Servier – Flebolinfología
Descargue este número Volver al resumen
de las extremidades inferiores:
actualización y recomendaciones actuales
Bourgoin-Jallieu, Francia
Resumen
Inicialmente, la trombosis venosa superficial (TVS) se consideró una enfermedad benigna o una complicación común de venas varicosas. Estudios recientes han demostrado la gravedad potencial de la TVS y han definido su lugar dentro de las enfermedades tromboembólicas venosas (TEV), junto con la trombosis venosa profunda (TVP) y la embolia pulmonar (EP). Se identificó una TVP concomitante en el 25-30% de los pacientes en el momento de la presentación y una EP en el 4-7% de los pacientes. Se notificaron TEV posteriores en el 3 al 20% de los pacientes, dependiendo de la duración del seguimiento. Hasta hace poco, se han probado numerosas estrategias anticoagulantes, sin un beneficio clínico claramente demostrado. Sin embargo, el reciente estudio CALISTO (Comparación de Arixtra en trombosis venosa superficial de miembros inferiores con placebo) validó un protocolo de tratamiento anticoagulante basado en fondaparinux, 2,5 mg al día durante 45 días, dando lugar a recomendaciones actualizadas para el tratamiento de la TVS. Este artículo presentará una actualización sobre el manejo de la TSV de la parte inferior de la pierna y las recomendaciones y directrices actuales. En resumen, todos los pacientes con TVS deben someterse a una exploración bilateral dúplex para confirmar el diagnóstico de TVS, determinar la ubicación y extensión precisas de la TVS y diagnosticar o descartar la presencia de TVP. Para pacientes con TVS sintomática de al menos 5 cm de longitud, se recomienda prescribir una dosis profiláctica de fondaparinux o heparina de bajo peso molecular durante 45 días sin anticoagulación (Grado 2B), y cuando el coste del tratamiento con fondaparinux sea aceptable, se recomienda utilizar 2,5 mg diarios de fondaparinux frente a heparina de bajo peso molecular (Grado 2C). Sin embargo, las recomendaciones y directrices han asignado a estos tratamientos un grado bajo, y quedan preguntas sobre el manejo de la TVS. Se han identificado algunos factores de riesgo para el desarrollo posterior de un TEV, pero se necesita más investigación para definir subgrupos de pacientes con una incidencia más alta de un TEV después de una TVS.
Introducción
La trombosis venosa superficial (TVS) se ha considerado una enfermedad benigna o una complicación común de las venas varicosas; sin embargo, estudios recientes han demostrado su gravedad potencial y han definido su lugar dentro de las enfermedades tromboembólicas venosas (TVS), junto con la trombosis venosa profunda (TVP) y la embolia pulmonar (EP).
La terapia anticoagulante se usa ampliamente hoy en día en lugar de los antiinflamatorios no esteroideos (AINE), que se usaban comúnmente hasta la última década. Un estudio reciente ha validado por primera vez un protocolo terapéutico.1 Sin embargo, quedan preguntas sobre el manejo de la TVS: (i) ¿se requiere terapia anticoagulante para tratar a todos los pacientes con TVS de las extremidades inferiores? ii) ¿deben utilizarse dosis profilácticas o terapéuticas? iii) ¿cuál es la duración recomendada del tratamiento?; (iv) ¿el tratamiento debe ser el mismo para la TVS que ocurre en venas varicosas y venas no varicosas?; v) ¿se pueden predecir los factores de riesgo de complicaciones del TEV después de la TVS?; y (vi) ¿sigue indicada la cirugía para el tratamiento de una TVS aguda?
Este artículo presentará la justificación de la actualización para el manejo de SVTs de las piernas y las recomendaciones y directrices actuales.
La incidencia de trombosis venosa superficial de los miembros inferiores
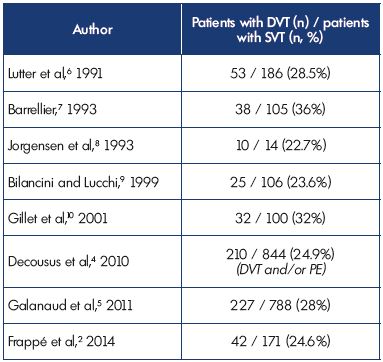
La TVS se considera una enfermedad común, pero la incidencia real en la población adulta sigue siendo desconocida. Un estudio reciente, realizado en Francia2, mostró que la tasa de diagnóstico anual fue de 0,6%. Fue mayor en las mujeres y aumentó con el avance de la edad, independientemente del género. Sorprendentemente, la tasa de diagnóstico anual de TVS fue menor de lo esperado y menor que la tasa de diagnóstico anual de TVP (aproximadamente la mitad de la TVP). Según otro estudio francés, realizado con métodos comparables, la incidencia anual de TVP y EP en miembros inferiores fue de 1,24% y 0,6%, respectivamente.3
Trombosis venosa superficial con trombosis venosa profunda concomitante en el momento de la presentación
Los estudios POST (Tromboflebitis Superficial Observacional Prospectiva) y OPTIMEV (Optimisation de l’Interrogatoire dans l’évaluation du risque throMbo – Embolique Veineux), dos grandes estudios observacionales y epidemiológicos, publicaron recientemente datos esenciales sobre la TVS.4,5 Un total de 844 pacientes con TVS de piernas fueron analizados en el estudio POST4,se identificó TVP o EP en el 25% de los pacientes con TVS en el momento de la presentación y se diagnosticó TVP proximal en el 9,7% de los pacientes. Cabe destacar que la TVP no fue contigua a la TVS en el 41,9% de los pacientes con TVP. Un total de 788 pacientes con TVP se incluyeron en el estudio OPTMEV5,en el que una TVP se asoció con una TVP en el momento de la inclusión en el 29% de los pacientes, con TVP distal en el 59,5% de estos pacientes (128/215; la localización exacta de la TVP no se encontró en 12 pacientes).
Estos datos confirman estudios previos que mostraron que la TVP se asoció con TVS en el 23-36% de los pacientes y muestran coherencia entre los diferentes estudios (Tabla I).2,4-10
Trombosis venosa superficial asociada a embolia pulmonar en el momento de la presentación
En el momento de la inclusión, se diagnosticó DP sintomático en el 3,9% y en el 6%.9% de los pacientes en los estudios POST y OPTIMEV, respectivamente. Sin embargo, la TVS con TEP, pero sin TVP, representó solo el 2,2% de todas las TVS con TVP o EP. Estos datos corroboran los hallazgos de estudios anteriores (Tabla II).2,4-7,9,10
En la práctica, un examen de exploración dúplex es obligatorio en pacientes con TVS para confirmar el diagnóstico (Figura 1), determinar la ubicación y extensión precisas de la TVS y diagnosticar o descartar la presencia de TVP.
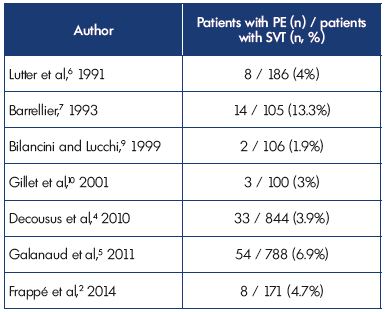
Tabla II. Trombosis venosa superficial con embolia pulmonar concomitante en el momento de la presentación.Abreviaturas: TVS: trombosis venosa superficial; TEP: embolia pulmonar.
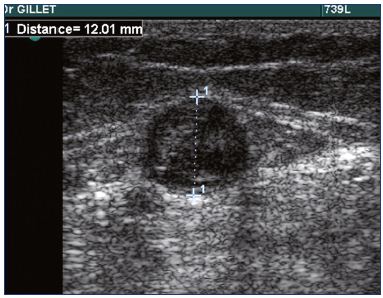
Figura 1. Ecografía de trombosis de la vena safena pequeña.

Resultado y recurrencia tromboembólica venosa
En la literatura, la tasa de recurrencia tromboembólica varía de 3 a 20% dependiendo de la duración del seguimiento. En un estudio personal13,reportamos la aparición de ETV sintomáticos en el 16,4% de los pacientes con TVS aislada, con un seguimiento medio de 14,5 meses. Los eventos de TEV incluyeron TVP (31%), EP (6%), otra TVS en un sistema safeno diferente (37,5%) y una TVS recurrente en el mismo sistema safeno (25%).
En el estudio POST, 4 8.el 3% de los pacientes con una TVS aislada en el momento de la inclusión desarrollaron al menos 1 episodio de TEV sintomático a los 3 meses (TVP sintomática, 2,8%; EP sintomática, 0,5%; extensión sintomática de la TVS, 3,3%; y recidiva sintomática de la TVS, 1,9%). En el estudio OPTIMEV,el 5,3% de los pacientes con TVS aislada y el 5,4% de los pacientes con TVS asociada a TVP en el momento de la presentación desarrollaron un TEV a los 3 meses; la tasa de TEV fue del 12,5% a los 3 años de seguimiento. En el estudio de Dewar y Panpher14,se presentó una TVP sintomática en el 4% de los pacientes con una TVS aislada a los 6 meses de seguimiento.
Estos hallazgos epidemiológicos muestran la gravedad potencial de la TVS. Ya no deben considerarse una afección benigna. En consecuencia, ahora se ha definido claramente su lugar dentro de las enfermedades del TEV.
Factores de riesgo para desarrollar un evento tromboembólico
En un análisis multivariante del estudio post4, se identificó el sexo masculino, los antecedentes de TVP o EP, el cáncer previo y la ausencia de venas varicosas como factores de riesgo para un TEV sintomático a los 3 meses, incluida la recidiva o extensión de la TVS. En el estudio STENOX (Tromboflebitis superficial tratada con enoxaparina) 15,se identificaron como factores predictivos independientes de un TEV (TVP o EP), sexo masculino e insuficiencia venosa crónica grave a los 3 meses. Solo la insuficiencia venosa crónica grave fue un factor predictivo independiente para TVP o EP. En un análisis agrupado de los estudios POST y OPTIMEV16,Galanaud et al mostraron que el sexo masculino, el cáncer, los antecedentes personales de TEV y el compromiso safenofemoral o safenopoplíteo aumentaron significativamente el riesgo de un TEV o TVP/ EP subsecuente en un análisis univariado. En los análisis multivariados, solo el sexo masculino aumentó significativamente el riesgo de una TEV posterior o una recurrencia de TVP/EP. Para el cáncer y los antecedentes personales de ETV, los cocientes de riesgos instantáneos ajustados fueron solo ligeramente inferiores al nivel de significación estadística (P=0,06 para ambos), lo que indica que, para estos factores, el estudio simplemente carecía de suficiente poder estadístico.
En el estudio STEFLUX (Tromboembolismo superficial FLUXum) 17, un índice de masa corporal (IMC) entre 25 y 30 kg/m2 y una combinación de TVS y/o TEV previos y/o antecedentes familiares de TEV se identificaron como factores de riesgo independientes significativos para un evento de TVS (combinación de TVP sintomática y asintomática, EP y recurrencia o extensión de TVS).
Estado de las venas varicosas
Se ha notificado que el estado de las venas varicosas influye en el riesgo de presentar TVP en el momento de la presentación. En los estudios POST4 y OPTIMEV, 5 SVT que se produjeron en una vena no varicosa (NVV–SVT) se asociaron con mayor frecuencia con una TVP o EP concomitante que las SVT que se produjeron en una vena varicosa (VV-SVT). Hallazgos similares fueron reportados por Gorty et al.
En el seguimiento de 3 meses en el estudio OPTIMEV, la TVV-TVS aislada no se asoció con un mayor riesgo de desenlaces adversos (es decir, muerte, recurrencia del TEV y hemorragia). La TVV-TVS aislada tuvo una asociación más alta con recurrencia sintomática de TVP o EP (2,7 frente a 0,6%), pero este resultado no alcanzó significación estadística (P=0,07).
En el estudio POSTERIOR, la ausencia de venas varicosas se identificó como un factor de riesgo para el desarrollo posterior de un TEV sintomático en pacientes con una TVS sintomática aislada en el momento de la presentación (P=0,049). En el estudio STEFLUX17, la ausencia de venas varicosas fue un factor de riesgo de TEV (P=0,004) tras la interrupción del tratamiento con heparina de bajo peso molecular.
En el grupo de placebo del estudio CALISTO (Comparación de Arixtra en trombosis venosa superficial de las extremidades inferiores con placebo) 1,las complicaciones tromboembólicas ocurrieron con mayor frecuencia cuando la TVS afectaba a la gran vena safena (VSG), se extendía a menos de 10 cm de la unión safenofemoral (JSF), afectaba venas por encima de la rodilla y en pacientes con antecedentes de TEV.
La estasis venosa es el mecanismo principal de la TVS en pacientes con venas varicosas. La inflamación puede desempeñar un papel esencial en la formación de trombo en pacientes sin venas varicosas; por lo tanto, confiere un mayor riesgo de tromboembolia clínicamente más grave. No se recomienda el cribado de trombofilia para el manejo rutinario de pacientes con TVV-TVS, aunque los datos de la literatura mostraron que la trombofilia era frecuente en esta situación. En un estudio prospectivo,10 hemos identificado trombofilia en el 50% de los pacientes con NVV-SVT, mientras que sólo el 15% de los pacientes con VV-SVT había trombofilia. En otro estudio prospectivo en el que participaron 42 pacientes con TVV-TVS19,identificamos trombofilia en 20 (47,6%) pacientes. La trombofilia más frecuente se debió a la mutación heterocigótica del factor V de Leiden. En un estudio en el que participaron 63 pacientes con TVV-TVS aisladas20,Martinelli et al identificaron trombofilia en el 30% de los pacientes. Se recomienda la detección de trombofilia, después de la exclusión de un cáncer oculto, especialmente para pacientes con progresión de trombo a pesar del tratamiento anticoagulante adecuado.11,21
Tratamiento de la trombosis venosa superficial
El tratamiento de la TVS siempre ha sido un tema controvertido. Se reportan grandes variaciones en el tratamiento, especialmente en lo que se refiere a la terapia anticoagulante. El estudio POST4, realizado en Francia entre marzo de 2005 y octubre de 2006, proporcionó información interesante sobre el tratamiento de la TSV. Un total de 634 pacientes tenían una TVS aislada en el momento de la inclusión. La información sobre el tratamiento que recibieron durante el período de observación de 3 meses estuvo disponible para 597 pacientes, siendo que el 90,5% de los pacientes recibieron uno o más fármacos anticoagulantes. De los pacientes que recibieron terapia anticoagulante, el 63% recibió dosis terapéuticas, el 36,7% dosis profilácticas y el 16,8% antagonistas de la vitamina K. La duración del tratamiento fue muy variable. Un total de 47.el 2% de los pacientes recibió un AINE tópico, el 8,2% un AINE oral y el 10% se sometió a cirugía venosa (extracción o ligadura alta).
Estos datos muestran la necesidad de aclarar el papel de la terapia anticoagulante en SVT gestión. El uso de terapia anticoagulante en pacientes con TVS fue reportado por primera vez en 1962 por Zollinger et al22,después de observar la aparición de un TEP, que fue fatal en 34 (10,1%) de una serie de 335 pacientes con TVS. Hasta hace poco, aunque se habían probado numerosas estrategias anticoagulantes, incluida la heparina no fraccionada o la heparina de bajo peso molecular, a dosis profilácticas o terapéuticas durante varios períodos, ninguna había demostrado claramente ningún beneficio clínico.
El estudio STENOX23 fue un ensayo aleatorizado doble ciego en el que participaron 427 pacientes, en el que se comparó heparina de bajo peso molecular (enoxaparina a dosis terapéuticas y profilácticas) con AINE y placebo. Los pacientes fueron tratados durante 10 días, con un seguimiento de 3 meses. A los 10 días, hubo más TEV en el grupo placebo (P24 comparó dosis terapéuticas frente a profilácticas de nodraparina en 163 pacientes con una TVS aislada en el VSG, y los pacientes fueron tratados durante 1 mes. A los 3 meses de seguimiento, los resultados fueron similares en ambos grupos (7,2% y 8,6% de aparición de TEV, respectivamente; P = 0,7), sin que se observara beneficio de la dosis terapéutica. Se observó un fenómeno de «recuperación» o rebote durante el seguimiento, ya que se notificaron muchos TEV, especialmente en el grupo de pacientes tratados con la dosis terapéutica. También se observó un fenómeno de «recuperación» después de interrumpir el tratamiento con heparina de bajo peso molecular después de 1 mes en el estudio STEFLUX.25 Estos hallazgos, al igual que los del ensayo STENOX, abogan por la elección de dosis profilácticas de heparina de bajo peso molecular en la TVS. La aparición de la mayoría de los TEV durante los 2 y 3 meses posteriores a la interrupción del tratamiento con heparina de bajo peso molecular en el grupo que recibió dosis terapéuticas, vuelve a poner de relieve la cuestión de la duración óptima de la terapia anticoagulante.
El estudio aleatorizado, doble ciego CALISTO 1 comparó fondaparinux 2,5 mg diarios durante 45 días con placebo en 3.002 pacientes con una TVS sintomática aislada de las extremidades inferiores de al menos 5 cm de longitud. Los principales criterios de exclusión fueron el tratamiento del cáncer en los 6 meses anteriores, TVP o EP en los 6 meses anteriores, TVS localizada a menos de 3 cm del SFJ e insuficiencia renal grave (aclaramiento de creatinina 26 la dosis de 2,5 mg de fondaparinux se seleccionó con la idea de que una dosis profiláctica sería suficiente para tratar a los pacientes con TVS. Además, esta dosis demostró ser más eficaz en la prevención de TEV después de una cirugía ortopédica mayor que una dosis profiláctica de heparina de bajo peso molecular, y tan eficaz como la dosis terapéutica de heparina de bajo peso molecular en pacientes con síndromes coronarios agudos, lo que sugiere que 2,5 mg de fondaparinux coincidiría con las recomendaciones del Colegio Americano de Médicos Torácicos (ACCP) de 200827, que abogan por el uso de dosis profilácticas o intermedias de heparina de bajo peso molecular para tratar pacientes con TVS. Se eligió la duración de 45 días porque un periodo de tratamiento de 30 días o menos podría ser demasiado corto, ya que la mayoría de los TEV sintomáticos se producen tras la interrupción del tratamiento. El resultado primario de eficacia fue una combinación de muerte por cualquier causa, una EP sintomática, una TVP sintomática, una extensión sintomática a la SFJ o una recurrencia sintomática de la TVS en el día 47. Hubo un período de seguimiento de 77 días para los pacientes.
El resultado primario de eficacia se produjo en el 0,9% de los pacientes del grupo de fondaparinux y en el 5.9% en el grupo placebo (P28

Es interesante observar el cambio de recomendaciones de las pautas de la ACCP de 2008.27 Sin embargo, debemos tener en cuenta que son recomendaciones de bajo grado (Grado 2B o 2C).
En la actualización de la Revisión Sistemática de la Base de Datos Cochrane sobre «Tratamiento de la tromboflebitis superficial de la pierna»29,30, Di Nisio et al llegaron a las mismas conclusiones. Esta revisión se basó en el análisis de 30 ensayos controlados aleatorios con 6.507 participantes con TVS de las piernas. Los autores concluyen que una dosis profiláctica de fondaparinux, administrado durante 6 semanas, parece ser una opción terapéutica válida para SVT de las piernas. La evidencia sobre los tratamientos orales, tópicos o quirúrgicos es demasiado limitada y no proporciona información para su uso en la práctica clínica sobre los efectos de estos tratamientos en términos de progresión de TEV y TVS.
Cirugía versus terapia anticoagulante
Una revisión de los estudios que comparan la cirugía con la terapia anticoagulante no muestra ningún beneficio para el tratamiento quirúrgico. Las tasas de progresión de la TVS fueron similares, mientras que la incidencia de TEV y complicaciones fue mayor con la cirugía.31 Lozano et al no mostraron diferencia entre cirugía y enoxaparina durante 4 semanas.32
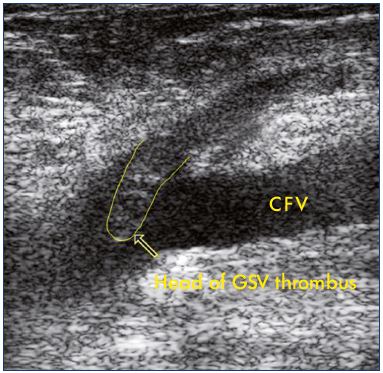
Figura 2. Ecografía de una extensión de una trombosis de la vena safena grande en la vena femoral común.Abreviaturas: CFV, vena femoral común; VSG, vena safena grande
Figura 3. Trombosis de la unión safenofemoral.Imagen cortesía del Dr. Nicolini.

En la práctica, la mayoría de los expertos recomiendan tratar a los pacientes con TVS extendida en el SFJ o SPJ con terapia anticoagulante a dosis terapéuticas durante 3 meses.
Conclusión
La TSV ya no debe considerarse una enfermedad benigna. Estudios epidemiológicos recientes, que han incluido a un gran número de pacientes, han demostrado la gravedad potencial de las TSV y han definido claramente su lugar dentro de las enfermedades de TEV. Se identificó una TVP concomitante en el 25-30% de los pacientes en el momento de la presentación y una EP en el 4-7% de los pacientes. En consecuencia, todos los pacientes con TVS deben someterse a una exploración bilateral dúplex para confirmar el diagnóstico de TVS, determinar la ubicación y extensión precisas de la TVS y diagnosticar o descartar la presencia de TVP. Hoy en día, el manejo de la TVS ha cambiado, y la terapia anticoagulante se usa ampliamente en lugar de los AINE. Hasta el reciente estudio CALISTO, ningún protocolo anticoagulante había demostrado un beneficio clínico claro. Las recomendaciones se actualizaron después de que el estudio CALISTO validara el protocolo de tratamiento anticoagulante basado en fondaparinux 2,5 mg al día durante 45 días. Para pacientes con una TVS sintomática de las piernas de al menos 5 cm de longitud, se recomienda una dosis profiláctica de fondaparinux o heparina de bajo peso molecular durante 45 días en lugar de no anticoagulación (Grado 2B). Cuando el coste del tratamiento con fondaparinux sea aceptable, se recomienda el uso de fondaparinux 2,5 mg al día sobre una dosis profiláctica de heparina de bajo peso molecular (Grado 2C). Sin embargo, las recomendaciones y directrices son de baja calidad, y quedan preguntas sobre el manejo de la TSV. Se han identificado algunos factores de riesgo para el desarrollo posterior de un TEV, pero se necesita más investigación para definir claramente subgrupos de pacientes con una mayor incidencia de TEV después de una TVS.
1. D ecousus H, Prandoni P, Mismetti P, et al; Grupo de Estudio CALISTO. Fondaparinux para el tratamiento de la trombosis venosa superficial en las piernas. N Engl J Med. 2010;363:1222-1232.
2. Frappé P, Buchmuller-Cordier A, Bertoletti L, et al; Grupo de Estudio STEPH. Tasa de diagnóstico anual de trombosis venosa superficial de las extremidades inferiores: el estudio comunitario de STEPH. J Thromb Haemost. 2014;12:831-838.
3. Oger E; Grupo de Estudio EPI-GETBO. Incidencia de tromboembolismo venoso: un estudio de base comunitaria en el oeste de Francia. Trombo Hemostático. 2000;83:657- 660.
4. D ecousus H, Quéré I, Presles E, et al; Grupo de Estudio posterior. Trombosis venosa superficial y tromboembolismo venoso: un estudio epidemiológico prospectivo a gran escala. Ann Intern Med. 2010;152:218-224.
5. G alanaud JP, Genty C, Sevestre MA, et al; OPTIMEV Investigadores de SFMV. Factores predictivos de trombosis concurrente de la veína profunda y recurrencia tromboembólica venosa sintomática en caso de trombosis venosa superficial. Trombo Hemostático. 2011;105:31-39.
6. Lutter KS, Kerr TM, Roedersheimer R, Lohr JM, Sampson MG, Cranley JJ. Tromboflebitis Superficial diagnosticada por escaneo dúplex. Cirugía. 1991;100:42-46.
7. Barrellier MT. Trombosis veineuses superficielles des membres aquellas . Actual Vasc Int. 1993;17:7-9.
8. Jorgensen JO, Hanel KC, Mogan AM, Hunt JM. La incidencia de trombosis venosa profunda en pacientes con tromboflebitis superficial de las extremidades inferiores. J Vasc Surg. 1993; 18: 70-73.
9. Bilancini S, Lucchi M. Les thromboses veineuses superficielles sont-elles polymorphes ? Phlébologie. 1999;52:41-43.
10. G illet JL, Perrin M, Cayman R. Trombosis venosa superficial de las extremidades inferiores: análisis prospectivo en 100 pacientes . J Mal Vasc. 2001;26:16-22.
11. Kalodiki E, Stvrtinova V, Allegra C, et al. Trombosis venosa superficial: una declaración de consenso. Angiol intravenoso. 2012;31:203-216.12. Nicolaides A. Trombosis venosa superficial en la prevención y el tratamiento del tromboembolismo venoso. Angiol intravenoso. 2013;32:237-242.13. G illet JL, Perrin M, Cayman R. Recurrencia tromboembólica después de tromboflebitis superficial de las extremidades inferiores. J Flebología. 2002;2:103-118.14. D ewar C, Panpher S. Incidencia de trombosis venosa profunda en pacientes diagnosticados con tromboflebitis superficial después de presentarse en un servicio ambulatorio de trombosis venosa profunda del departamento de emergencias. Emerg Med J. 2010; 27: 758-761.15. Quenet S, Laporte S, Décousus H, Leizorovicz A, Epinat M, Mismetti P; Grupo STENOX. Factores predictivos de complicaciones trombóticas venosas en pacientes con trombosis venosa superficial aislada. J Vasc Luchando 2003;38:944 – 949.16. G alanaud JP, Bosson JL, Genty C, et al. Trombosis venosa superficial y tromboembolismo venoso recurrente: un análisis conjunto de dos estudios observacionales. J Thromb Haemost. 2012;10:1004-1011.17. Cosmi B, Filippini M, Campana F, et al; Investigadores de STEFLUX. Factores de riesgo de acontecimientos recurrentes en sujetos con trombosis venosa superficial en el ensayo clínico aleatorizado SteFlux (Tromboembolismo superficial Fluxum). Thromb Res. 2014; 133: 196-202.18. G orty S, Patton-Adkins J, DaLanno M, Starr J, Dean S, Satiani B. Trombosis venosa superficial de las extremidades inferiores: análisis de factores de riesgo, recurrencia y papel de la anticoagulación. Vasc Med. 2004;9:1-6.19. G illet JL, Allaert FA, Perrin M. Tromboflebitis superficial en venas no varicosas de las extremidades inferiores. Análisis prospectivo en 42 pacientes . J Mal Vasc. 2004;29:263-272.20. Martinelli I, Cattaneo M, Taioli E, de Stefano V, Chiusolo P, Mannucci PM. Factores de riesgo genéticos para trombosis venosa superficial. Trombo Hemostático. 1999;82:1215-1217.21. Milio G, Siragusa S, Malato A, Grimaudo S, Pinto A. Trombosis venosa superficial: papel de la deficiencia hereditaria de anticoagulantes naturales en extensión a venas profundas. Angiol intravenoso. 2009;28:298- 302.22. Zollinger RW, Williams RD, Briggs DO. Problemas en el diagnóstico y tratamiento de la tromboflebitis. Arch Surg. 1962; 85: 34-40.23. D ecousus H; Grupo de Estudio de Enoxaparina. Comparación piloto aleatorizada doble ciego de una heparina de bajo peso molecular, un agente antiinflamatorio no esteroideo y un placebo en el tratamiento de la trombosis venosa superficial. Arch Int Med. 2003;163:1657-1663.24. Prandoni P, Tormene D, Pesavento R; Grupo de Investigadores Vesalio. Dosis altas vs. bajas de heparina de bajo peso molecular para el tratamiento de la trombosis venosa superficial de las piernas: un ensayo aleatorizado doble ciego. J Thromb Haemost. 2005;3:1152-1157.25. Cosmi B, Filippini M, Tonti D, Avruscio G, Ghirarduzzi A, Bucherini E; STEFLUX Investigators. Un estudio aleatorizado doble ciego de heparina de bajo peso molecular (parnaparina) para trombosis venosa superficial: STEFLUX (tromboembolismo superficial y Fluxum). J Thromb Haemost. 2012;10:1026-1035.26. D ecousus H, Frappé P, Accassat S, et al. Epidemiología, diagnóstico, tratamiento y manejo de la trombosis venosa superficial de las piernas. El mejor Hematol de Pract Res Clin. 2012;25:275-284.27. Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ; Colegio Americano de Médicos de Tórax. Terapia antitrombótica para la enfermedad tromboembólica venosa: Guías de Práctica Clínica Basadas en la Evidencia del Colegio Americano de Médicos de Tórax (8a Edición). Pecho. 2008; 133 (suppl 6): 454S-545S.
28. Kearon C, Akl EA, Comerota AJ, et al; Colegio Americano de Médicos de Tórax. Terapia antitrombótica para la enfermedad de TEV: Terapia Antitrombótica y Prevención de Trombosis, 9a ed: American College of Chest Physicians Guía de Práctica Clínica Basada en la Evidencia. Pecho. 2012; 141 (suppl 2): e419S-e494S.
29. D i Nisio M, Wichers IM, Middeldorp S. Tratamiento para la tromboflebitis superficial de la pierna. Cochrane Database Syst Rev. 2013; 30; 4: CD004982.30. D i Nisio M, Middeldorp S. Tratamiento de la tromboflebitis superficial de las extremidades inferiores. JAMA. 2014;311:729- 730.31. Sullivan V, Denk PM, Sonnad SS, Eagleton MJ, Wakefield TW. Ligadura versus anticoagulación: tratamiento de la tromboflebitis superficial por encima de la rodilla que no afecta al sistema venoso profundo. J Am Coll Surg. 2001; 193: 556-562.32. Lozano FS, Almazán A. Heparina de bajo peso molecular versus desconexión safenofemoral para el tratamiento de la tromboflebitis safena mayor por encima de la rodilla: un estudio prospectivo. Cirugía endovascular Vasc. 2003; 37: 415-420.33. Chengelis DL, Bendick PJ, Glover JL, Brown OW, Ranval TJ. Progresión de la trombosis venosa superficial a trombosis venosa profunda. J Vasc Surg. 1996; 24: 745-749.34. Hingorani A, Ascher E. Tromboflebitis venosa superficial. En: Gloviczki P, ed. Manual de Trastornos Venosos. Guidelines of the American Venous Forum (en inglés). 3rd ed. Londres, Reino Unido: Hodder Arnold; 2009: 314-319.
Leave a Reply