Química: ¿Qué son los Ácidos y las Bases?
¿Qué son los Ácidos y las Bases?
Aunque les he dicho que los ácidos y las bases no son difíciles de entender, tengo malas noticias: No hay una, sino tres definiciones comunes utilizadas para describir ácidos y bases: ácidos y bases de Arrhenius, ácidos y bases de Brnsted-Lowry, y ácidos y bases de Lewis. Aunque esto hace que suene como si tuviera que aprender sobre ácidos y bases tres veces, la buena noticia es que para muchos propósitos prácticos, estas tres definiciones son aproximadamente equivalentes.
Ácidos y bases de Arrhenius
A finales de 1800, nuestro viejo amigo Svante Arrhenius ideó definiciones de ácidos y bases mientras trabajaba en problemas de cinética.
Según Arrhenius, los ácidos son compuestos que se rompen en el agua para emitir iones de hidronio (H+). Un ejemplo común de ácido Arrhenius es el ácido clorhídrico (HCl):
- HCl ? H + + Cl –
Las fórmulas para ácidos generalmente comienzan con hidrógeno, aunque los ácidos orgánicos son una excepción notable. Los nombres y las fórmulas de algunos ácidos se encuentran en la tabla a continuación:
| Ácido Nombre | Fórmula |
|---|---|
| ácido clorhídrico | HCl |
| ácido nítrico | HNO3 |
| ácido fosfórico | H3PO4 |
| ácido sulfúrico | H2SO4 |
| ácido acético | C2H4O2 |
bases de Arrhenius se definen como compuestos que causan la formación del hidróxido de iones cuando se coloca en agua. Un ejemplo de una base de Arrhenius es el hidróxido de sodio (NaOH):
- NaOH ? Na + + OH –
Las bases suelen tener » OH » en sus fórmulas, aunque hay excepciones. Por ejemplo, el amoníaco (NH3) no contiene iones hidróxido, sino que los forma cuando reacciona con el agua:
- NH3 + H2O ? NH4 + + OH –
Los nombres y fórmulas de algunas bases comunes se encuentran en la siguiente tabla:
| Nombre | Fórmula |
|---|---|
| amoníaco | NH3 |
| hidróxido de potasio | KOH |
| bicarbonato de sodio | NaHCO3 |
| carbonato de sodio | Na2CO3 |
| hidróxido de sodio | NaOH |
Algunos de los óxidos ácidos o bases cuando se añade agua. Debido a que estos compuestos no contienen iones H + u OH-a menos que reaccionen con el agua, se les llama «anhídridos».»Típicamente, los óxidos de no metales son anhídridos ácidos (forman ácido cuando se colocan en agua), y los óxidos de metales son anhídridos de base (forman una base cuando se colocan en agua).
Brnsted-Ácidos y bases Lowry
A principios de 1900, Johannes Brnsted y Thomas Lowry propusieron una definición alternativa de ácidos y bases para explicar el hecho de que el amoníaco puede neutralizar la acidez del HCl incluso si no hay agua presente. Este fenómeno les mostró que el amoníaco es una base, incluso cuando no hay agua alrededor para formar iones de hidróxido.
Hay muchos nombres y fórmulas diferentes utilizados para describir el ion hidronio. Aunque la fórmula se mostraba anteriormente como » H+», a veces se escribe como» H3O » porque este es el ion formado cuando H+ se combina con agua. Otra forma común de referirse a los iones de hidronio es simplemente llamarlos «protones».»Este nombre proviene del hecho de que H+ representa un átomo de hidrógeno (un protón y un electrón) que ha perdido su electrón, dejando solo el protón desnudo detrás.
Un ácido Brnsted-Lowry se define como un compuesto que da iones de hidronio a otro compuesto?por ejemplo, el ácido clorhídrico da iones H+ a los compuestos con los que reacciona. Las bases Brnsted-Lowry son compuestos que pueden aceptar iones de hidronio?cuando el amoníaco obtiene un ion hidronio del HCl, forma el ion amonio.
La siguiente ecuación representa la reacción de un ácido Brnsted-Lowry con una base Brnsted-Lowry:
- HNO3 + NH3 ? NO3 – + NH4 +
En esta reacción, el ácido nítrico se comporta como un ácido porque da un protón al amoníaco. El amoníaco se comporta como una base porque acepta el protón del ácido nítrico.
Sin embargo, si echas un vistazo al otro lado de la ecuación, encontramos los iones nitrato y amonio. Debido a que el ion nitrato puede aceptar protones del ion amonio (para formar HNO3), el ion nitrato es una base muy débil de Brnsted-Lowry. Debido a que el ion amonio tiene un protón adicional para donar (en este caso al ion nitrato), es un ácido Brnsted-Lowry.
El ion nitrato se basa en la molécula de ácido nítrico, por lo que decimos que es la base conjugada del ácido nítrico. Del mismo modo, el ion amonio es el ácido conjugado del amoníaco. Juntos, un ácido con su base conjugada (como HNO3 y NO3 -) o una base con su ácido conjugado (como NH3 y NH4+) se conoce como un par ácido-base conjugado.
Ácidos y bases de Lewis
En la definición Brnsted-Lowry de ácidos y bases, una base se define como un compuesto que puede aceptar un protón. Sin embargo, ¿cómo acepta el protón?
Una característica que las bases Brnsted-Lowry tienen en común es que tienen un par de electrones no compartidos. Cuando un ion hidronio viene deambulando por la molécula, a veces los pares solitarios lo alcanzan y lo agarran. Un ejemplo de esto es cuando el amoníaco acepta un protón en una solución ácida:
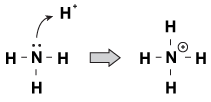
Figura 23.1 El amoníaco puede tomar un protón del ácido nítrico con su par solitario de electrones.
Una forma de ver este proceso es que el átomo de amoníaco está donando su par solitario al protón. Debido a que los pares solitarios están impulsando esta reacción química, tenemos una nueva definición de acidez y basicidad, llamada «acidez/basicidad de Lewis».»Una base de Lewis es un compuesto que dona un par de electrones a otro compuesto (el amoníaco en nuestro ejemplo). Un ácido de Lewis es un compuesto que acepta un par de electrones (el ion H+ en nuestro ejemplo).
Las bases Lewis son sustancias químicas que pueden donar pares de electrones. Los ácidos de Lewis son químicos que pueden aceptarlos.
Aunque en nuestro ejemplo, el amoníaco donaba un par solitario a un protón, el par solitario en amoníaco también puede reaccionar con muchos otros compuestos. Por ejemplo, el amoníaco puede donar su par solitario de electrones al BH3 mediante el siguiente proceso:

Figura 23.2 El par solitario del amoníaco que se une al BH3.
En este proceso, el amoníaco es la base de Lewis y el BH3 es el ácido de Lewis.
Generalmente, la definición de Lewis de ácidos y bases es la más útil porque es la más inclusiva de las tres definiciones. Por ejemplo, la definición Brnsted-Lowry de un ácido incluye HF pero no BH3, que no pierde un protón cuando está unido por los pares solitarios en una base de Lewis.
Extraído de The Complete Idiot’s Guide to Chemistry 2003 de Ian Guch. Todos los derechos reservados, incluido el derecho de reproducción total o parcial en cualquier forma. Utilizado por acuerdo con Alpha Books, miembro de Penguin Group (USA) Inc.
Para pedir este libro directamente a la editorial, visite el sitio web de Penguin USA o llame al 1-800-253-6476. También puede comprar este libro en Amazon.com y Barnes & Noble.
Leave a Reply