Pros y contras de las pruebas prenatales
El objetivo de la detección y el diagnóstico prenatales es identificar anomalías cromosómicas, condiciones genéticas y anomalías estructurales en el feto antes del nacimiento.
Las opciones de detección y diagnóstico incluyen una variedad de pruebas no invasivas e invasivas en diferentes etapas del embarazo, y han avanzado a pasos agigantados en los últimos 40 años, en paralelo con cambios sociales y demográficos significativos durante ese tiempo.
En Australia, en 2013, la edad media de las mujeres que dieron a luz era de 30,1 años, en comparación con 29,5 en 2003, mientras que la proporción de madres de 35 años o más aumentó del 19% en 2003 al 22% en 2013, y la edad media de las madres primerizas también aumentó, de 27,8 años en 2003 a 28,6 en 20131
Hace cuarenta años, la edad materna era la única herramienta de detección disponible identificar embarazos en riesgo de anomalías cromosómicas. Desde entonces, la disponibilidad de pruebas prenatales no invasivas cada vez más baratas y precisas ha significado que las mujeres de todas las edades ahora pueden tener mejores opciones de pruebas prenatales.
Cuando se enfrentan a las muchas opciones para las pruebas prenatales, algunas parejas pueden sentirse abrumadas, mientras que a los médicos les puede resultar difícil mantenerse al día con todos los detalles de las nuevas pruebas. Pero el asesoramiento es vital para garantizar que las parejas sean plenamente conscientes del proceso de pruebas desde las perspectivas física, emocional, práctica y financiera.
La primera y más importante pregunta es: ¿debería la pareja considerar la realización de pruebas prenatales? Algunas parejas nunca discuten el tema hasta que quedan embarazadas, y muchas nunca han considerado la posibilidad de tener un bebé con un problema cromosómico, como el síndrome de Down, o un defecto de nacimiento, como el labio leporino.
Por otro lado, en estos días, la mejora de la alfabetización sanitaria significa que muchas parejas están informadas y son proactivas, y algunas quieren que cada prueba esté disponible para garantizar que sus bebés estén sanos.
La siguiente pregunta se refiere a qué pruebas se deben realizar y si deben ser pruebas de detección o de diagnóstico. Por definición, una prueba de detección encuesta a una población para identificar a aquellos individuos con mayor riesgo de tener una determinada afección, mientras que una prueba de diagnóstico determina si un individuo tiene una afección en particular. En el contexto de las pruebas prenatales, las pruebas de detección incluyen ecografías, pruebas bioquímicas y pruebas prenatales no invasivas (NIPT), mientras que las pruebas de diagnóstico son el muestreo de vellosidades coriónicas (CVS) y la amniocentesis.
Finalmente, cuando se habla con las parejas sobre las pruebas, están los problemas prácticos de costo y acceso, que estarán influenciados en gran medida por el estado socioeconómico del paciente. Muchos servicios de ultrasonido de alta calidad y otras pruebas no son reembolsables por Medicare y, por lo tanto, inasequibles para algunos pacientes.
Por supuesto, el hecho de que haya una prueba disponible no significa que deba realizarse, y las parejas que se embarquen en pruebas prenatales deben hacerlo con los ojos bien abiertos para evitar terminar en una montaña rusa de pesadilla cuando se les derive para «todas las pruebas».
Con este fin, el asesoramiento previo a la prueba es vital para que las parejas comprendan las posibilidades maternas relacionadas con la edad de un bebé con un problema cromosómico importante, y luego puedan sopesarlas con los riesgos y beneficios de las diversas pruebas que se ofrecen.
Las parejas necesitan entender exactamente lo que las pruebas pueden y no pueden detectar, y, lo más fundamental, exactamente por qué se están haciendo la prueba. En esta etapa es necesario responder a preguntas difíciles: ¿considerarían la interrupción de un embarazo si a un feto se le diagnosticara síndrome de Down? ¿El diagnóstico informaría el manejo y la planificación para el parto si también se descubriera que un feto con síndrome de Down tiene un defecto cardíaco importante que requiere cirugía cardíaca neonatal?
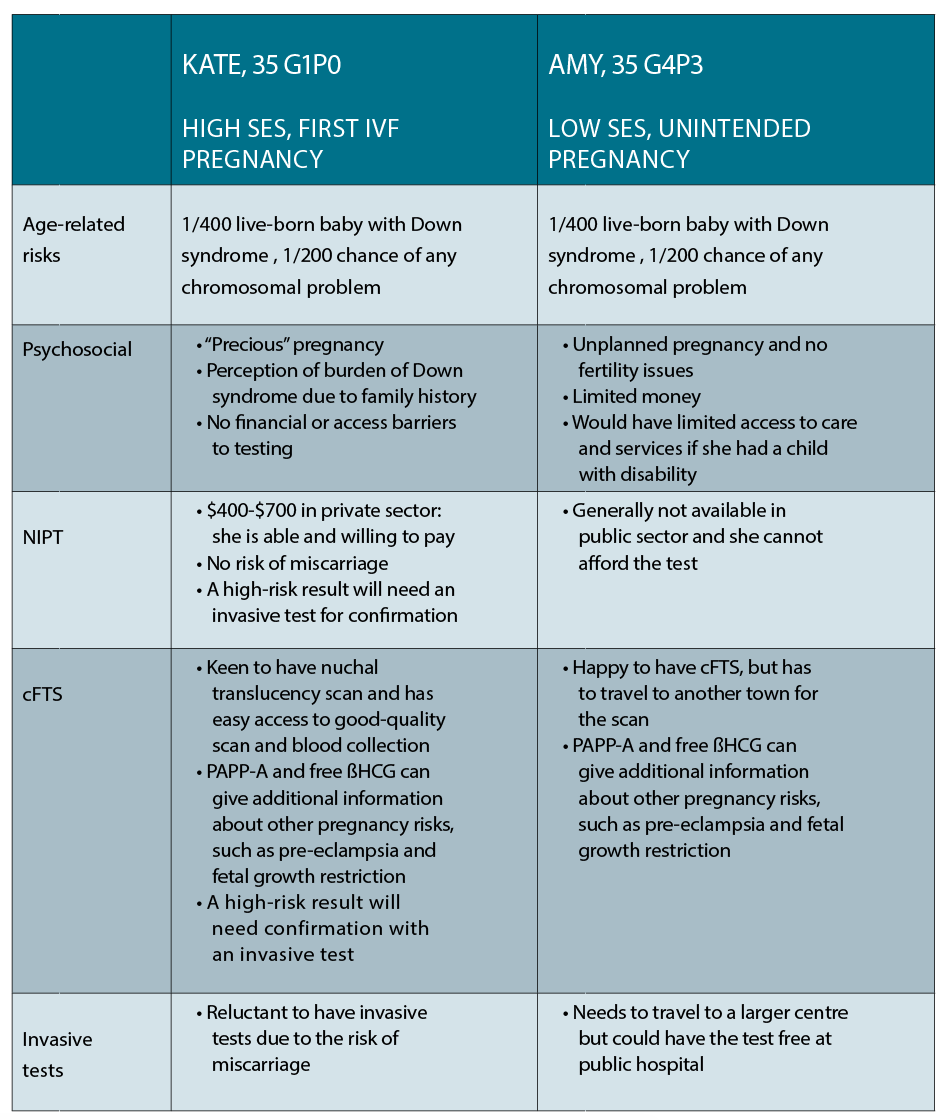
Este artículo considera dos escenarios de casos comunes y la gama de opciones de pruebas prenatales disponibles para ambos.
Caso 1
Kate es una abogada corporativa de 35 años que vive en el centro de la ciudad y que ha concebido su primer embarazo en su cuarto ciclo de fecundación in vitro. Ahora está embarazada de 10 semanas y quiere saber las opciones disponibles para su diagnóstico prenatal. Tiene un primo con síndrome de Down y está muy preocupada por su propio riesgo de tener un bebé con la misma afección.
Caso 2
Amy también tiene 35 años y vive en un pequeño pueblo de Nueva Gales del Sur. Ella y su pareja tienen tres hijos pequeños y están luchando financieramente, y tiene 10 semanas de embarazo no deseado. Ella quiere saber sus opciones para las pruebas prenatales, ya que una de sus amigas dio a luz recientemente a un niño con síndrome de Down.

Las parejas necesitan comprender exactamente lo que las pruebas pueden y no pueden detectar
PRUEBAS NO INVASIVAS
Una ecografía temprana del primer trimestre, o de datación, se realiza entre siete y 12 semanas, y es útil para confirmar la presencia de un embarazo viable y determinar si hay un embarazo múltiple. También permite la datación precisa de la gestación, ayuda a excluir un embarazo ectópico y a localizar la placenta. No se realiza para detectar defectos de nacimiento.
Una exploración de translucidez nucal se realiza entre 11 semanas y tres días, y 13 semanas y seis días (longitud de la grupa de la corona fetal de 45-84 mm), idealmente como parte de la «detección combinada del primer trimestre». La translucencia nucal es un espacio lleno de líquido en la parte posterior del cuello fetal que se puede medir por ultrasonido. Es bien sabido que cuanto mayor sea la translucencia nucal, mayor será el riesgo de anomalías fetales, incluidos problemas cromosómicos como el síndrome de Down, así como defectos cardíacos estructurales y algunos trastornos de un solo gen.
Hasta la fecha, la recomendación ha sido que la exploración de translucencia nucal se realice junto con un cribado bioquímico materno como un cribado combinado del primer trimestre (CFTs), que mide PAPP-A y ßhCG libre para mejorar las tasas de detección del síndrome de Down.
Solo, la exploración de translucencia nucal tiene una tasa de detección de alrededor del 65% al 70% para el síndrome de Down, y con la adición de marcadores séricos como PAPP-A y beta-HCG libre, ambos reportados como múltiplos de la mediana (mamás), esto aumenta a alrededor del 90% con una tasa de falsos positivos del 5%.
En la mayoría de los casos, estas pruebas serán tranquilizadoras y ofrecerán tranquilidad a las parejas sin poner en riesgo el embarazo, lo que puede ocurrir con pruebas invasivas como CVS o amniocentesis.
Con la disponibilidad de pruebas prenatales no invasivas, ha surgido un debate sobre el valor de la detección combinada del síndrome de Down en el primer trimestre, aunque muchos argumentan que la exploración de 12 semanas todavía tiene un papel que desempeñar en la identificación de anomalías estructurales y otros problemas que podrían afectar negativamente el resultado del embarazo.2
La ecografía de morfología fetal se realiza a las 18 a 20 semanas y puede detectar hasta el 50% de anomalías estructurales importantes. No se recomienda como prueba de detección primaria para el síndrome de Down. La sensibilidad de la exploración para detectar malformaciones está influenciada por una serie de factores, incluida la naturaleza de la malformación, la habilidad y experiencia del operador, la calidad de la máquina de ultrasonido, el hábito del cuerpo materno y la posición de la placenta.
Una muestra genética fetal detectable en la sangre materna, que puede analizarse para un diagnóstico prenatal preciso, ha sido durante mucho tiempo el santo grial de las pruebas prenatales. Las mejoras en la tecnología del ADN finalmente han llevado a la capacidad de aislar y medir el ADN fetal circulante en la sangre materna.3
Alrededor del 10% al 15% del ADN en la sangre materna es de origen fetal, y proviene de células fetales intactas, así como de ADN fetal libre de células circulantes (ccffDNA), derivado predominantemente de la descomposición de las células placentarias. El ccffDNA se elimina de la circulación materna a las pocas horas del parto, y el ADN fetal detectado durante el embarazo, por lo tanto, representa el ADN del feto actual.
NIPT consiste en medir los fragmentos cromosómicos libres de células y utilizar las diferencias cuantitativas para distinguir los embarazos aneuploideos de los que no se ven afectados. Por ejemplo, los fetos con síndrome de Down tendrán un aumento medible y estadísticamente significativo en el número de fragmentos del cromosoma 21.
Sin embargo, al igual que el muestreo de vellosidades coriónicas, el ccffDNA refleja el ADN placentario en lugar del fetal, que debe tenerse en cuenta al asesorar y discutir posibles opciones de pruebas invasivas. Esto puede devolver resultados citogenéticamente ambiguos causados por factores como el mosaicismo placentario.
Numerosas empresas de biotecnología han lanzado diferentes plataformas NIPT con nombres eufemísticos como Harmony y Panorama, que permiten realizar pruebas prenatales no invasivas a gran escala para detectar aneuploidías fetales, como trisomía 13, 18 y 21, y anomalías cromosómicas sexuales comunes, como el síndrome de Turner.
Las principales ventajas de la NIPT son que no es invasiva, está disponible a partir de las nueve semanas de gestación y tiene una alta sensibilidad y especificidad, aunque por definición es una prueba de detección en lugar de una prueba diagnóstica. Sin embargo, alrededor del 25% de las anomalías cromosómicas no serán detectadas por NIPT, y por lo tanto, las pruebas invasivas deben ofrecerse a las mujeres con mayor riesgo de una anomalía cromosómica, por ejemplo, en el caso de una medición de translucencia nucal aumentada o CFT, o aquellas con una anomalía estructural detectada en ultrasonido.4
También hay un inconveniente práctico en el entorno australiano, ya que NIPT no está financiado con fondos públicos, lo que conduce a la desigualdad de acceso. Todavía no se ha establecido cómo se debe incorporar la NIPT en la práctica de exámenes prenatales de rutina, o cuál es la forma más rentable de hacerlo.
En la actualidad, muchos expertos abogan por el modelo de detección contingente en el que todas las mujeres tienen CFT, y a las que tienen un alto riesgo de síndrome de Down (>1/50) se les ofrecen pruebas invasivas; a las que tienen un riesgo intermedio entre 1/50 y 1/300 se les ofrece la opción de pruebas NIPT o invasivas; y a las que tienen un riesgo bajo (<1/300) tranquilizado y no se le ofrecieron más pruebas.5
PRUEBAS INVASIVAS O DE DIAGNÓSTICO
En los últimos años, el número de procedimientos invasivos de pruebas prenatales ha disminuido significativamente, principalmente debido a la disponibilidad de pruebas no invasivas mejoradas.6 Las principales indicaciones para realizar pruebas invasivas ahora son para el diagnóstico prenatal de trastornos de un solo gen (mendelianos), en lugar de detectar aneuploidías.El muestreo de vellosidades coriónicas es una prueba invasiva que se realiza a las 11 a 13 semanas de embarazo, ya sea a través de un enfoque transvaginal o transabdominal, según la preferencia del operador y la ubicación de la placenta. La tasa de abortos espontáneos relacionados con el procedimiento es baja (<1%), pero sin embargo sigue siendo una barrera para algunas mujeres, especialmente en aquellas con antecedentes de infertilidad o pérdida de embarazo.
Hay un 1% de probabilidades de obtener un resultado no concluyente con el CVS. Esto se debe generalmente al mosaicismo placentario confinado, un fenómeno bien reconocido que puede asociarse con un PAPP-A bajo y resultados adversos del embarazo, incluida la restricción del crecimiento fetal y la pérdida temprana del embarazo, incluso si el feto tiene un cariotipo normal. Cuando los resultados del CVS son ambiguos, se realizan pruebas adicionales, generalmente amniocentesis, para aclarar si la anomalía cromosómica está realmente presente en el feto o está confinada a la placenta.
La amniocentesis se realiza después de 15 semanas y también se asocia con una pequeña (< 0.5%) riesgo de aborto espontáneo. La amniocentesis se considera el estándar de oro, ya que las células fetales obtenidas del líquido amniótico se derivan de varios tejidos fetales, incluidos el tracto urinario y la piel, y por lo tanto son más representativas del cariotipo fetal que las obtenidas de la placenta. La principal desventaja de la amniocentesis sobre el CVS es el momento posterior, y por lo tanto una gestación más avanzada, en el momento en que se reciben los resultados.
Actualmente, la mayoría de los laboratorios de diagnóstico se han alejado del análisis citogenético (cariotipo) como prueba estándar y han adoptado técnicas moleculares, incluida la reacción en cadena de la polimerasa fluorescente cuantitativa (QF-PCR). La QF-PCR es más barata y requiere menos mano de obra que el análisis de cariotipo estándar, y los resultados se obtienen más rápidamente (en 24-48 horas en comparación con 10-14 días), ya que la técnica no requiere el cultivo de células fetales.
Mientras QF-PCR es capaz de diagnosticar las aneuploidías comunes que involucran los cromosomas 13, 18, 21 y los cromosomas sexuales, no puede detectar otras anomalías cromosómicas raras. Además, no puede determinar si una trisomía se debe a una no disyunción (es decir, aneuploidía común relacionada con la edad) o translocación, que es más rara pero preocupante, ya que puede ser hereditaria y estar asociada con un mayor riesgo de recurrencia en embarazos futuros.
El microarray cromosómico, también conocido como cariotipado molecular, está bien establecido como una de las principales investigaciones utilizadas para evaluar a bebés y niños con anomalías estructurales y discapacidad intelectual. Analiza cromosomas con una resolución mucho mayor (generalmente <2,5 kb o 250.000 pares de bases) en comparación con la resolución de 5 Mb a 10 MB de un cariotipo estándar, o estudio citogenético, para detectar duplicaciones y eliminaciones cromosómicas pequeñas.
Cada vez más, el microarray se está utilizando en el entorno prenatal, donde puede producir resultados difíciles de interpretar, denominados «variantes de significado incierto». Por esta razón, el microarray cromosómico solo debe ofrecerse con asesoramiento adecuado antes y después de la prueba, y solo en situaciones en las que esté clínicamente indicado. En embarazos de alto riesgo en los que se ha detectado una anomalía estructural o una medición aumentada de la translucencia nucal, se ha demostrado que el microarray mejora el rendimiento diagnóstico en alrededor de un 6%.7
El diagnóstico genético preimplantacional está ahora disponible para pacientes con mayor riesgo de aneuploidía o de un trastorno de un solo gen. Ahora pueden someterse a FIV y someterse a biopsias y pruebas de embriones a través de un diagnóstico genético preimplantacional en el quinto día, antes de la transferencia de embriones al útero.
El DGP está siendo utilizado cada vez más por parejas que desean evitar un embarazo afectado por una afección genética o anomalía cromosómica en particular. Si bien no es 100% preciso, el DGP puede reducir significativamente el riesgo de tener un embarazo afectado y, por lo tanto, la necesidad de considerar la interrupción del embarazo.
Hay dos tipos principales de diagnóstico genético preimplantacional:
Pruebas de aneuploidía: se utilizan para parejas con riesgo de aneuploidía debido a la edad materna avanzada, la translocación equilibrada de los padres, el aborto espontáneo recurrente y el fallo de implantación;
: se usa en parejas con riesgo de tener un hijo con un trastorno de un solo gen, incluidas afecciones autosómicas recesivas, ligadas al cromosoma X o autosómicas dominantes. En estas situaciones, es necesario identificar el diagnóstico molecular o de ADN específico, antes de que se pueda ofrecer el DGP.
Es vital que las parejas que consideren la FIV y el DGP sean remitidas para el asesoramiento adecuado, ya que necesitan ser plenamente conscientes de los aspectos físicos, emocionales y financieros relevantes para estos procedimientos.
El Dr. Kennedy es Director de MotherSafe RHW y Profesor Conjunto de la Escuela de Salud de Mujeres y Niños en UNSW
1. AIHW Australia’s mothers and babies 2013 en resumen
2. McLennan A, Palma-Dias R, da Silva Costa F, et al. Pruebas prenatales no invasivas en la práctica clínica de rutina: una auditoría de NIPT y exámenes combinados de detección del primer trimestre en una población australiana no seleccionada. ANZJOG 2016; 56: 22-28.
3. Lo YMD, Corbetta N, Chamberlain PF, Rai V, Sargent IL, Redman CWG, Wainscoat JS. 1997. Presencia de ADN fetal en plasma y suero maternos. Lanceta 350, 485-4874:
4. Petersen OB1, Vogel I, Ekelund C, Hyett J, Tabor A. Consecuencias diagnósticas potenciales de la aplicación de pruebas prenatales no invasivas: estudio basado en la población de un país con pruebas de detección del primer trimestre existentes. Ultrasound Obstet Gynecol. 2014 Mar; 43 (3): 265-71.
5. Hui L, Hyett J Pruebas prenatales no invasivas para la trisomía 21; desafíos para la implementación en Australia. ANZJOG 2013; 53 (5): 416-424.
6. Hui L, Muggli EE, Halliday JL. Tendencias poblacionales en el cribado prenatal y el diagnóstico de aneuploidía: un análisis retrospectivo de 38 años de datos a nivel estatal. BJOG 2016; 123(1):90-7
7. Wapner RJ et al Chromosomal microarray versus karyotyping for prenatal diagnosis N Engl J Med 2012; 367:2175-2184

Leave a Reply