NOAA Global Monitoring Laboratory – Halocarbons and other Atmospheric Trace Species
Chlorofluorocarbons (CFCs)
(published in The Chapman & Hall Encyclopedia of Environmental Science, edited by David E. Alexander and Rhodes W. Fairbridge, pp pp.78-80, Kluwer Academic, Boston, MA, 1999.)
Chlorofluorocarbons (CFCs) are nontoxic, nonflammable chemicals containing atoms of carbon, chlorine, and fluorine. Se utilizan en la fabricación de aerosoles, agentes espumantes para espumas y materiales de embalaje, como disolventes y refrigerantes. Los CFC se clasifican como halocarbonos, una clase de compuestos que contienen átomos de carbono y átomos de halógeno. Las moléculas de CFC individuales se etiquetan con un sistema de numeración único. Por ejemplo, el número de CFC de 11 indica el número de átomos de carbono, hidrógeno, flúor y cloro (por ejemplo, CCl3F como CFC-11). La mejor manera de recordar el sistema es la «regla de 90» o agregar 90 al número CFC donde el primer dígito es el número de átomos de carbono (C), el segundo dígito es el número de átomos de hidrógeno (H), y el tercer dígito es el número de átomos de flúor (F). El número total de átomos de cloro (Cl) se calcula por la expresión: Cl = 2(C+1) – H – F. En el ejemplo, el CFC-11 tiene un carbono, sin hidrógeno, un flúor y, por lo tanto, 3 átomos de cloro.
Los refrigeradores a finales de 1800 y principios de 1900 usaban gases tóxicos, amoníaco (NH3), cloruro de metilo (CH3Cl) y dióxido de azufre (SO2), como refrigerantes. Después de una serie de accidentes mortales en la década de 1920, cuando el cloruro de metilo se filtró de los refrigeradores, la búsqueda de un reemplazo menos tóxico comenzó como un esfuerzo de colaboración de tres corporaciones estadounidenses: Frigidaire, General Motors y Du Pont. Los CFC fueron sintetizados por primera vez en 1928 por Thomas Midgley, Jr.de General Motors, como productos químicos más seguros para refrigeradores utilizados en aplicaciones comerciales de gran tamaño1. Frigidaire recibió la primera patente, número 1.886.339, para la fórmula de los CFC el 31 de diciembre de 1928. En 1930, General Motors y Du Pont formaron la Kinetic Chemical Company para producir Freón (un nombre comercial de Du Pont para CFC) en grandes cantidades. Para 1935, Frigidaire y sus competidores habían vendido 8 millones de refrigeradores nuevos en los Estados Unidos utilizando Freón-12 (CFC-12) fabricado por la Kinetic Chemical Company y las empresas autorizadas para fabricar este compuesto. En 1932, la Carrier Engineering Corporation utilizó Freón-11 (CFC-11) en la primera unidad de aire acondicionado doméstica autónoma del mundo, llamada «Gabinete Atmosférico».; Debido al registro de seguridad de CFC para la no toxicidad, el freón se convirtió en el refrigerante preferido en los grandes sistemas de aire acondicionado. Los códigos de salud pública en muchas ciudades estadounidenses se revisaron para designar al Freón como el único refrigerante que podía usarse en edificios públicos. Después de la Segunda Guerra Mundial, los CFC se utilizaron como propulsores para aerosoles de insectos, pinturas, acondicionadores para el cabello y otros productos para el cuidado de la salud. A finales de la década de 1950 y principios de la década de 1960, los CFC hicieron posible una solución económica para el deseo de aire acondicionado en muchos automóviles, hogares y edificios de oficinas. Más tarde, el crecimiento del uso de CFC despegó en todo el mundo con un pico de ventas anuales de alrededor de mil millones de dólares (EE.UU.) y más de un millón de toneladas métricas de CFC producidos.
Mientras que los CFC son seguros de usar en la mayoría de las aplicaciones y son inertes en la atmósfera inferior, experimentan una reacción significativa en la atmósfera superior o estratosfera. En 1974, dos químicos de la Universidad de California, el Profesor F. Sherwood Rowland y el Dr. Mario Molina, mostró que los CFC podrían ser una fuente importante de cloro inorgánico en la estratosfera después de su descomposición fotolítica por radiación UV. Además, parte del cloro liberado se activaría en la destrucción del ozono en la estratosfera2. El ozono es un gas traza ubicado principalmente en la estratosfera (véase ozono). El ozono absorbe la radiación ultravioleta dañina en longitudes de onda entre 280 y 320 nm de la banda UV-B, lo que puede causar daños biológicos en plantas y animales. Una pérdida de ozono estratosférico resulta en una radiación UV-B más dañina que llega a la superficie de la Tierra. El cloro liberado de los CFC destruye el ozono en reacciones catalíticas en las que se pueden destruir 100.000 moléculas de ozono por átomo de cloro.
Un gran agotamiento primaveral del ozono estratosférico empeoraba cada año siguiente. Esta pérdida de ozono fue descrita en 1985 por el investigador británico Joe Farman y sus colegas 3. Fue llamado «el agujero de ozono antártico» por otros. El agujero de ozono era diferente de la pérdida de ozono en las latitudes medias. La pérdida fue mayor en la Antártida que en las latitudes medias debido a muchos factores: las temperaturas inusualmente frías de la región, el aislamiento dinámico de este ìholeî y las reacciones sinérgicas del cloro y la bromina4. La pérdida de ozono también aumenta en las regiones polares como resultado de reacciones que involucran nubes estratosféricas polares (PSC)5 y en las latitudes medias después de erupciones volcánicas. La necesidad de controlar los CFC se hizo urgente.
En 1987, 27 naciones firmaron un tratado ambiental global, el Protocolo de Montreal para Reducir las Sustancias que Agotan la Capa de Ozono6, que tenía una disposición para reducir los niveles de producción de estos compuestos en 1986 en un 50% antes del año 2000. Este acuerdo internacional incluía restricciones a la producción de CFC-11, -12, -113, -114, -115, y los Halones (sustancias químicas utilizadas como agentes extintores de incendios). Una enmienda aprobada en Londres en 1990 fue más enérgica y pedía la eliminación de la producción para el año 2000. Los disolventes clorados, el metilcloroformo (CH3CCl3) y el tetracloruro de carbono (CCl4) se añadieron a la Enmienda de Londres. Durante el invierno de 1992, en algunas regiones de América del Norte, se observaron grandes cantidades de cloro estratosférico reactivo en forma de monóxido de cloro (ClO) que sólo podían resultar de la destrucción del ozono por los CFC en la estratosfera mediante instrumentos a bordo del avión ER-2 de la NASA y el Satélite de Investigación de la Atmósfera Superior (UARS) 7,8. La preocupación ambiental por los CFC se deriva de su larga vida en la atmósfera (55 años para el CFC-11 y 140 años para el CFC-12, CCl2F2)9, lo que limita nuestra capacidad de reducir su abundancia en la atmósfera y la pérdida de ozono futura asociada. Esto dio lugar a la Enmienda de Copenhague que limitó aún más la producción y fue aprobada más tarde en 1992. La fabricación de estos productos químicos terminó en su mayor parte el 1 de enero de 1996. Las únicas excepciones aprobadas fueron para la producción en los países en desarrollo y para algunas aplicaciones exentas en medicina (por ejemplo, inhaladores para el asma) e investigación. El Protocolo de Montreal incluía disposiciones de cumplimiento mediante la aplicación de sanciones económicas y comerciales en caso de que un país signatario comerciara o produjera esos productos químicos prohibidos. Un total de 148 países signatarios ya han firmado el Protocolo de Montreal. Las mediciones atmosféricas de CFC-11 y CFC-12 notificadas en 1993 mostraron que sus tasas de crecimiento estaban disminuyendo como resultado de reducciones voluntarias y obligatorias de las emisiones 9. Muchos CFC y disolventes clorados seleccionados se han estabilizado (Figura 1) o han disminuido su concentración en 19949, 10.
La demanda de CFC se atendió mediante el reciclado y la reutilización de las existencias actuales de CFC y el uso de sustitutos. Algunas aplicaciones, por ejemplo, desengrasado de metales y disolventes de limpieza para placas de circuitos, que una vez usaron CFC, ahora usan fluidos sin halocarbonos, agua (a veces como vapor) y ácidos cítricos diluidos. La industria desarrolló dos clases de sustitutos de halocarbonos: los hidroclorofluorocarbonos (HCFC) y los hidrofluorocarbonos (HFC). Los HCFC incluyen átomos de hidrógeno además de cloro, flúor y átomos de carbono. La ventaja de utilizar HCFC es que el hidrógeno reacciona con el hidroxilo troposférico (OH), lo que resulta en una vida atmosférica más corta. El HCFC-22 (CHClF2) tiene una vida útil en la atmósfera de unos 13 años11 y se ha utilizado en aplicaciones de aire acondicionado doméstico de baja demanda y algunas aplicaciones de refrigeración desde 1975. Sin embargo, los HCFC todavía contienen cloro, lo que les permite destruir el ozono. La enmienda de Copenhague pide que se elimine su producción para el año 2030. Los HFC se consideran uno de los mejores sustitutos para reducir la pérdida de ozono estratosférico debido a su corta vida útil y a la falta de cloro. En los Estados Unidos, el HFC-134a se utiliza en todos los acondicionadores de aire de automóviles domésticos nuevos. Por ejemplo, el HFC-134a está creciendo rápidamente en 1995 a una tasa de crecimiento de alrededor del 100% anual, con una vida útil en la atmósfera de unos 12 años12. (La «regla del 90» también se aplica a la fórmula química de los HCFC y los HFC.)
El uso de CFC, algunos disolventes clorados y halones debería quedar obsoleto en el próximo decenio si todas las Partes observan el Protocolo de Montreal y se utilizan sustitutos. La ciencia que se convirtió en la base del Protocolo de Montreal resultó en el Premio Nobel de Química de 1995. El premio fue otorgado conjuntamente a los profesores F. S. Rowland en la Universidad de California en Irvine, M. Molina en el Instituto Tecnológico de Massachusetts, Cambridge, y Paul Crutzen en el Instituto Max-Planck de Química en Maguncia, Alemania, por su trabajo en química atmosférica, particularmente en relación con la formación y descomposición del ozono (en particular, por los CFC y los óxidos de nitrógeno).
1Midgley, T., y Henne, A., Fluoruros orgánicos como refrigerantes, Química Industrial y de Ingeniería, 22, 542-547, 1930.
2Molina, M. J. y F. S. Rowland, Sumidero estratosférico para clorofluorometanos: Destrucción catalizada por átomos de cloro del ozono, Nature, 249, 810-814, 1974.
3Farman, J.C., B. G. Gardiner y J. D. Shanklin, Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction, Nature, 315,207-210, 1985.
4McElroy, M. B., R. J. Salawitch, S. C. Wofsy, y J. A. Logan, Reductions of Antarctic ozone due to synergistic interactions of chlorine and bromine, Nature, 321, 759-762, 1986.
5Solomon, S., R. R. Garcia, F. S. Rowland, y D. J. Wuebbles, On the depletion of Antarctic ozone, Nature, 321, págs. 755 a 758, 1986.
6 Protocolo sobre Sustancias que agotan la capa de Ozono, 15 páginas, Programa de las Naciones Unidas para el Medio Ambiente (PNUMA), Nueva York, 1987.
7Toohey, D. W., L. M. Avallone, L. R. Lait, P. A. Newman, M. R. Schoeberl, D. W. Fahey, E. L. Woodbridge, y J. G. Anderson, The seasonal evolution of reactive chlorine in the northern hemisphere stratosphere, Science, 261, 1134-1136, 1993.
8Waters, J., L. Froidevaux, W. Read, G. Manney, L. .Elson, D. Flower, R. Jarnot, and R. Harwood, Stratospheric Clo andozone from the Microwave Limb Sounder on the Upper Atmosphere Research Satellite, Nature, 362, 597-602, 1993.
9Elkins, J. W., T. M. Thompson, T. H. Swanson, J. H. Butler, B. D. Hall, S. O. Cummings, D. A. Fisher, y A. G. Raffo, Decremence in the growth rates of atmospheric chlorofluorocarbons 11 and 12, Nature, 364, 780-783, 1993.
10Prinn, R. G., R. F. Weiss, B. R. Miller, J. Huang, F. N. Alyea, D. M. Cunnold, P. J. Fraser, D. E. Hartley, y P. G. Simmonds, Atmospheric trends and lifetimes of CH3CCl3 and global OH concentrations, Science, 269, págs. 187 a 192, 1995.
11Montzka, S.A., R. C. Myers, J. H. Butler, S. C. Cummings, y J. W. Elkins, Global tropospheric distribution and calibration scale of HCFC-22, Geophysical Research Letters, 20 (8), 703-706, 1993. 12Montzka, S.A., R. C. Myers, J. H. Butler, J. W. Elkins, L. T. Lock, A. D. Clarke, y A. H. Goldstein, Observations of HFC-134a in the remote troposphere, Geophysical Research Letters, 23, págs. 169 a 172, 1996.
Lectura adicional sugerida:
Cagin, S., y P. Dray, Between Earth and Sky: How CFCs changed our world and threatened the ozone layer, 512 págs., Pantheon Press, Nueva York, 1993.
Scientific Assessment of Ozone Depletion: 1994, editado por D. L. Albritton, R. T. Watson y R. J. Aucamp, 37, 451 págs., Organización Meteorológica Mundial (OMM), Ginebra, 1995.
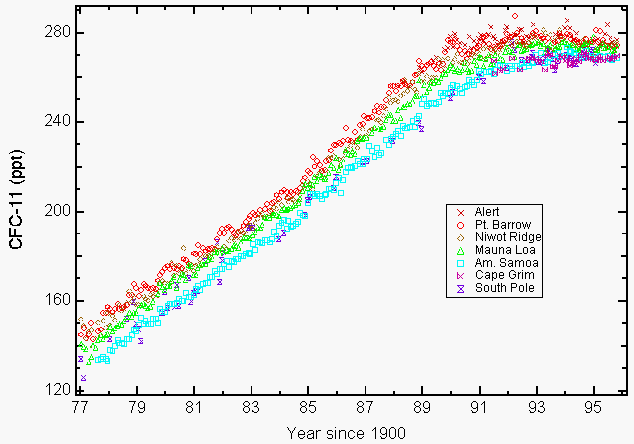
Figura 1: La acumulación de clorofluorocarbono-11 (CFC-11) en los niveles atmosféricos como resultado de reducciones de emisiones voluntarias y obligatorias. Medias mensuales notificadas como relaciones de mezcla en seco en partes por billón (ppt) para CFC-11 a nivel del suelo para cuatro estaciones de NOAA/CMDL (Pt. Barrow, Alaska; Mauna Loa, Hawái; Cabo Matatula, Samoa Americana; y Polo Sur) y tres estaciones cooperativas (Alert, Territorios del Noroeste, Canadá (Servicio de Medio Ambiente Atmosférico); Niwot Ridge, Colorado (Universidad de Colorado); Estación de Referencia de Contaminación Atmosférica de Cape Grim, Tasmania, Australia (Organización de Investigación Científica e Industrial del Commonwealth) 9. (Cortesía de NOAA / CMDL)
Leave a Reply