Hidróxido de sodio
Hidróxido de sodio Propiedades químicas,Usos, Producción
Propiedades químicas
El hidróxido de sodio es un material alcalino blanco, inodoro y no volátil comercializado en forma sólida como gránulos, copos, grumos o palos. Su solubilidad en agua es del 111% en peso y una presión de vapor de 0 mmHg (NIOSH, 1994).Puede reaccionar con tricoloetileno (TCE) para formar dicloroacetileno inflamable y con metales para formar gas hidrógeno (OEHHA, 1993). Se debe tener en cuenta su reactividad con los metales en lo que respecta a las unidades de almacenamiento y los contenedores.
El hidróxido de sodio está comúnmente disponible como una solución acuosa conocida como sosa cáustica, lejía de soda o simplemente como lejía. Tiene varios usos, incluida la neutralización de ácido; la fabricación de papel, textiles, plásticos, corrosivos, colorantes, pintura, removedor de pintura y jabón; refinación de petróleo; galvanoplastia; limpieza de metales; lavado y lavado de platos. Un uso creciente ha sido en la fabricación ilegal de metanfetamina.
Usos
El hidróxido de sodio (NaOH) es uno de los compuestos de sodio industriales más útiles. También se conoce como lejía o sosa cáustica y es uno de los álcalis de base más fuertes (alto valor de pH)en el mercado doméstico. Se utiliza como limpiador de desagües y hornos, y saponifica las grasas en la fabricación de jabón. Debe usarse con cuidado, ya que también es capaz de producir quemaduras graves en la piel.
Descripción
El hidróxido de sodio, también conocido como lejía y sosa cáustica, es una sustancia altamente cáustica que se utiliza en pequeñas cantidades en cosméticos para establecer y mantener el pH de un producto.El hidróxido de sodio es un compuesto extremadamente importante en nuestras vidas porque tiene muchos usos. Es una base muy común utilizada en la industria química y se utiliza para muchas cosas, muchas de las cuales ocurren en nuestra vida diaria. Uno de los usos más conocidos del hidróxido de sodio es su uso en desagües de desagüe. Viene en muchas marcas diferentes de limpiadores de desagües, pero uno de los más comunes es el Drano. También viene en forma de jabón de lejía que se puede usar para lavar prácticamente cualquier cosa, desde los platos hasta la cara.
estructura de hidróxido de sodio
A temperatura ambiente, el hidróxido de sodio es un sólido inodoro cristalino blanco que absorbe la humedad del aire. Es una sustancia manufacturada. El hidróxido de sodio es un compuesto inorgánico utilizado para controlar los niveles de pH o servir como agente tampón en cosméticos y productos de cuidado personal. Se utilizó históricamente en la formulación de jabones, pero actualmente se ve en una variedad de fórmulas, que incluyen productos de baño, productos de limpieza, fragancias, polvos para los pies, tintes y colores para el cabello, maquillaje, productos para uñas, productos de limpieza personal, champús, productos de afeitado, depilatorios, productos para el cuidado de la piel y productos para el bronceado, así como planchas químicas para el cabello y conjuntos de ondas para el cabello. También es un ingrediente popular en solventes industriales como base química para jabones, limpiadores de horno, detergentes y limpiadores de desagües debido a su capacidad para disolver grasas, aceites, grasas y depósitos a base de proteínas, según Wikipedia. Con menos frecuencia, el hidróxido de sodio se ve como un ingrediente en las pastas dentales.El hidróxido de sodio está aprobado por la FDA y ha recibido la calificación GRAS (Generalmente Reconocido como Seguro) como aditivo alimentario directo. Sin embargo, se utiliza principalmente en el lavado y pelado químico de productos agrícolas. Está aprobado para su uso en cosméticos y productos de cuidado personal en diferentes concentraciones: 5% en peso en disolventes para cutículas de uñas, 2% en peso en planchas para el cabello para uso general, 4,5% en peso en planchas para el cabello para uso profesional, hasta un pH 12,7 en depilatorios y hasta pH 11 en otros usos como ajustador de pH.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
Propiedades químicas
El hidróxido de sodio, NaOH, también conocido como sosa cáustica o hidrato de sodio (y anteriormente conocido como lejía), es un sólido cristalino blanco,masivo y delicuescente que es soluble en agua, alcohol y glicerol. Se funde a 318 ° C (606 OF) y es el producto químico alcalino más utilizado y disponible. La mayor parte del hidróxido de sodio se produce como coproducto de cloro mediante el uso de células electrolíticas;las células son del tipo diafragma, mercurio o membrana. Parte del hidróxido de sodio se marca como producido en las células; la mayoría se evapora y se vende como soluciones al 50% y al 73% o como perlas anhidras. La mayoría de los usos finales cáusticos requieren soluciones de concentraciones relativamente bajas. La sosa cáustica se utiliza como reactivo analítico e intermedio químico,en baños de limpieza y limpieza, en recuperación de caucho y refinación de petróleo,en baños de enfriamiento para tratamiento térmico de acero,en aceites solubles y de corte, en jabones y detergentes, y en una amplia variedad de otras aplicaciones.
Propiedades químicas
El NaOH es un material blanco, inodoro y delicuescente que se vende como gránulos, copos, grumos o palos. Las soluciones acuosas se conocen como lejía de sosa
Propiedades químicas
El hidróxido de sodio se presenta como una masa fundida blanca o casi blanca. Está disponible en pequeños pellets, escamas, palos y otras formas. Es duro y quebradizo y muestra una fractura cristalina. El hidróxido de sodio es muy delicuescente y al exponerse al aire absorbe rápidamente dióxido de carbono y agua.
Propiedades físicas
Cristales ortorrómbicos blancos, producidos en forma de gránulos, grumos, palos, perlas, astillas, escamas o soluciones; higroscópicos; muy corrosivos; absorbe rápidamente CO2 y agua del aire; densidad 2,13 g/cm3; se derrite a 323°C; vaporiza a 1388°C; presión de vapor 1 torr a 739°C y 5 torr a 843°C; muy soluble en agua (110 g/100 ml a temperatura ambiente), generando calor en disolución; soluciones acuosas altamente alcalinas, pH de solución al 0,5% aproximadamente 13 y solución al 0,05% aproximadamente 12; soluble en metanol, etanol y glicerol (23,8 g/100 mL de metanol y 13.9 g/100 ml de etanol a temperatura ambiente.).
Usos
La sosa cáustica es uno de los productos químicos más utilizados. Se utiliza para neutralizar ácidos; para tomar sales de sodio; para precipitar metales como sus hidróxidos; en refinación de petróleo; en la saponificación de ésteres; en el tratamiento de celulosa, plásticos y caucho; y en numerosas aplicaciones sintéticas y analíticas.
Usos
El hidróxido de sodio se vende comercialmente como copos o pellets anhidros o como soluciones acuosas al 50% o al 73%. Tiene innumerables usos industriales y es uno de los 10 principales productos químicos en términos de producción y uso a escala mundial. Anualmente se utilizan aproximadamente 15 millones de toneladas de hidróxido de sodio. Su mayor uso, que consume aproximadamente la mitad de su producción, es como base para producir otros productos químicos. Se utiliza para controlar el pH y neutralizar ácidos en procesos químicos. La industria papelera utiliza ampliamente el hidróxido de sodio en el proceso de pulpa. El hidróxido de sodio se utiliza para separar las fibras disolviendo la lignina de conexión. Se utiliza de manera similar en la producción de rayón a partir de celulosa. El hidróxido de sodio es un químico clave en el jabón industry.In el proceso de saponificación, los triglicéridos obtenidos de animales y plantas se calientan en solución abásica para dar glicerol y jabón:
El hidróxido de sodio se utiliza en la industria textil para blanquear y tratar textiles para hacerlos teñir más fácilmente. La industria petrolera utiliza hidróxido de sodio en lodos de perforación y bactericida asa. El hipoclorito de sodio (NaOCl) se utiliza ampliamente para la limpieza y como desinfectante.El blanqueador doméstico común consiste en una solución de hipoclorito de sodio al 5% aproximadamente. El hipoclorito de sodio se prepara reaccionando cloro con hidróxido de sodio: Cl2(g) + 2NaOH(aq) →NaOCl(aq) + NaCl(aq) + H2O(l). El hidróxido de sodio se utiliza en la industria alimentaria para limpiar y pelar frutas y verduras. El hidróxido de sodio es un ingrediente menor en muchos productos comunes, pero en algunos puede constituir más de la mitad del producto. Los dranocristales contienen entre un 30% y un 60% de hidróxido de sodio y algunos limpiadores de desagües pueden consistir en un 100% de hidróxido de sodio.
Usos
El hidróxido de sodio es un álcali soluble en agua, que tiene una solubilidad de 1 g en 1 ml de agua. se utiliza para destruir los productos químicos amargos de las aceitunas que se convertirán en aceitunas negras. también funciona para neutralizar los ácidos en varios productos alimenticios.
Usos
el hidróxido de sodio se utiliza para ajustar el pH de un producto para que sea más aceptable para la piel. Se conoce comúnmente como sosa cáustica, y a menudo sirve como reactivo químico al hacer jabón. Si está demasiado concentrado, puede causar irritación grave de la piel.
Usos
El hidróxido de sodio es uno de los productos químicos industriales más importantes. En volumen, se encuentra entre los diez principales productos químicos producidos en los Estados Unidos. Se utiliza en la fabricación de un gran número de compuestos, incluidas varias sales de sodio, en el tratamiento de celulosa para producir rayón y celofán, y en la fabricación de jabones, detergentes, pulpa y papel. El hidróxido de sodio es un agente neutralizador común para ácidos en titulaciones ácido-base y refinación de petróleo. Otra aplicación importante es la extracción de metales de sus minerales, donde la fusión alcalina, como la fusión con sosa cáustica, a menudo se aplica para abrir los minerales. Además, el hidróxido de sodio se utiliza para precipitar metales como hidróxidos. Otros usos son la recuperación de caucho, la disolución de caseína en la producción de plásticos, el refinado de aceites vegetales, el procesamiento de textiles, como eluante en cromatografía iónica, grabado y galvanoplastia, y como reactivo de laboratorio. El hidróxido de sodio también se utiliza como una base fuerte en muchas reacciones de síntesis orgánica y catalizadas por bases.
Usos
Las soluciones de NaOH se utilizan para neutralizar ácidos y fabricar sales de sodio, por ejemplo, en refinación de petróleo para eliminar ácidos sulfúricos y orgánicos; para tratar celulosa en la fabricación de rayón viscoso y celofán; en la recuperación de caucho para disolver la tela; en la fabricación de plásticos para disolver la caseína. Las soluciones de NaOH hidrolizan grasas y forman jabones; precipitan alcaloides (bases) y la mayoría de los metales (como hidróxidos) a partir de soluciones de agua de sus sales. Ayuda farmacéutica (alcalinizante).
Preparación
El hidróxido de sodio se fabrica junto con cloro por electrólisis de solución de cloruro de sodio. Se utilizan comercialmente varios tipos de células electrolíticas. Incluyen la célula de mercurio, la célula de diafragma y la célula de membrana.Se electroliza una solución saturada de salmuera. El gas de cloro se libera en el ánodo y el ion de sodio en el cátodo. La descomposición del agua produce iones de hidrógeno e hidróxido. El ion hidróxido se combina con NaOH formador de iones de sodio. Las reacciones electrolíticas generales pueden representarse como:
2Na+ + 2Cl – + 2H2O → Cl2 (g) + H2 (g) + 2NaOH (aq)
La celda de mercurio se desarrolla en dos etapas que se producen por separado en dos celdas. El primero se conoce como celda de salmuera o electrolizador primario en el que los depósitos de iones de sodio en el cátodo de mercurio forman amalgama, mientras que el gas de cloro se libera en el ánodo:
Na + + Cl – → Na-Hg ( cátodo) + ½Cl2(g) (ánodo)
En la segunda celda, conocida como la celda descomponedora, se usa un cátodo de grafito mientras que la amalgama de sodio sirve como ánodo. El agua reacciona con el metal de sodio de la amalgama en el descomponedor:
Na-Hg + H2O → Na+ + OH– + ½H2 + Hg
En las celdas de diafragma cloroalcalino, se emplea un diafragma para separar el cloro liberado en el ánodo del hidróxido de sodio y el hidrógeno generado en el cátodo. Sin diafragma, el hidróxido de sodio formado se combinará con cloro para formar hipoclorito de sodio y clorato. En muchas células, se utilizan diafragmas de asbesto para dicha separación. Hay muchos tipos de células de diafragma disponibles.El hidróxido de sodio se produce como sólido anhidro o como solución acuosa al 50%.
Definición
El cáustico comercial más importante.
Métodos de producción
El hidróxido de sodio se fabrica mediante electrólisis de electrodos de inerte con salmuera. El cloro evoluciona como gas en el ánodo y el hidrógeno evoluciona como gas en el cátodo. La eliminación de iones de cloruro e hidrógeno deja iones de sodio e hidróxido en solución.La solución se seca para producir el hidróxido de sodio sólido.Un segundo método utiliza la célula Kellner-Solvay. La solución saturada de cloruro de sodio se electroliza entre un ánodo de carbono y un cátodo de mercurio que aflora. En este caso, el sodio se produce en elcatodo en lugar del hidrógeno debido a la disponibilidad del sodio para disolverse en el mercurio. La amalgama de sodio y mercurio se expone al agua y se produce una solución de hidróxido de sodio.
Reacciones
El hidróxido de sodio es fuertemente alcalino y puede reaccionar con ácidos para formar sales y agua.
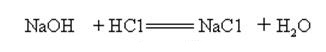
El hidróxido de sodio reacciona con óxidos ácidos para formar sal y agua, por lo que el hidróxido de sodio se puede usar para absorber gases ácidos en el laboratorio o en la industria.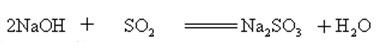
El hidróxido de sodio puede reaccionar con soluciones acuosas de muchas sales metálicas para formar sales de sodio e hidróxidos metálicos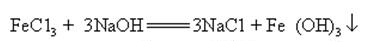
Cuando el hidróxido de sodio y la sal de amoníaco se calientan juntos, puede liberar amoníaco 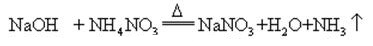
El hidróxido de sodio es altamente corrosivo, de modo que los frascos de vidrio que almacenan soluciones de hidróxido de sodio deben ser tapones de goma, y no se deben usar tapones de vidrio para evitar que se abra una reacción química. El hidróxido de sodio es una importante materia prima industrial y se puede producir mediante electrólisis de solución salina industrialmente
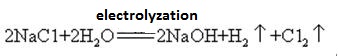
Descripción general
Un sólido blanco. Corrosivo para metales y tejidos. Se utiliza en la fabricación de productos químicos, refinación de petróleo, compuestos de limpieza, limpiadores de desagües.
Aire & Reacciones al agua
Solubles en agua. La disolución puede liberar suficiente calor para causar vapor y salpicaduras e inflamar el material combustible adyacente .
Perfil de reactividad
La SOSA CÁUSTICA (hidróxido de sodio) es una base fuerte. Reacciona rápida y exotérmicamente con ácidos, tanto orgánicos como inorgánicos. Absorbe fácilmente la humedad del aire para dar semisólidos cáusticos que atacan el aluminio y el zinc con la evolución del gas de hidrógeno inflamable. Cataliza la polimerización de acetaldehído y otros compuestos polimerizables; estas reacciones pueden ocurrir violentamente, por ejemplo, la acroleína se polimeriza con extrema violencia cuando se pone en contacto con materiales alcalinos como el hidróxido de sodio . Reacciona con gran violencia con pentóxido de fósforo cuando se inicia por calentamiento local . El contacto (como agente de secado) con tetrahidrofurano, que a menudo contiene peróxidos, puede ser peligroso—se han producido explosiones en tal uso del hidróxido de potasio químicamente similar . La mezcla con cualquiera de las siguientes sustancias en un recipiente cerrado provocó un aumento de la temperatura y la presión: ácido acético glacial, anhídrido acético, acroleína, clorhidrina, ácido clorosulfónico, cianhidrina de etileno, glioxal, ácido clorhídrico (36%), ácido fluorhídrico (48,7%), ácido nítrico (70%) ,eumeum, propiolactona y ácido sulfúrico (96%) . El contacto accidental entre una solución de limpieza cáustica (que probablemente contenga hidróxido de sodio) y pentol causó una explosión violenta. . El calentamiento con una mezcla de alcohol metílico y triclorobenceno durante un intento de síntesis provocó un aumento repentino de la presión y una explosión . El NaOH caliente y / o concentrado puede causar que la hidroquinona se descomponga exotérmicamente a temperatura elevada. (NFPA Pub. 491M, 1975, 385)
Peligro
Corrosivo para los tejidos en presencia de moisés, fuerte irritante para los tejidos (ojos, piel, membranas mucosas y vías respiratorias superiores), ingestión de veneno.
Peligro para la salud
Fuerte acción corrosiva sobre los tejidos en contacto. INHALACIÓN: el polvo puede causar daños en las vías respiratorias superiores y en los pulmones, produciendo desde irritación leve de la nariz hasta neumonitis. INGESTIÓN: daño grave a las membranas mucosas; puede producirse una perforación o formación de cicatrices graves. CONTACTO VISUAL: produce daños graves.
Peligro para la salud
El hidróxido de sodio es una sustancia altamente corrosiva que causa daños a los tejidos humanos.Su acción sobre la piel es algo diferentede las quemaduras ácidas. No hay dolor inmediato, pero penetra en la piel. No coagula la proteína para evitar su mayor penetración,y por lo tanto la quemadura cáustica puede volverse severa y lenta curación. El derramamiento de sus soluciones concentradas en los ojos puede resultar en una severa irritación o lesión permanente.Es tóxico tanto por ingestión como por inhalación de su polvo. Aunque se encontró que la toxicidad oral de una solución de sosa cáustica al 5-10% era baja en animales de prueba, dosis altas a concentraciones mayores pueden causar vómitos,postración y colapso. La dosis letal oral de conejos es de 500 mg / kg (NIOSH 1986).Los polvos o aerosoles de hidróxido de sodio se irritan en los ojos, la nariz y la garganta. La exposición prolongada a altas concentraciones en el aire puede producir ulceración del conducto nasal.
Peligro de incendio
No combustible, la sustancia en sí no se quema, pero puede descomponerse al calentarse para producir humos corrosivos y / o tóxicos. Algunos son oxidantes y pueden encender combustibles (madera, papel, aceite, ropa, etc.).). El contacto con metales puede producir gas hidrógeno inflamable. Los contenedores pueden explotar cuando se calientan.
Inflamabilidad y explotabilidad
El hidróxido de sodio y el hidróxido de potasio no son inflamables en forma de sólidos o soluciones de agua.
Aplicaciones farmacéuticas
El hidróxido de sodio se usa ampliamente en formulaciones farmacéuticas para ajustar el pH de las soluciones. También se puede usar para reaccionar con ácidos débiles para formar sales.
Usos industriales
La sosa cáustica (NaOH) se considera el regulador de pH alcalino más fuerte. El sodio cáustico es una sustancia muy activa y altamente corrosiva. La mayor parte de la sosa cáustica se fabrica mediante electrólisis de salmueras saturadas (NaCl). La sosa cáustica tiene una capacidad de regulación del pH muy fuerte (es decir, de pH 7 a pH 14) a una dosis relativamente baja en comparación con otras sustancias alcalinas. Comercialmente, la sosa cáustica está disponible en forma anhidra, pero en la mayoría de las aplicaciones mineras, la sosa cáustica se suministra como una solución al 50%.En la industria de procesamiento de minerales, el hidróxido de sodio se utiliza principalmente para el control de alcalinidad durante el procesamiento de minerales no metálicos. En la flotación de metales básicos, el uso de hidróxido de sodio es raro.
Perfil de seguridad
Veneno por vía intraperitoneal. Moderadamente tóxico por ingestión. Datos de mutaciones reportados. Un irritante corrosivo para la piel, los ojos y las membranas mucosas. Cuando se calienta para descomponerse, emite vapores tóxicos de NanO.
Seguridad
El hidróxido de sodio es ampliamente utilizado en las industrias farmacéutica y alimentaria y generalmente se considera un material no tóxico en concentraciones bajas. En altas concentraciones es un irritante corrosivo para la piel, los ojos y las membranas mucosas.
LD50 (ratón, IP) : 0,04 g/kg
LD50 (conejo, oral): 0,5 g/kg
Exposición potencial
El NaOH se utiliza para neutralizar ácidos y fabricar sales de sodio en refinación de petróleo, rayón viscoso; celofán, producción de plástico; y en la recuperación de soluciones de sus sales. Se utiliza en la fabricación de algodón mercerizado, papel, explosivos y colorantes en la limpieza de metales; extracción electrolítica de zinc; estañado; revestimiento de óxido; lavado, blanqueo, lavado de vajilla; y se utiliza en las industrias químicas.
almacenamiento
se deben usar guantes para salpicaduras y guantes impermeables en todo momento al manipular estas sustancias para evitar el contacto con los ojos y la piel. Las operaciones con soluciones de hidróxidos metálicos que tienen el potencial de crear aerosoles deben llevarse a cabo en una fumeta para evitar la exposición por inhalación. El NaOH y el KOH generan un calor considerable cuando se disuelven en agua; cuando se mezclan con agua, siempre agregue cáusticos lentamente al agua y revuelva continuamente. Nunca agregue agua en cantidades limitadas a los hidróxidos sólidos. Los recipientes de hidróxidos deben almacenarse en un lugar fresco y seco, separados de ácidos y sustancias incompatibles.
almacenamiento
El hidróxido de sodio debe almacenarse en un contenedor hermético no metálico en un lugar fresco y seco. Cuando se expone al aire, el hidróxido de sodio absorbe rápidamente la humedad y se licúa, pero posteriormente se vuelve sólido de nuevo debido a la absorción de dióxido de carbono y la formación de carbonato de sodio.
Envío
UN1823 NaOH, sólido, Clase de peligro: 8; Etiquetas: 8-Material corrosivo. UN1824 NaOH, solución, Clase de peligro: 8; Etiquetas: 8-Material corrosivo
Métodos de purificación
Las impurezas comunes son el agua y el carbonato de sodio. El hidróxido de sodio se puede purificar disolviendo 100 g en 1 L de EtOH puro, filtrando la solución al vacío a través de un fino disco de vidrio sinterizado para eliminar carbonatos y haluros insolubles. (Esta y las operaciones posteriores deben realizarse en una caja seca y libre de CO2.) La solución se concentra al vacío, utilizando un calentamiento suave, para dar una suspensión espesa del monoalcoholato que se transfiere a un disco de vidrio sinterizado grueso y se evacúa libre de licor madre. Después de lavar los cristales varias veces con alcohol purificado para eliminar los restos de agua, se secan al vacío, con calentamiento suave, durante aproximadamente 30 horas para descomponer el alcoholato, dejando un polvo cristalino blanco fino . CÁUSTICA. Soluciones de hidróxido de sodio (cáustico), 14.77. El ion carbonato se puede eliminar por el paso a través de una columna de intercambio de aniones (como Amberlite IRA-400; forma OH form). La columna debe prepararse recién a partir de la forma de cloruro mediante un paso previo lento de la solución de hidróxido de sodio hasta que el efluente no presente pruebas de iones de cloruro. Después del uso, la columna se puede regenerar lavando con HCl diluido, luego con agua. Del mismo modo, otros iones metálicos se eliminan cuando una solución de NaOH de 1 M (o más diluida) pasa a través de una columna de resina A-1 de intercambio iónico Dowex en su forma Na+. Alternativamente, la contaminación por carbonatos se puede reducir enjuagando barras de NaOH (calidad de reactivo analítico) rápidamente con H2O, luego disolviéndolas en H2O destilado, o preparando una solución acuosa concentrada de NaOH y extrayendo el líquido sobrenadante transparente. (El Na2CO3 insoluble se deja atrás.) La contaminación por carbonatos se puede reducir añadiendo un ligero exceso de BaCl2 concentrado o Ba (OH)2 a una solución de NaOH, agitando bien y permitiendo que el precipitado de BaCO3 se asiente. Si la presencia de Ba en la solución es inaceptable, se puede usar una purificación electrolítica. Por ejemplo, la amalgama de sodio se prepara mediante electrólisis de 3 L de NaOH al 30% con 500 ml de mercurio puro para cátodo y un ánodo de platino, pasando 15 días a 4 amperios, en una botella de polietileno de paredes gruesas. La botella está equipada con tubos de entrada y salida, y la solución gastada se elimina con N2 libre de CO2. La amalgama se lava a fondo con un gran volumen de agua desionizada (con la corriente de electrólisis encendida para minimizar la pérdida de Na). Finalmente, se coloca una varilla de acero limpia en contacto en la solución con la amalgama (para facilitar la evolución del hidrógeno), se permite que la reacción continúe hasta alcanzar una concentración adecuada, antes de transferirse a un recipiente de almacenamiento y diluirse según sea necesario .
Incompatibilidades
Una base fuerte y un oxidante fuerte. Reacción violenta con ácido. Incompatibles con el agua; líquidos inflamables; halógenos orgánicos, nitrometano y compuestos nitrosos, combustibles. Absorbe rápidamente dióxido de carbono y agua del aire. El contacto con la humedad o el agua puede generar calor. Corrosivo para los metales. Contacto con zinc, aluminio, estaño y plomo en presencia de humedad, formando gas hidrógeno explosivo. Ataca algunas formas de plásticos, caucho o revestimientos.
Incompatibilidades
El hidróxido de sodio es una base fuerte y es incompatible con cualquier compuesto que se somete fácilmente a hidrólisis u oxidación. Reaccionará con ácidos, ésteres y éteres, especialmente en solución acuosa.
Eliminación de residuos
Descarga en el tanque que contiene agua, neutraliza y luego descarga al alcantarillado con agua.
Estado reglamentario
GRAS listado. Aceptado para su uso como aditivo alimentario en Europa.Incluido en la Base de Datos de Ingredientes Inactivos de la FDA (preparaciones dentales; inyecciones; inhalaciones; preparaciones nasales, oftálmicas, orales, óticas,rectales, tópicas y vaginales). Incluido en medicamentos no parenterales y parenterales con licencia en el Reino Unido. Incluido en la Lista de Ingredientes No medicinales Aceptables de Canadá.
Leave a Reply