Epigenética-No son solo los genes los que nos hacen
Entonces, ¿qué es la epigenética?
Otra forma de ver la epigenética es así; mientras que la genética tradicional describe la forma en que las secuencias de ADN en nuestros genes se pasan de una generación a la siguiente, la epigenética describe la transmisión de la forma en que se utilizan los genes. Para hacer una analogía informática, piense en la epigenética como metadatos, información que describe y ordena los datos subyacentes. Si posee un reproductor de MP3, por ejemplo, contendrá una gran cantidad de datos, los archivos MP3. Piense en estos como análogos a los genes. Pero también es probable que tengas listas de reproducción o que reproduzcas pistas por artista o género. Esta información, lista de reproducción, artista, género, etc. es metadatos. Determina qué pistas se tocan y en qué orden, y esto es lo que la epigenética es para la genética. Es un conjunto de procesos que afectan a los genes que se activan, o «expresan», como dirían los biólogos moleculares.
¿Cómo funciona la epigenética?
Entonces, la epigenética se trata de cómo se expresan y usan los genes, en lugar de la secuencia de ADN de los genes en sí, pero ¿cómo funciona esto? Muchos investigadores han estado estudiando epigenética en las últimas décadas, y actualmente es un área de intensa actividad de investigación. Sabemos que una parte de cómo funciona la epigenética es agregar y eliminar pequeñas etiquetas químicas al ADN. Puede pensar en estas etiquetas como notas post-it que resaltan genes particulares con información sobre si deben activarse o desactivarse. De hecho, la etiqueta química en cuestión se llama grupo metilo (ver Diagrama 1) y se usa para modificar una de las cuatro bases o «letras químicas», A, C, T y G, que conforman el código genético de nuestro ADN. La letra que se etiqueta es C o citosina y cuando se modifica, o se metila, se llama 5-metil citosina. Los grupos metilo se agregan al ADN por enzimas llamadas ADN metiltransferasas (DNMT).
-
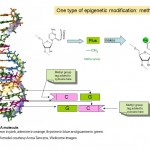
el Diagrama 1. Dos etiquetas químicas, los grupos metilo y acetilo que son centrales para los fenómenos epigenéticos y la estructura química de la citosina y la citosina 5-metilo en el ADN. La parte pentagonal de la molécula forma la «columna vertebral» continua del ADN . Solo se muestra una de las dos hebras de ADN que componen la familiar doble hélice.
El estado de abeja reina está determinado en parte por menos etiquetas metílicas
En la mayoría de los casos, el Cs más metilado en el ADN de un gen resulta en que el gen se desconecta. Las abejas melíferas nos proporcionan un buen ejemplo de cómo esto puede funcionar. Las abejas obreras y la reina tienen cuerpos muy diferentes; la reina es mucho más grande, de vida más larga, tiene un abdomen agrandado y pone muchos miles de huevos, mientras que las obreras más pequeñas son estériles pero tienen habilidades complejas de alimentación y comunicación. A pesar de esto, la reina y las obreras de una colmena son hembras y genéticamente idénticas. La clave de cómo se produce esto radica en la jalea real, una secreción que se alimenta a algunas larvas en desarrollo, y que resulta en que estas larvas se conviertan en reinas en lugar de en trabajadoras. Volveremos a la jalea real y sus propiedades para hacer reinas más adelante, pero una investigación fascinante mostró que si la cantidad del grupo metilo que agrega la enzima DNMT se redujo artificialmente en las larvas de abejas, entonces las larvas se convirtieron en reinas, incluso si no se alimentaron con jalea real. Por lo tanto, el cambio entre la reina y la trabajadora se puede cambiar por la abundancia de etiquetas de metilo en el ADN de las larvas de abeja. Una menor cantidad de etiquetas de metilo conduce a la activación de un gen o genes especiales en las larvas en desarrollo, lo que resulta en el desarrollo de las larvas en reinas y no en trabajadoras.Sin embargo, las etiquetas
en las colas también operan interruptores de genes
Las etiquetas metilo de ADN son solo una parte de la historia. En las células de todas las plantas y animales, el ADN se empaqueta o envuelve en nucleosomas donde la doble hélice de ADN se envuelve alrededor de un núcleo central de proteína (ver Diagrama 2). Alrededor de 150 letras de ADN (o pares de bases) están envueltos alrededor de cada nucleosoma, y esto ayuda a empaquetar los 3 mil millones de pares de bases de código genético en cada una de nuestras células. Los nucleosomas son demasiado pequeños para ser vistos con microscopios convencionales, pero los biólogos utilizan una técnica llamada difracción de rayos X para determinar la forma y organización de objetos como los nucleosomas, y en 1997 esta técnica reveló la hermosa estructura de los nucleosomas a alta resolución – véase (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
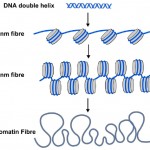
el Diagrama 2. La conocida doble hélice de ADN (azul) está envuelta alrededor de nucleosomas (cilindros grises) en las células. La cadena de nucleosomas se puede enrollar en un filamento más grueso, llamado fibra de 30 nm, y esto se puede enrollar en una fibra de cromatina aún más gruesa. Cuando los genes se activan, sus nucleosomas se desenrollan más como la fibra de 10 nm.
Los nucleosomas son compactos, pero los extremos o» colas » de las proteínas que componen el nucleosoma, que se llaman histonas, sobresalen de la estructura de nucleosoma compacta. Al igual que las etiquetas de metilo en el ADN, también se pueden agregar pequeñas etiquetas químicas a estas colas de histonas (ver el Diagrama 3). Dos de las etiquetas químicas que se agregan a estas colas son grupos acetilo y grupos metilo. Metilo, acetil y algunos otros tipos de etiquetas se pueden agregar a las colas en un gran número de combinaciones y esto afecta si un gen subyacente está encendido o apagado. De hecho, los genes pueden desactivarse de inmediato (esto se llama silenciamiento), activarse por completo o en algún lugar intermedio mediante etiquetas de metilo de ADN y etiquetas de cola de histona. La combinación de etiquetas de ADN e histonas también puede afectar la facilidad con que un gen se enciende o apaga.
-
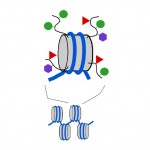
Diagrama 3. Se pueden agregar etiquetas químicas a las «colas» de las proteínas histónicas que componen los nucleosomas. Cilindro gris, nucleosoma; líneas negras curvas, colas de histonas; círculos verdes, etiquetas de metilo; triángulos rojos, etiquetas de acetilo; hexágonos malva, otros tipos de etiquetas.
Cuando las células se dividen
Cuando las células se dividen, toda la secuencia de ADN de la célula original (3 mil millones de pares de bases contenidas en 23 pares de cromosomas en una célula humana) se duplica para que ambas células hijas reciban una copia exacta. ¿Qué le pasa a todas esas etiquetas epigenéticas? Sabemos desde hace algún tiempo que las etiquetas ADN-metilo también se copian, de modo que ambas células hijas tienen el mismo patrón de metilación del ADN. Ahora sabemos que el patrón de las etiquetas de histonas también se duplica en su mayoría a medida que las células se dividen, aunque esto actualmente se entiende menos. Sin embargo, la división celular también es un momento en el que las etiquetas epigenéticas se pueden cambiar más fácilmente.
Retorno del gusano de larga vida
Justo al principio nos encontramos con la historia de los gusanos microscópicos de larga vida que superaron su longevidad a su descendencia, incluso si la descendencia individual no heredó el gen variante (mutación) que originalmente causó la prolongación de la vida útil. Ahora estamos en condiciones de explicar este resultado aparentemente extraño. En la mayoría de los casos, los genes contienen la información para fabricar una molécula de proteína, y las moléculas de proteína pueden ser enzimas que llevan a cabo reacciones químicas en la célula, o partes de la estructura de la propia célula. Resulta que los genes que mutaron en el estudio de gusanos producen proteínas que trabajan juntas para agregar una etiqueta metilo a los nucleosomas. Esta etiqueta es un interruptor de encendido. Cuando uno o más de los genes fueron mutados, esta etiqueta estaba ausente y varios genes que debían estar activados, incluidos algunos involucrados en el envejecimiento, se apagaron y los gusanos tuvieron una vida útil más larga. Lo inesperado es que se pensaba que las etiquetas epigenéticas se borraban o restablecían por completo durante la formación de espermatozoides y óvulos, por lo que, a diferencia de los genes en sí, no deberían transmitirse a la siguiente generación. Pero este resultado y otras investigaciones muestran que esto no siempre es el caso y que a veces, el patrón de etiquetas epigenéticas se transmite.
Cómo hacer una reina
El hecho de que una abeja larvaria se convierta en trabajadora o en reina depende de un interruptor epigenético, y este interruptor parece estar «volteado» por la jalea real. Pero, ¿qué tiene la jalea real que lleva a una larva que de otro modo crecería para ser trabajadora, para convertirse en reina? La respuesta radica en entender que las etiquetas químicas individuales que se agregan a las colas de histonas de los nucleosomas están siendo revisadas constantemente por la célula. Las etiquetas acetil se agregan por enzimas llamadas histonas acetil transferasas y se eliminan o borran por un segundo grupo de enzimas llamadas histonas desacetilasas (HDACs). Ambas enzimas están presentes en la mayoría de las células y esto permite que los genes se activen o desactiven con el tiempo.
Más etiquetas de acetilo ayudan a obtener el estatus de abeja reina
Recientemente, los investigadores se propusieron identificar compuestos en la jalea real que podrían alterar este proceso, y lo que encontraron fue algo conocido como un inhibidor de HDAC. Este era un compuesto químico relativamente simple que está presente en la jalea real y que detiene la acción de las enzimas HDAC que normalmente eliminan las etiquetas acetil de las histonas. Esto resulta en una acumulación de acetilo en las células de los embriones de abeja, y al igual que la reducción en los grupos ADN-metilo descrita anteriormente, se cree que esto activa genes clave necesarios para el desarrollo de una reina. Sin el inhibidor de HDAC en la jalea real, las larvas siguen un conjunto» predeterminado » de instrucciones genéticas y se convierten en obreras.Los inhibidores de HDAC no solo son importantes para las abejas reinas, sino que también forman parte de un pequeño pero creciente número de medicamentos médicamente útiles que se dirigen a las etiquetas epigenéticas y que son útiles en el tratamiento de algunos tipos de cáncer. Además, los HDAC también tienen un papel en la forma en que nuestros cerebros forman los recuerdos, y los nuevos medicamentos que afectan la acetilación de histonas pueden tener un papel en el futuro en el tratamiento del deterioro de la memoria en pacientes de edad avanzada.
El medio ambiente y la epigenética
Hemos visto cómo la diferencia entre una abeja reina y una abeja trabajadora se determina por la exposición a una sustancia química que altera directamente las etiquetas epigenéticas, como los grupos acetil; pero ¿hay ejemplos en los que la nutrición u otros aspectos del medio ambiente afectan a las poblaciones humanas de una manera que puede explicarse por la epigenética? Obviamente no podemos hacer experimentos en poblaciones humanas como podemos hacer en gusanos microscópicos o abejas, pero a veces la historia humana o los fenómenos naturales lo hacen por nosotros. Un ejemplo de ello es lo que se conoce como el invierno de Hambre holandés. En el último año de la Segunda Guerra Mundial en Europa, un embargo de alimentos impuesto por las fuerzas de ocupación alemanas a la población civil de los Países Bajos provocó una hambruna severa, coincidiendo con un invierno particularmente duro. Alrededor de 20.000 personas murieron de hambre al reducirse las raciones a menos de 1.000 kilocalorías por día. A pesar del caos de la guerra, la atención médica y los registros permanecieron intactos, lo que permitió a los científicos estudiar posteriormente el efecto de la hambruna en la salud humana. Lo que encontraron fue que los niños que estaban en el útero durante la hambruna experimentaron un aumento de por vida en sus posibilidades de desarrollar varios problemas de salud en comparación con los niños concebidos después de la hambruna. El período más sensible para este efecto fueron los primeros meses de embarazo. Por lo tanto, algo parece suceder al principio del desarrollo en el útero que puede afectar al individuo por el resto de sus vidas.
Los efectos epigenéticos a veces pueden pasar a los nietos
Aún más sorprendente, algunos datos parecen sugerir que los nietos de mujeres que estaban embarazadas durante el invierno de Hambre experimentan algunos de estos efectos. De lo que ya hemos discutido, esto sugiere fuertemente un mecanismo epigenético. De hecho, la investigación con las familias holandesas de Hambre Invernal continúa, y un estudio reciente que analiza un gen IGF2 encallado encontró niveles más bajos de la etiqueta metilo en el ADN de este gen en individuos expuestos a la hambruna antes de nacer. Aunque el IGF2 puede no estar involucrado en el aumento del riesgo de mala salud en estas personas, muestra que los efectos epigenéticos (es decir, la reducción del número de etiquetas metilo en genes particulares) que se producen antes del nacimiento pueden durar muchas décadas. Los estudios en animales también han encontrado que la dieta de la madre puede tener efectos en su descendencia. Por ejemplo, alimentar a las ovejas con una dieta que carece de los tipos de alimentos necesarios para hacer grupos metilo conduce a la descendencia con patrones alterados de metilación del ADN y que tienen tasas más altas de lo esperado de ciertos problemas de salud.
Epigenética e impresión, por qué los genes de mamá y papá no siempre son equivalentes
Todos tenemos 23 pares de cromosomas en nuestras células. Por cada par, uno vino de la madre y otro del padre. Por lo tanto, heredamos una copia de cada gen de cada padre y generalmente asumimos que la función del gen no depende de de qué padre provenga. Sin embargo, para los genes impresos las cosas son diferentes. Para estos genes, la copia materna o paterna del gen está activa, mientras que el otro se mantiene en silencio. Hay al menos 80 genes impresos en humanos y ratones, muchos de los cuales están involucrados en el crecimiento del embrión o la placenta. ¿Cómo se puede apagar una copia de un gen, mientras que la otra copia de la misma célula está encendida? La respuesta es epigenética. Probablemente el gen impreso más estudiado es el IGF2 (ver arriba). Una parte de IGF2 funciona como un interruptor. Si el ADN se metila aquí, se puede expresar el gen IGF2. El interruptor solo está metilado en la copia del gen de papá y, por lo tanto, solo esta copia se expresa, mientras que la copia materna es silenciosa. Se cree que este interruptor se instala en los gametos (óvulos y espermatozoides), de modo que desde el principio, los genes recibidos de mamá y los de papá se etiquetan de manera diferente con etiquetas epigenéticas y, por lo tanto, no son equivalentes.Los síndromes de Angelmann y Prader-Willi son dos afecciones genéticas distintas con síntomas diferentes, ambos causados por la pérdida de una parte del cromosoma 15. Los niños que heredan una copia de este cromosoma defectuoso desarrollan el síndrome de Angelmann o de Prader-Willi, a pesar de tener una copia normal del cromosoma de su otro padre. Entonces, ¿cómo la misma mutación (pérdida de parte del cromosoma 15) conduce a estas dos afecciones diferentes? La respuesta está en el descubrimiento de que esta pieza en particular del cromosoma 15 contiene una serie de genes que están impresos, por lo que solo se expresa la copia paterna o materna de estos genes; cuál de los dos síndromes aparece depende de si la deleción se produjo en el cromosoma heredado materno o paterno. Cuando el cromosoma defectuoso se hereda del padre, no hay copia funcional de los genes impresos que se desactivan en el cromosoma materno 15 y el resultado es el síndrome de Angelmann y viceversa para el síndrome de Prader-Willi. Esto es bastante diferente de la mayoría de las afecciones genéticas, como la fibrosis quística, donde un efecto en el desarrollo o la salud solo se ve cuando un gen o genes mutados se heredan de ambos padres.
Niños contra niñas, cómo desactivar un cromosoma completo
Un poco de genética que la mayoría de nosotros conocemos es lo que hace que un niño sea un niño y una niña una niña. Son los cromosomas X e Y. Al principio de nuestra existencia, cada uno de nosotros recibió un cromosoma X de nuestras madres a través del óvulo, y mientras que las niñas recibieron otro cromosoma X de sus padres, a través del esperma, los niños recibieron un cromosoma Y. El cromosoma Y en las células de un embrión masculino lo dirige a convertirse en un niño, mientras que con dos cromosomas X y sin cromosoma Y el embrión femenino se convierte en una niña. Ahora, pueden notar que hay un desequilibrio aquí. Todos tenemos dos cromosomas cada uno de los demás, pero para los cromosomas sexuales (X e Y) las niñas tienen dos X, mientras que los niños solo tienen una X (y una Y). Mientras que el cromosoma Y contiene pocos genes, principalmente involucrados en la» masculinidad», el cromosoma X contiene bastantes genes involucrados en procesos importantes como la visión del color, la coagulación de la sangre y la función muscular. Para igualar la «dosis» de genes del cromosoma X entre las células masculinas y femeninas, se desconecta un cromosoma X completo en las células femeninas. Esto se denomina inactivación del cromosoma X y ocurre muy temprano en el útero. En este proceso, las células desconectan aleatoriamente el cromosoma X paterno o materno, de modo que cuando nace una niña, su cuerpo es una mezcla o quimera de células donde se apaga el cromosoma X materno o paterno. La forma en que esto sucede involucra el tipo de etiquetas epigenéticas que hemos discutido y se ha sabido durante décadas que las células femeninas contienen un cromosoma X muy compacto llamado cuerpo Barr que se puede ver bajo el microscopio, y este es el cromosoma X inactivo.
El caso del gato con concha
Probablemente todos estemos familiarizados con los gatos con concha y sus abrigos moteados con parches de piel naranja y negra. Lo que quizás no sepas es que casi todos los gatos con este tipo de pelaje son hembras. La razón de esto es que un gen para el color del pelaje se encuentra en el cromosoma X del gato. Hay dos versiones de este gen, llamadas » O «y» o»; una da pelaje de jengibre y la otra negra. Dos copias de la misma versión en una gata hembra dan como resultado pelaje de jengibre o negro respectivamente, pero una copia de cada una da un efecto de concha de tortuga. Esto se debe a la inactivación del cromosoma X. La piel de estos gatos está compuesta por parches de células donde el cromosoma X materno o paterno está inactivado. Esto resulta en piel con el gen O activado y silenciado en algunos parches (piel naranja) y el gen O activado y silenciado en otros parches (piel negra), de ahí el patrón de concha de tortuga. Dado que los gatos machos solo tienen un cromosoma X, y no tienen inactivación del cromosoma X, son de color naranja o negro por todas partes.
Herencia epigenética, ¿se pueden pasar los estados epigenéticos de una generación a la siguiente?
Como hemos visto en el ejemplo de lombrices intestinales, los efectos epigenéticos (en este caso, vida útil prolongada) a veces se pueden transmitir de una generación a la siguiente, aunque los efectos solo parecen durar unas pocas generaciones. ¿Hay ejemplos en los que los efectos epigenéticos se transmiten a generaciones posteriores en humanos u otros mamíferos? Hay algunas pruebas de que los efectos del invierno de Hambre holandés afectaron a los nietos de las mujeres que estaban embarazadas durante la hambruna. De manera similar, en un estudio de una población del norte de Suecia del siglo XIX que sufrió ciclos de hambruna y abundancia, la cantidad de alimentos disponibles parece haber afectado la salud y la longevidad de la próxima generación.
El color del cabello en el ratón se puede determinar por un efecto epigenético
Quizás el ejemplo más conocido de efectos epigenéticos transgeneracionales lo proporciona el gen Agutí del ratón. Este gen controla el color del cabello y se activa en el momento justo en las células del folículo piloso para producir una franja amarilla en los pelos oscuros, lo que resulta en lo que se llama un abrigo agutí. Pero los ratones con una variante particular del gen Agutí llamada Avy tienen capas que están en cualquier lugar entre el patrón amarillo y el oscuro normal (agutí) de los ratones de tipo salvaje. Los ratones amarillos también se vuelven obesos y sufren otros problemas de salud. Por lo tanto, el gen Avy parece tener un efecto variable (de hecho, Avy significa amarillo Avariable). Cómo funciona esto ha desconcertado a los genetistas durante años, pero ahora podemos reconocer esto como un efecto epigenético. El pelaje amarillo se produce porque la versión Avy del gen Agutí tiene controles defectuosos y está encendida todo el tiempo. Sin embargo, las etiquetas metilo a menudo se agregan a la secuencia de ADN de control defectuoso y esto tiende a apagar el gen, lo que resulta en piel de agutí moteada u oscura en ratones individuales. Las crías nacidas en madres con el gen Avy varían en color de amarillo a oscuro, pero la proporción depende del color del pelaje de la madre; las camadas de hembras oscuras (agutíes) tienen más probabilidades de contener crías oscuras. Además, se observa una mayor proporción de descendencia oscura si tanto la madre como la abuela tienen la coloración oscura. Por lo tanto, la coloración agutí, que se determina epigenéticamente (por el número de etiquetas metilo en el gen Avy) puede, hasta cierto punto, transmitirse de una generación a la siguiente.
Los óvulos y los espermatozoides no suelen «traspasar» efectos epigenéticos
Aunque podemos encontrar casos en los que los efectos epigenéticos aparentemente duran de padres a hijos, este no suele ser el caso y casi todos los interruptores o marcas epigenéticas se restablecen en las células germinales (óvulos y espermatozoides) y en las primeras etapas de desarrollo de un embrión. De hecho, si este no fuera el caso, el asombroso desarrollo de un óvulo fertilizado en una criatura completamente formada sería imposible.
Pasar de un óvulo fertilizado a un humano completamente formado, todo está en el genoma (epi)
Hasta ahora hemos descrito algunos casos específicos de regulación epigenética, pero ahora sabemos que la epigenética en su sentido amplio, (cómo se expresan y usan los genes, en lugar de la secuencia de ADN de los genes en sí) es fundamental para que un óvulo fertilizado pueda dar lugar a un organismo completo y cómo las células de, digamos, su piel, siguen siendo células de la piel y son diferentes de las células cerebrales, a pesar de contener exactamente lo mismo genes. Poco después de la fertilización, un embrión humano en desarrollo consiste en una bola de células llamadas células madre embrionarias. Cada una de estas células tiene la capacidad de dar lugar a cualquiera de los tipos de células del cuerpo a medida que el embrión crece (por ejemplo, células cerebrales, células de la piel o células sanguíneas). Por el contrario, 9 meses después, cuando nace un bebé, la mayoría de las células que componen su cuerpo se comprometen a ser un tipo específico de célula con funciones específicas. A medida que las células se dividen, la bola de células madre embrionarias se desarrolla gradualmente en todos los tipos y estructuras celulares del bebé a término. Para que esto suceda, miles de genes deben activarse o desactivarse en el momento adecuado y en las células adecuadas a medida que crece un embrión. Por ejemplo, los genes que producen la proteína de queratina fibrosa que le da fuerza a nuestra piel, solo se activan en las células de la piel y no en el cerebro en desarrollo, y los genes necesarios para que las células cerebrales se desarrollen y realicen sus interconexiones están activados en el cerebro, pero no en la piel.
Durante el desarrollo, los genes deben activarse y desactivarse. Las etiquetas epigenéticas ayudan con esto
Un área de investigación muy grande hoy en día se refiere a cómo funciona todo este cambio de gen y una gran parte de este proceso utiliza las etiquetas químicas epigenéticas, especialmente las etiquetas de acetil e histona de metilo. Para que esas células madre embrionarias puedan dar lugar a todos los otros tipos de células, sus interruptores epigenéticos se reinician (casi) por completo en comparación con las células adultas. He puesto «casi» entre paréntesis, como sabemos por los genes impresos y la herencia epigenética transgeneracional, que hay excepciones.
Epigenética, Dolly la oveja y sus amigos
En febrero de 1997, una oveja llamada Dolly se convirtió en el ejemplo más famoso de su especie, convirtiéndose brevemente en una celebridad de la televisión. La razón de su fama es que fue el primer mamífero en ser «creado» por un proceso llamado transferencia nuclear de células somáticas, o en otras palabras, el primer clon hecho por el hombre (hecho por el hombre para ser distinto de los gemelos idénticos, que son clones naturales). El proceso que llevó a su nacimiento requirió un ovocito maduro (un huevo sin fertilizar) de una oveja hembra y una célula ordinaria de la ubre de una segunda oveja. En primer lugar, el núcleo (la parte que contiene el ADN) se eliminó del ovocito. Esto se hizo utilizando un microscopio especial, ya que aunque los ovocitos son bastante grandes en comparación con otras células, todavía son demasiado pequeños para verlos a simple vista. Luego, el núcleo de la célula de la ubre se insertó en el ovocito enucleado. Por lo tanto, Dolly tuvo tres «madres»: la donante del ovocito, la donante de la célula de la ubre y la oveja que llevó el embrión en desarrollo a término. Ningún padre estuvo involucrado. Aunque este proceso fue, y sigue siendo, muy ineficiente, fue la primera prueba de que los genes de una célula adulta de mamíferos pueden ser «reprogramados epigenéticamente» de nuevo al estado de las células madre embrionarias que pueden desarrollarse en cualquier otro tipo de célula. Posteriormente, el mismo proceso se ha aplicado a otras especies y puede tener usos médicos en la generación de células que podrían reparar tejidos dañados por lesiones o enfermedades.
Resumen: el epigenoma y el proyecto ENCODE – el «Gran Colisionador de Hadrones» de Biología
Mientras que el término «genoma» se refiere a toda la secuencia de ADN de un organismo (tres mil millones de letras para humanos), el epigenoma se refiere a todo el patrón de modificaciones epigenéticas en todos los genes, incluidas las etiquetas metil ADN, las etiquetas metil histona, las etiquetas acetil histona y otras etiquetas químicas que no hemos mencionado, en cada tipo de célula de un organismo. Esto representa una cantidad de información casi inimaginable, que empequeñece incluso el proyecto del genoma humano. Sin embargo, el conocimiento del epigenoma es esencial para responder plenamente a algunas de las preguntas más importantes de la biología, como por ejemplo: ¿cómo nos desarrollamos de una bola de células idénticas a un organismo completo? ¿por qué envejecemos? y ¿cómo podemos entender mejor enfermedades como el cáncer? No es de extrañar entonces que la epigenética y el epigenoma sea un gran área de investigación. Parte de la investigación en este campo está abarcada por el proyecto ENCODE (Enciclopedia de Elementos de ADN), una empresa en curso para identificar patrones de etiquetas epigenéticas en muchos tipos diferentes de células para todo el genoma humano (http://genome.ucsc.edu/ENCODE/). El proyecto ENCODE a veces se compara con el Gran Colisionador de Hadrones o LHC en Suiza. El LHC es el equipo científico más grande jamás construido y los experimentos que el físico realiza con él tienen como objetivo investigar los detalles fundamentales de la materia que compone nuestro Universo. Aunque los biólogos no tienen (o necesitan) un kit tan espectacular para su investigación, el esfuerzo por examinar la complejidad del epigenoma humano se ha comparado con el proyecto LHC debido a su escala, complejidad y la cantidad de información que se está creando.
Errores epigenéticos
La epigenética es un área en la que nuestro conocimiento científico está aumentando rápidamente. Una cosa que los científicos han descubierto es que los errores epigenéticos son comunes en enfermedades como el cáncer y en células envejecidas. Como resultado, los científicos están desarrollando medicamentos que se dirigen a los epigenomas defectuosos y uno de los primeros ejemplos es el uso de inhibidores de HDAC, similares al compuesto que se encuentra en la jalea real. A partir del estudio de patrones extraños de herencia, como la impresión genética, el ratón Avy amarillo/agutí, la población de gatos con concha hembra y otros fenómenos relacionados, los biólogos han descubierto una nueva capa de información que se encuentra «encima» de la secuencia de ADN de nuestros genes. Estos nuevos descubrimientos explican estas observaciones desconcertantes anteriores, pero también tienen un gran potencial para una nueva comprensión y tratamientos para enfermedades humanas.
Más información:
- Bird, Adrian. Epigenética. Experto Instantáneo No. 29′, New Scientist, 5 de enero de 2013, No. 2898.Carey, Nessa. «The Epigenetics Revolution: How Modern Biology is Rewriting Our Understanding of Genetics, Disease and Inheritance» (en inglés). Editorial: Icon Books. Libro de bolsillo 1 de marzo de 2012. ISBN-10: 1848313470. Precio PVP £9-99.
Epigenéticos y la Enfermedad en el sitio Web:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply