Enlace químico
Los enlaces químicos son las atracciones entre los átomos que los mantienen unidos para formar compuestos. Hay tres tipos principales de enlaces: enlaces covalentes que unen compuestos moleculares, enlaces iónicos que unen sales y cristales iónicos, y enlaces metálicos que unen los átomos de metales.
Moléculas y enlaces Covalentes
La mayoría de los combustibles, plásticos y productos naturales son compuestos moleculares, hechos de átomos unidos en moléculas. El tipo de unión que une los átomos de una molécula es la unión covalente, que ocurre cuando los electrones exteriores de dos átomos se comparten entre ellos, creando una atracción entre los dos átomos.
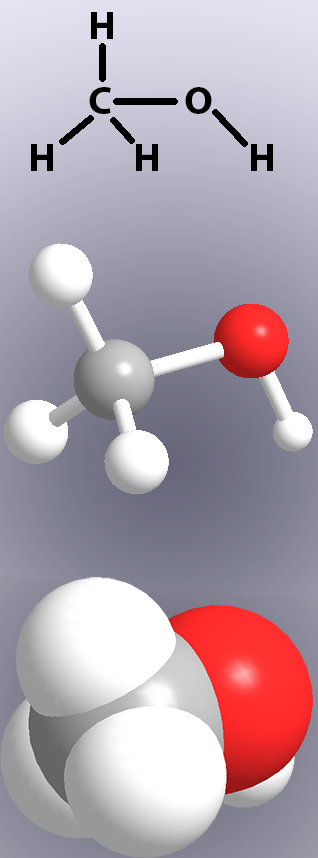
Los enlaces covalentes se muestran en estructuras químicas por líneas (Figura 1, arriba) y en modelos, ya sea mostrando «barras» o la superposición de los átomos (Figura 1, medio e inferior).
Los electrones en un enlace covalente no siempre se comparten por igual entre los dos átomos. Cuando la distribución es desigual, un átomo tendrá una carga positiva muy leve, y el otro átomo será ligeramente negativo. Esta caja contiene un dipolo eléctrico pequeño: las moléculas que contienen un dipolo son compuestos polares. El hecho de que una molécula sea polar o no polar afectará sus propiedades, como los puntos de fusión y ebullición, y el enlace de hidrógeno.
Lea más sobre la unión covalente en el texto libre de Química.
Enlace iónico y metálico
Mientras que el enlace covalente implica compartir electrones entre dos átomos, el enlace iónico implica la transferencia completa de electrones de un átomo a otro, creando iones positivos y negativos. Estos iones se mantienen unidos por la atracción entre sus cargas opuestas. Los compuestos iónicos forman cristales basados en estas atracciones.
El enlace metálico implica el intercambio completo de los electrones de valencia de los átomos metálicos, creando un «mar de electrones» en el que los electrones son libres de moverse. Esto es parte de la razón de la alta conductividad de los metales. Lea más sobre el enlace metálico en el texto libre de química
Enlaces energéticos y Químicos
En general, la energía se libera cuando se forma un enlace entre dos átomos, sin importar el tipo de enlace. De manera similar, si ya existe un enlace entre dos átomos, se requerirá energía para romperlo. La cantidad de energía requerida para romper un enlace es la misma que la cantidad de energía liberada cuando se forma.
La mayoría de las reacciones químicas implican la ruptura y la formación de enlaces químicos. Si la energía liberada al formar nuevos enlaces es mayor que la energía necesaria para romper los «viejos» enlaces, la energía será liberada en general por la reacción. Esta energía se puede perder como calor, o se puede usar para generar energía.
Por ejemplo, la combustión de metano (CH4) sigue esta reacción química:
Esta reacción implica la ruptura de los cuatro enlaces carbono-hidrógeno en el metano y el enlace oxígeno-oxígeno en el O2. Los nuevos enlaces formados son los dos enlaces carbono-oxígeno (en CO2) y los enlaces hidrógeno-oxígeno (en H2O). Estos nuevos enlaces tienen menos energía en general que los enlaces originales, por lo que la energía será liberada por esta reacción. La liberación de energía es una característica de las reacciones de combustión; es posible que lo haya notado al sentir una llama caliente. La siguiente animación ilustra la combustión de hidrocarburos del metano.
Dado que se libera una gran cantidad de energía al formar el CO2 y el H2O en la combustión de hidrocarburos como el metano, estos son una buena fuente de energía primaria. También significa que se necesitaría una gran cantidad de energía para romper los enlaces en el CO2 y formar otras moléculas. Esta es una de las razones por las que la fotosíntesis requiere tanta energía (de la luz solar) para convertir el CO2 en carbohidratos.
Para Leer Más
- Energía Química
- energía Primaria
- la tecnología de conversión de Energía
- O explorar una página al azar
Leave a Reply