El tratamiento de primera línea para el Cáncer de próstata resistente a la castración metastásico
En 2019, el cáncer de próstata (PCa) representa casi 1 de cada 5 nuevos diagnósticos de cáncer en hombres en los EE.1 En los últimos años, la tasa general de incidencia de cáncer de próstata (PCa) disminuyó en aproximadamente 7% por año.1 La fuerte caída en la incidencia se ha atribuido comúnmente a la disminución de las pruebas de antígeno prostático específico (PSA) de 2008 a 2013. La disminución del uso de los exámenes de detección del PSA se debió a las recomendaciones del Grupo de Trabajo de Servicios Preventivos de los Estados Unidos (EE.UU.) contra los exámenes de detección del PSA de rutina. Esta fue una recomendación de grado D específicamente para hombres de 75 años o más, que se declaró en 2008 y luego se amplió a todos los hombres en 2011, debido a la creciente preocupación por el sobrediagnóstico y el tratamiento excesivo.2 Aunque la prevalencia de las pruebas de APE dejó de disminuir y se estabilizó de 2013 a 20153, el efecto de la reducción de los exámenes de detección en la incidencia de la enfermedad avanzada aún no está claro. Un análisis de un gran registro de cáncer que cubre el 89% de la población de los Estados Unidos informó que la disminución general de la incidencia de PCa está, de hecho, enmascarando un aumento de los diagnósticos en etapas distantes a partir de 2010 en función de la edad y la raza.4
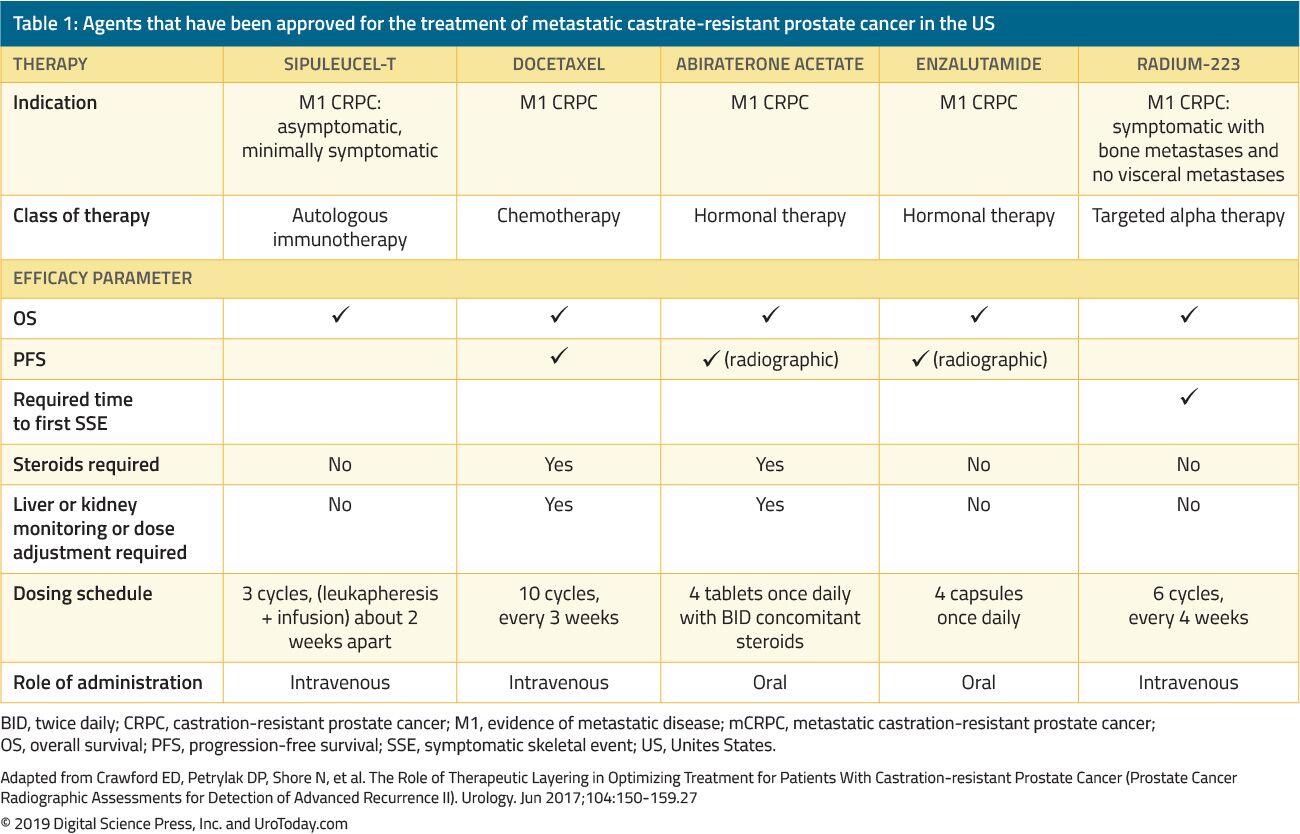
Independientemente del tratamiento administrado, aproximadamente 20-30% de los pacientes con PCa localizada progresan a enfermedad metastásica, comúnmente tratados con terapia hormonal.5 Esto se puede administrar mediante castración quirúrgica (orquiectomía bilateral) o mediante castración médica mediante terapia de privación de andrógenos (ADT). Ambos métodos alcanzan un nivel de testosterona sérica castrada que se considera el estándar de atención para el tratamiento de PCa sensible a hormonas metastásicas (mHSPC). Sin embargo, el mHSPC está destinado a progresar a cáncer de próstata resistente a la castración metastásico (cPCRM).6 El estado de cáncer de próstata resistente a la castración (CPRC) se define como la progresión de la enfermedad a pesar de alcanzar niveles de testosterona castrada (testosterona sérica < 50 ng/dL o 1.7 nmol / L), y puede presentarse como un aumento continuo de las concentraciones séricas de APE, progresión de la enfermedad preexistente o aparición de nuevas metástasis.7 CRPC tiene una mediana de supervivencia de aproximadamente tres años8 y se asocia con un deterioro significativo de la calidad de vida.9 El mecanismo exacto de transición de mHSPC a mCRPC aún no está claro. Sin embargo, se sabe que a pesar de los niveles castrados de andrógenos, el receptor de andrógenos (AR) permanece activo y continúa impulsando la progresión de la PCa en la CPRC.10 Esto ha llevado al desarrollo de nuevos agentes destinados a disminuir aún más la producción de andrógenos o bloquear la función AR. Sin embargo, hay otras vías biológicas que funcionan independientemente de la señalización de andrógenos y también resultan en CPRC. Se han producido varios cambios significativos en las opciones de tratamiento del espacio mHSPC, lo que ha dado como resultado un beneficio sustancial de supervivencia (consulte el enlace «Estrategia de tratamiento en rápida evolución del Cáncer de próstata metastásico Sensible a hormonas»), incluida la introducción de quimioterapia en el estudio CHAARTED11 y el ensayo STAMPEDE,12 la adición de acetato de abiraterona y prednisona en el estudio LATITUDE 13 y el ensayo STAMPEDE,14 la adición de enzalutamida en el ensayo ARCHES15 y el estudio ENZAMET, 16 y, por último, la adición de apalutamida, un antiandrógeno oral no esteroideo, que le gusta enzalutamida, se une directamente al dominio de unión a ligandos de la AR y previene la translocación de la AR, la unión al ADN y la transcripción mediada por la AR.17 El ensayo TITAN mostró un beneficio en la supervivencia global (SG) en pacientes con CPMH tratados con apalutamida.18 Apalutamida también ha mostrado un beneficio sobre el placebo en el entorno de CRPC no metastásico (nmCRP) en el ensayo SPARTAN fase 3 controlado con placebo,19 similar al beneficio mostrado por los pacientes con cáncer de próstata resistente a la castración no metastásico (nmCRPC) tratados con enzalutamida, en el ensayo PROSPER20 (consulte el enlace «Los nuevos tratamientos para el cáncer de próstata resistente a la castración no metastásico»). Estos avances en el tratamiento en el entorno de mHSPC y nmCRPC han planteado la cuestión de qué opciones de tratamiento se deben ofrecer a los pacientes en el entorno de mCRPC.El tratamiento de los hombres con CPRC ha cambiado drásticamente en los últimos 15 años. Antes de 2004, cuando los pacientes fallaban en la TPA primaria, los tratamientos se administraban únicamente para paliación. The landmark trials por Tannock et al.22 y Petrylak et al.23 en 2004 fueron los primeros en introducir quimioterapia con docetaxel en pacientes con cPCRM que demostraron mejorar su supervivencia. Sin embargo, desde que el docetaxel fue aprobado por la FDA, cinco agentes beneficiosos adicionales que muestran una ventaja de supervivencia han sido aprobados por la FDA en base a ensayos clínicos aleatorizados (Tabla 1). Estos incluyen enzalutamida y abiraterona, que afectan específicamente al eje andrógeno, sipuleucel-T, que estimula el sistema inmunológico24;cabazitaxel, que es otro agente quimioterapéutico;25 y radio-223, una terapia con radionúclidos.Otros 26 tratamientos para el cPCRM han demostrado mejorar los resultados, pero aún han sido aprobados por la FDA y se discutirán en otra revisión. Debido al aumento sustancial de múltiples agentes terapéuticos aprobados por la FDA en pacientes con CPRC, los médicos se enfrentan al desafío de una gran cantidad de opciones de tratamiento y múltiples secuencias potenciales de estos agentes, lo que hace que la toma de decisiones clínicas en CPRC sea significativamente más compleja.Tabla 1. Fármacos aprobados para el tratamiento del cáncer de próstata metastásico resistente a la castración en los Estados Unidos
El CPRM suele ser una enfermedad debilitante y es muy probable que los pacientes se beneficien de una estrategia de manejo formalizada por un equipo multidisciplinario integrado por urólogos, oncólogos médicos, oncólogos radioterápicos, enfermeros, psicólogos y trabajadores sociales.28 Es imperativo discutir las opciones de tratamiento paliativo al considerar el tratamiento sistémico adicional, incluido el manejo del dolor, el estreñimiento, la anorexia, las náuseas, la depresión y la fatiga.Otro punto crucial a considerar al establecer la secuencia de tratamiento adecuada en este espacio de la enfermedad es el costo asociado. Utilizando modelos que incluían líneas de tratamiento adicionales antes o después del docetaxel, el costo medio del tratamiento con CPCRM durante un período medio de 28,1 meses fue de aproximadamente 4 48,000 por paciente.29 Este costo es bastante alto debido al hecho de que los pacientes pueden recibir múltiples líneas de terapia e incurrir en servicios médicos continuos durante el curso de su enfermedad.30
Solo en dos ensayos se demostró un beneficio marginal de supervivencia para los pacientes que permanecen en tratamiento con análogos de la LHRH en lugar de agregar terapias de segunda y tercera línea.31, 32 Estudios han demostrado que el CPRC no es resistente a la ADT, sino más bien hipersensible a ella.10 Tratamiento mediada por la presión de selección durante ADT causa de la AR para amplificar, y asegurar que la situación no se agrave, ADT se continuó a ser administrado en el mCRPC configuración. La presión de selección mediada por el tratamiento también continúa a lo largo de toda la vida del tumor, lo que intensifica la necesidad de secuenciar correctamente las terapias. Sin embargo, debido a la falta de datos prospectivos, el beneficio potencial mínimo de la castración continua aún supera el riesgo mínimo de este tratamiento. Además, todos los tratamientos aprobados posteriormente se han estudiado en hombres con TPA en curso, lo que agrega otra razón por la que se debe continuar. Antes de ahondar en las opciones de tratamiento disponibles, es importante reconocer que todavía no está claro cuándo comenzar el tratamiento en pacientes con cPCRM que están completamente asintomáticos. Todavía se desconoce si el tratamiento anterior es superior, o si debemos esperar hasta que el paciente se vuelva sintomático y desarrolle dolor. Antes de iniciar el tratamiento, debemos considerar las comorbilidades existentes del paciente y los efectos adversos esperados del inicio del tratamiento. Los pacientes con cPCRM en estadio temprano en el ensayo COU-AA-302 que recibieron abiraterona, por lo general, sobrevivieron casi un año más que los que recibieron placebo (mediana de SG, 53,6 meses vs .41,8 meses, respectivamente, CRI, 0,61; IC 95%, 0,43 a 0,87; P=.006).33 Por lo tanto, los pacientes con CPCRM en estadio temprano se beneficiaron de un inicio más temprano de abiraterona. En el mismo ensayo, los pacientes con cPCRM asintomático o levemente sintomático, con APE basal < 15,6 ng/ml de abiraterona también produjeron una tasa más rápida y un mayor grado de disminución del APE que el placebo.34 Aunque los datos disponibles en la actualidad son limitados, lo más probable es que sugieran que es más ventajoso iniciar el tratamiento antes que más tarde.33,34
Opciones de tratamiento de primera línea aprobadas para el cáncer de próstata resistente a los castrados metastásicos
Abiraterona
Abiraterona es un antiandrógeno que es un inhibidor de la enzima 17α-hidroxilasa/C17, 20-liasa (CYP17). En el estudio de fase III COU-AA-302 se evaluó abiraterona en 1.088 pacientes con cPCRM asintomáticos o levemente sintomáticos sin metástasis viscerales que no habían recibido quimioterapia previa. En este ensayo, los pacientes fueron aleatorizados a acetato de abiraterona o placebo, ambos combinados con prednisona35 (Figura 1). Los pacientes se estratificaron según el estado funcional 0 ó 1 del Eastern Cooperative Oncology Group (ECOG) y según la enfermedad asintomática o levemente sintomática.35 La SG y la supervivencia sin progresión radiográfica (sLPR) fueron los criterios de valoración co-primarios. El ensayo demostró que después de una mediana de seguimiento de 22,2 meses, hubo una mejoría significativa de rPFS en el abiraterone brazo (la media de 16.5 vs 8.2 meses, HR 0.52, p < 0.001). En el análisis final, después de una mediana de seguimiento de 49.2 meses, el sistema operativo de punto final fue significativamente positivo (34.7 vs 30,3 meses, HR: 0.81, IC del 95%: 0,70 a 0,93, p = 0.0033).36 es importante recordar que mCRPC abarca una amplia pronóstico del espectro, incluso cuando se la quimioterapia ingenuo.En un análisis del grupo de abiraterona del estudio COU-AA-302, los pacientes que no presentaban dolor al inicio, niveles normales de fosfatasa alcalina y LDH y menos de 10 metástasis óseas tuvieron una mediana de SG de 42,6 meses.37 Sin embargo, los pacientes con más factores de riesgo de progresión tuvieron una mediana de SG significativamente más corta.37 Al evaluar el perfil de toxicidad de la abiraterona, pareció conferir más efectos adversos relacionados con el exceso de mineralocorticoides y anomalías de la función hepática, pero estos fueron en su mayoría efectos adversos clasificados de 1 a 2. Por último, la abiraterona también demostró ser igualmente eficaz en la población de edad avanzada (> 75 años).38
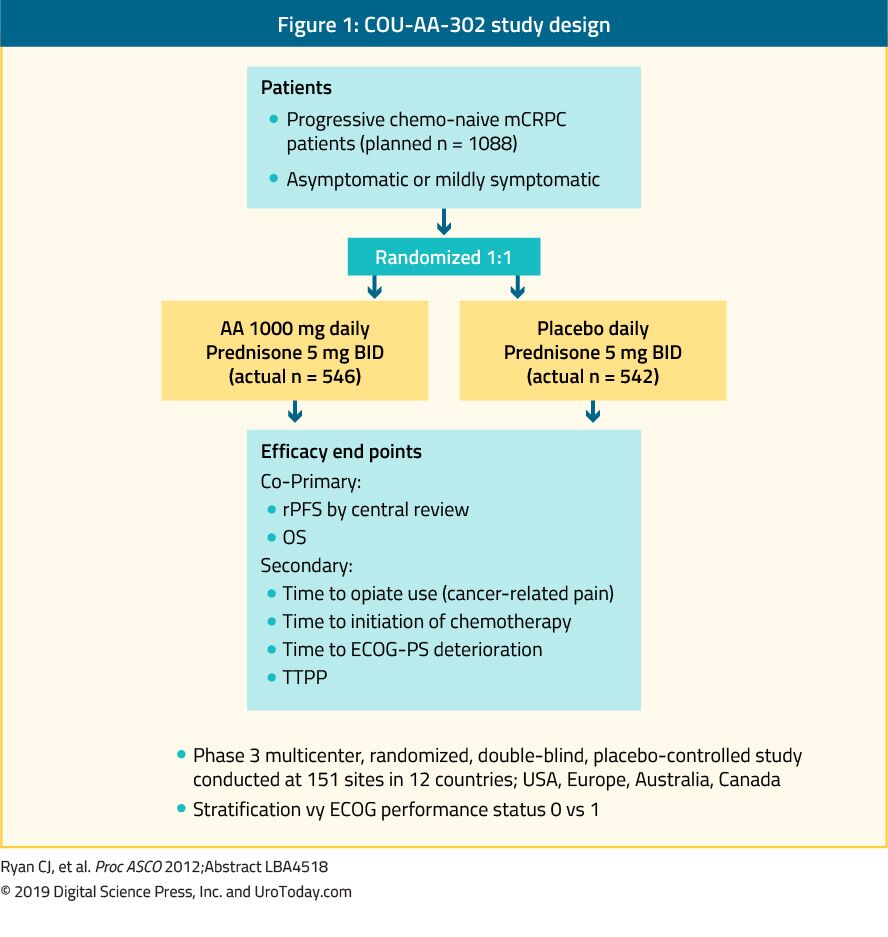
Figura 1. Diseño del estudio COU-AA-302
Enzalutamida
Enzalutamida es un antiandrógeno no esteroideo. El estudio PREVAIL, que es un ensayo aleatorizado de fase III, incluyó a 1.717 pacientes con CPCRM sin quimioterapia previa, y los pacientes con metástasis viscerales también fueron elegibles.39 En este ensayo se comparó enzalutamida con placebo (Figura 2). El ensayo PREVAIL mostró una mejora significativa en los pacientes tratados con enzalutamida en ambas variables co-primarias, que incluyeron sLPR (HR: 0,186; IC: 0,15-0,23, p < 0,0001) y SG (HR: 0,706; IC: 0,6-0,84, p < 0,001). El seguimiento extendido y el análisis final confirmaron un beneficio en la SG y la sLPR para enzalutamida.40 En 78% de los pacientes tratados con enzalutamida se notificó una disminución del PSA de más de 50%. Los acontecimientos adversos clínicamente relevantes más frecuentes fueron fatiga e hipertensión. Enzalutamida también fue igualmente eficaz y bien tolerada en hombres mayores (> 75 años)41 y en aquellos con metástasis viscerales o sin ellas.42 Sin embargo, para los hombres con metástasis hepáticas, no parecía haber ningún beneficio discernible.43 El ensayo TERRAIN comparó enzalutamida con bicalutamida, un antiandrógeno más antiguo, en un estudio aleatorizado doble ciego de fase II, que mostró una mejora significativa en la SSA (15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
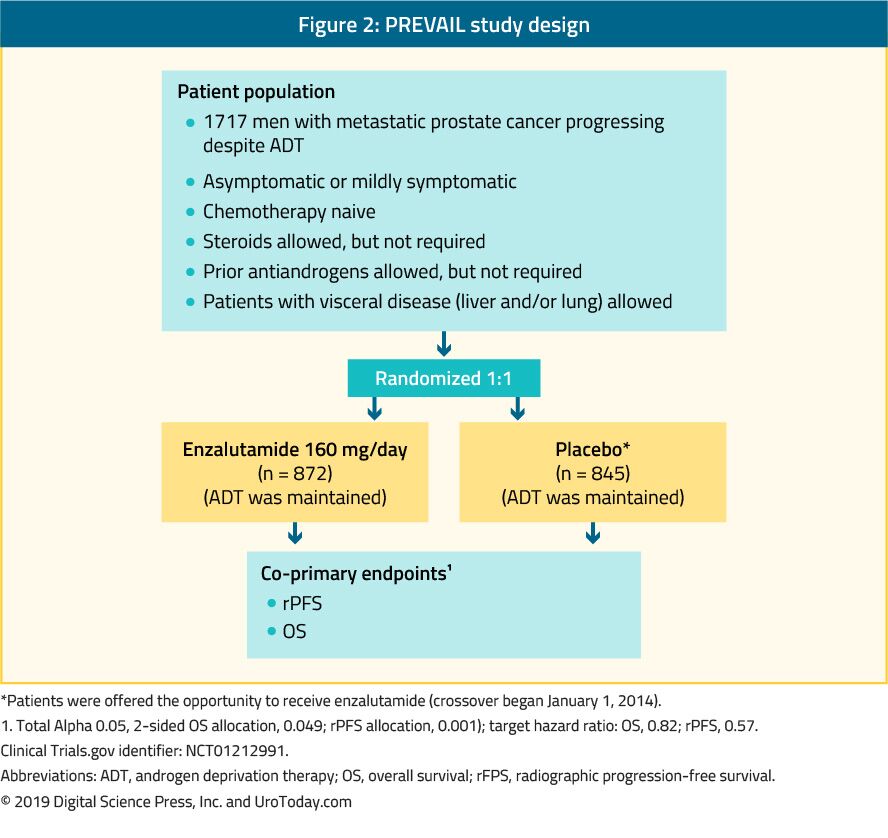
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). La quimioterapia de primera línea estándar es docetaxel 75 mg / m2 en dosis tres veces por semana combinadas con prednisona 5 mg dos veces al día, hasta diez ciclos. Hay varios factores pronósticos importantes que se deben considerar al administrar docetaxel: metástasis viscerales, dolor, anemia (Hb < 13 g/dL), progresión de la gammagrafía ósea y tratamiento previo con estramustina. Estos factores pronósticos pueden ayudar a estratificar la respuesta al docetaxel. Utilizando estos factores pronósticos, la enfermedad se puede clasificar en riesgo bajo, intermedio y alto, con estimaciones correspondientes de mediana de SG significativamente diferentes de 25.7, 18.7 y 12,8 meses, respectivamente.Aunque la edad por sí sola no es una contraindicación para el tratamiento con docetaxel, los pacientes deben estar lo suficientemente en forma para soportar este tipo de tratamiento y se deben evaluar las comorbilidades antes de iniciar el tratamiento. En hombres que se cree que no pueden tolerar la dosis y la pauta estándar de docetaxel, esta puede reducirse de 75 a 50 mg/m2 cada dos semanas, mostrando menos reacciones adversas de grado 3-4 y un tiempo más prolongado hasta el fracaso del tratamiento.46
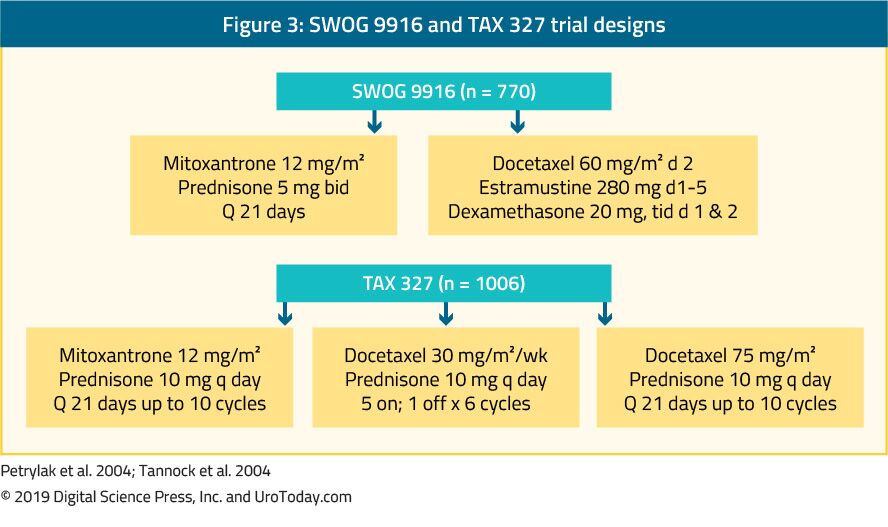
Figura 3. Diseños de ensayos SWOG 9916 y TAX 327
Sipuleucel-T
En un ensayo de fase III (ensayo IMPACT) se demostró que el Sipuleucel-T, una inmunoterapia celular activa autóloga, confería un beneficio de supervivencia en 512 pacientes con cPCRM asintomáticos o mínimamente sintomáticos en comparación con placebo24 (Figura 4). Después de una mediana de seguimiento de 34 meses, la mediana de supervivencia fue significativamente mayor en el sipuleucel-T grupo (25.8 vs 21,7 meses, con una HR de 0,78,p = 0.03).24 Es importante destacar que no se observó disminución del PSA durante o después del tratamiento y la SSP fue similar en ambos grupos. La tolerancia general al sipuleucel-T fue muy buena, con acontecimientos adversos de grado 1-2 en su mayoría. Actualmente, este tratamiento solo está disponible en los Estados Unidos y ya no está disponible en Europa.
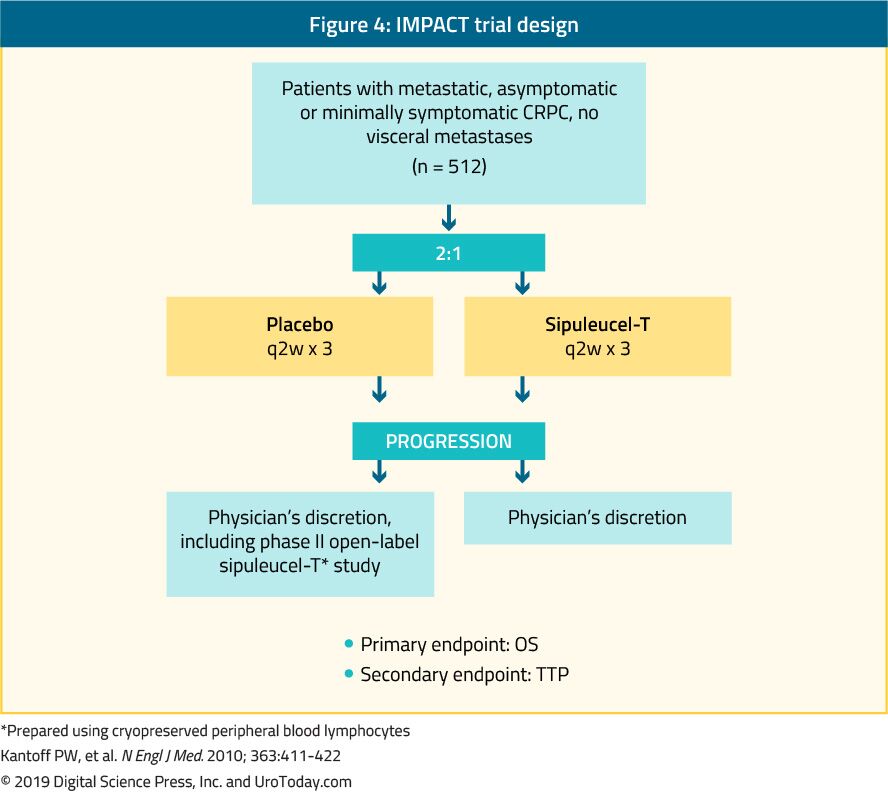
Figura 4. Diseño del ensayo IMPACT
Conclusiones
En los últimos 15 años, se han realizado considerables avances científicos e inversiones en el desarrollo de fármacos para pacientes con cPCRM. Esto ha dado lugar a la aprobación por la FDA de varias líneas de terapias sistémicas por motivos de paliación del dolor, minimización de los efectos adversos de la enfermedad y prolongación de la SG. Hasta la fecha, el impacto notificado en la SG en pacientes con cPCRM de cada uno de estos fármacos individuales sigue siendo modesto, lo que resulta en una adición de solo unos pocos meses. Es necesario mejorar nuestra comprensión de la biología de la enfermedad del cPCRM, integrar una comprensión molecular integral de la resistencia a la castración y analizar los mecanismos de resistencia a las terapias actuales para mejorar el desarrollo de tratamientos futuros. También es crucial invertir y desarrollar biomarcadores predictivos para ayudar en la personalización de la terapia. Por último, desde un punto de vista más práctico, se necesitan más datos sobre las terapias de segunda y tercera línea apropiadas, y la secuenciación y combinación de medicamentos disponibles, que se analizan con más detalle en el próximo artículo de revisión («Más allá del tratamiento de primera línea del cáncer de próstata resistente a la castración metastásica»).
Fecha de publicación: 19 de noviembre de 2019
Leave a Reply