Eche un vistazo a los artículos recientes
Resumen
Los tumores de cuerpo carotídeo son tumores neuroendocrinos hipervasculares de crecimiento lento y poco frecuentes. Aunque estos tumores son neoplasias benignas, también tienen una tendencia a la transformación maligna. La escisión quirúrgica completa es la modalidad terapéutica estándar de oro para el tratamiento de tumores de cuerpo carotídeo. Se recomienda la extirpación quirúrgica temprana para prevenir el desarrollo de tumores más grandes y avanzados, que se relacionan con una mayor morbilidad y mortalidad. En este informe, presentamos tres casos de tumor de cuerpo carotídeo que se trataron con éxito con escisión quirúrgica completa, y revisamos la literatura actual. Además, se enfatizó la necesidad de un manejo quirúrgico temprano, independientemente de la edad del paciente y el tamaño del tumor.
Palabras clave
Tumores de cuerpo carotídeo, manejo, escisión quirúrgica
Introducción
Los tumores de cuerpo carotídeo (TCC), también conocidos como paragangliomas o quimiodectomas, son neoplasias neuroendocrinas poco frecuentes que surgen cerca de la bifurcación carotídea dentro de las células glómicas derivadas de la cresta neural embrionaria. La incidencia reportada de TCC es de 1-2 por 100,000 . La mayoría de estos tumores son asintomáticos y se detectan inicialmente mediante inspección y palpación de la hinchazón del cuello durante el examen físico, o más comúnmente como hallazgos incidentales en estudios de imágenes radiológicas. Sin embargo, los síntomas más observados son dolor, disfagia y disfunción autonómica en casos sintomáticos . Aunque los TCC son lesiones benignas, tienen una tendencia a convertirse en tumores malignos en aproximadamente el 10% de todos los casos . Por lo tanto, para evitar la invasión local y la metástasis, la escisión quirúrgica temprana se considera una opción de tratamiento curativo de primer para el tratamiento de los TCC. En este trabajo, se reportaron tres casos de TCC que se trataron con éxito con escisión quirúrgica completa y se revisó la literatura actual.
Abordaje quirúrgico
Después de informar sobre la operación y obtener el consentimiento quirúrgico, los tres casos fueron llevados al quirófano para la escisión primaria bajo anestesia general. La masa tumoral se abordó a través de una incisión cervical oblicua. Los principios quirúrgicos básicos incluyeron la disección anatómica completa y el control vascular antes del intento de escisión del tumor. Para ello, se identificaron todas las estructuras neurovasculares y se realizaron disecciones periadventiciales de las arterias carótidas. Las arterias carótidas comunes, carótidas internas y carótidas externas se restringieron mediante cintas de vasos antes de la resección del tumor (Figura 1). Los vasos de alimentación que abastecían al tumor se ligaron inicialmente, luego se aisló el tumor de estructuras adyacentes y se extirpó (Figuras 2a y 2b). Mientras que las masas se extirparon fácilmente totalmente sin disección subadventicial de las arterias carótidas en los casos de Shamblin tipo I y II, en el caso de Shamblin tipo III, la disección se realizó a lo largo del plano subadventicial arterial para permitir la escisión tumoral local completa, así como la preservación de las arterias carótidas. En todos los casos, las masas se extirparon sin ninguna lesión neurovascular.
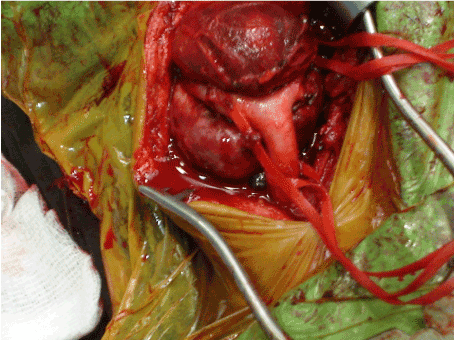
Figura 1. Vista intraoperatoria del tumor del cuerpo carotídeo antes de la escisión completa.
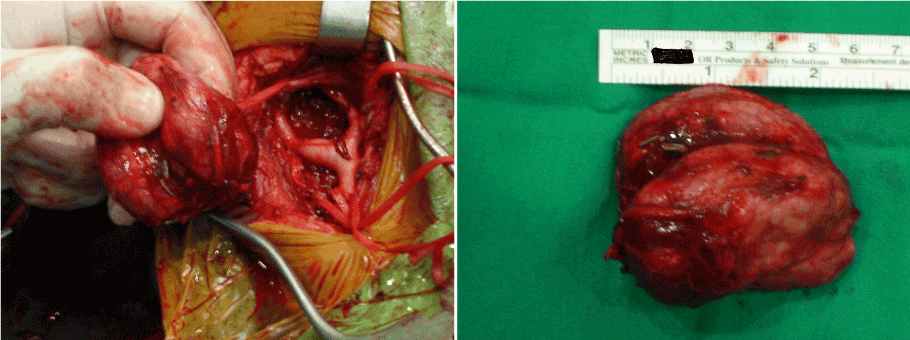
Figuras 2a y 2b. Vista intraoperatoria del tumor del cuerpo carotídeo después de la escisión completa.
Presentación de casos
Caso 1
Paciente de sexo femenino de 66 años de edad ingresada en nuestro ambulatorio por la presencia de hinchazón en la región cervical derecha. El examen físico, la ecografía dúplex y la angiografía por tomografía computarizada revelaron una masa en la bifurcación de la carótida derecha de 15 x 15 x 11 mm que se consideró TCC. Fue operada lo antes posible después del establecimiento del diagnóstico. Su lesión fue aceptada como Shamblin tipo I intraoperatorio. Fue trasladada a la unidad de cuidados intensivos para un seguimiento estrecho después de la operación. En el primer día del postoperatorio, se retiró el drenaje y la paciente fue trasladada a la clínica, luego fue dada de alta sin problemas el mismo día.
Caso 2
Paciente de sexo femenino de 75 años de edad ingresada en nuestro ambulatorio por la presencia de mareos e hinchazón en la región cervical derecha. El examen físico, la ecografía dúplex y la angiografía por tomografía computarizada revelaron una masa en la bifurcación de la carótida derecha de 40 x 30 x 24 mm que se consideró TCC. Además, se detectó insuficiencia vertebrobasilar de acuerdo con los hallazgos de la ecografía dúplex (volumen total de arterias vertebrales = 166 ml / min). Fue operada lo antes posible después del establecimiento del diagnóstico. Su lesión fue aceptada como Shamblin tipo II intraoperatorio. Fue trasladada a la unidad de cuidados intensivos para un seguimiento estrecho después de la operación. En el primer día del postoperatorio, se retiró el drenaje y la paciente fue trasladada a la clínica, después fue dada de alta sin problemas en el segundo día del postoperatorio.
Caso 3
Una paciente de 50 años de edad fue ingresada en nuestro ambulatorio por la presencia de mareos e hinchazón en la región cervical derecha. Sus síntomas, que se incrementaron gradualmente, habían existido durante unos 15 años. El examen físico, la ecografía dúplex y la angiografía por tomografía computarizada revelaron una masa en la bifurcación de la carótida derecha de 75 x 55 x 45 mm que se consideró TCC. Fue operada lo antes posible después del establecimiento del diagnóstico. Su lesión fue aceptada como Shamblin tipo III intraoperatorio. Fue trasladada a la unidad de cuidados intensivos para un seguimiento estrecho después de la operación. En la 4a hora del postoperatorio, el paciente fue trasladado a la clínica. En el 1er día postoperatorio, se retiró el drenaje y se le dio de alta sin problemas en el 2do día postoperatorio.
Discusión
cuerpo Carotídeo fue primeramente descrito por von Haller en el año 1743 . Es un órgano redondo de color marrón rojizo, bien circunscrito, altamente especializado, de 2-6 mm de tamaño, ubicado en la adventicia de la bifurcación carotídea, suministrado por los vasos de alimentación que corren principalmente desde la rama faríngea ascendente de la arteria carótida externa, e inervado a través de los nervios glosofaríngeo y vago. Funciona como un órgano quimiorreceptor que es estimulado por acidosis, hipoxia e hipercapnea, y desempeña un papel en el control autónomo de la presión arterial, la frecuencia cardíaca, la respiración y la temperatura sanguínea en respuesta a los cambios en estos parámetros al aumentar el flujo simpático .
Los TCC son tumores hipervasculares de crecimiento lento que representan aproximadamente 0,03% de todas las neoplasias. Parecen más comunes en el género femenino, con una proporción de hombres a mujeres de 1: 1,9 . Se notificó que estos tumores eran malignos en 10%, familiares en 10% y bilaterales en 10% de los casos esporádicos; la bilateralidad puede alcanzar 30% en los casos familiares .
En el año 1971, Shamblin, et al. se introdujo un sistema de clasificación según la relación con las arterias carótidas para determinar la resecabilidad de estos tumores. Los tumores de Shamblin de tipo I son masas localizadas y no involucran las arterias carótidas circundantes, los tumores de tipo II son adherentes o rodean parcialmente las arterias carótidas y, por lo tanto, son relativamente más difíciles de resecar, y los tumores de tipo III son grandes, encajonan los vasos y, por lo tanto, son el tipo más difícil de intentar resecar. De acuerdo con la clasificación de Shamblin, los tumores de tipo III se asocian con más complicaciones neurovasculares perioperatorias y procedimientos quirúrgicos complejos. Sin embargo, este sistema de clasificación tiene algunos inconvenientes, ya que no refleja la profundidad con la que el tumor se infiltra a través de la pared de las arterias carótidas, lo que decide si es posible preservar las arterias carótidas. Por lo tanto, Luna-Ortiz, et al. se sugirió una modificación del sistema de clasificación de Shamblin para producir Shamblin IIIb que se ha confirmado clínica o histológicamente que se infiltra en la adventicia del vaso, independientemente del tamaño del tumor.
Los diagnósticos diferenciales de TCC incluyen linfadenopatías reactivas cervicales, quistes cervicales laterales, quistes braquiales, paragangliomas vagales, nódulos tiroideos, aneurismas de la arteria carótida y tumores de la glándula parótida. Además de estos, también se debe recordar la hiperplasia corporal carotídea; puede desarrollarse a causa de hipoxia crónica y se describe principalmente en pacientes que viven a grandes altitudes .
Los TCC tienen dificultades diagnósticas y de manejo, ya que no hay guías en la literatura para su diagnóstico y tratamiento. Si se sospecha un diagnóstico de TCC después de un examen físico detallado, el diagnóstico casi siempre se establece mediante métodos de imagen radiológica, como la ecografía dúplex, la angiografía por tomografía computarizada, la angiografía por resonancia magnética y la angiografía digital por sustracción. Hoy en día, el examen ecográfico se usa ampliamente para la detección porque es una modalidad de imágenes no invasiva y de fácil acceso. Además, en su revisión multicéntrica y metanálisis, el Joint Vascular Research Group ha recomendado que la ecografía dúplex sea el examen diagnóstico primario para el diagnóstico de TCC . La tomografía computarizada y la resonancia magnética sirven para evaluar el tamaño, el grado y la invasividad del tumor. Los métodos angiográficos permiten la evaluación de los vasos que irrigan el tumor y la embolización preoperatoria . Debido a la hipervascularización y la proximidad a diversas estructuras vasculares y nerviosas de estos tumores, la biopsia como método de diagnóstico está contraindicada, ya que presenta un riesgo de hemorragia masiva y diseminación, y puede conducir a la formación de seudoaneurisma y trombosis carotídea también .
La primera extirpación quirúrgica exitosa de la TCC fue aplicada por Albert en el año 1889, y Gordon-Taylor definió una disección segura subadventicial en el año 1940. La desvascularización de TCC por ligadura de vasos de alimentación durante el procedimiento ha sido un método quirúrgico práctico común desde la década de 1980. En el año 2008, van der Bogt, et al. sugirió la técnica de disección craneocaudal que minimizaría la pérdida de sangre y, por lo tanto, reduciría el riesgo de morbilidad perioperatoria. En la actualidad, la escisión quirúrgica sigue siendo la modalidad terapéutica estándar de oro para el tratamiento de los TCC .
La radioterapia (RT) es una modalidad de tratamiento alternativa que puede disminuir el tamaño del tumor o detener su crecimiento. Se recomienda para pacientes que no pueden someterse a cirugía debido a un compromiso extenso, tumores múltiples y alto riesgo quirúrgico y anestésico . En el estudio realizado por Gilbo, et al. , que es la serie más grande con 156 casos de paraganglioma tratados con RT, los autores presentaron su experiencia de 45 años y observaron una disminución del tamaño en solo 5 tumores (3,2%) y una falta de crecimiento tumoral después de 5 años en el 99% de los pacientes.
La cuestión de la utilidad de la embolización preoperatoria es controvertida. Según algunos estudios, el procedimiento de embolización preoperatoria es beneficioso ya que reduce el flujo sanguíneo y disminuye el tamaño del tumor, por lo que puede facilitar la extirpación completa del tumor con menos pérdida de sangre, especialmente en tumores grandes . Por otro lado, en algunos otros estudios, la embolización preoperatoria no fue recomendada debido no solo a su inutilidad, sino también al riesgo de morbilidad postembolización, como ataque isquémico transitorio e incluso accidente cerebrovascular por partículas embólicas .
Las principales complicaciones relacionadas con el tratamiento quirúrgico de los TCC incluyen sangrado secundario a lesión vascular, déficit de nervios craneales y accidente cerebrovascular perioperatorio. Las tasas de complicaciones se correlacionan positivamente con la clasificación de Shamblin . Davila, et al. relataron que la tasa de lesión permanente del nervio craneal fue de 5,5%, y la tasa de ictus fue de 1%, sin mortalidad perioperatoria en su serie de 183 casos. Pacheco-Ojeda acaba de presentar la serie de casos más grande de la literatura con 215 TCC extirpadas quirúrgicamente. En su serie de casos, la tasa de complicaciones acumuladas fue de 27,5%, y estas complicaciones fueron en su mayoría menores y relacionadas con disfunción de los nervios craneales, sin accidente cerebrovascular perioperatorio y muerte. Recientemente se publicó un interesante estudio de revisión integral que examinó las complicaciones de la cirugía de TCC. En este estudio, se revisaron un total de 625 casos de 19 estudios, y se encontraron las tasas de lesión transitoria del nervio craneal, lesión vascular, lesión permanente del nervio craneal, accidente cerebrovascular y mortalidad perioperatoria como 31%, 28%, 17%, 2.5% y 0,5%, respectivamente .
Independientemente de la edad del paciente y el tamaño del tumor, se recomienda la extirpación quirúrgica temprana de los TCC para prevenir la aparición de tumores más grandes y avanzados (clase de Shamblin III), que se relacionan con una mayor morbilidad y mortalidad. La escisión quirúrgica completa de los TCC puede ser un desafío técnico debido a su proximidad a las principales estructuras norovasculares, así como a la compleja anatomía del cuello. Durante la cirugía, se deben identificar todas las estructuras neurovasculares para disminuir la frecuencia de complicaciones. El control proximal y distal de las arterias carótidas con la ligadura de las ramas de alimentación es importante para lograr la escisión tumoral completa. En conclusión, la escisión quirúrgica de TCC es un procedimiento muy eficaz y seguro con una baja tasa de complicaciones neurovasculares importantes y mortalidad. La detección temprana y la extirpación quirúrgica completa de los TCC mejoran los resultados.
- Sevilla García MA, Llorente Pendás JL, Rodrigo Tapia JP, García Rostán G, Suárez Fente V, et al. (2007) Paragangliomas de cabeza y cuello: revisión de 89 casos en 73 pacientes. Acta Otorrinolaringol Esp 58: 94-100.
- Jena A, Reddy GV, Kadiyala V, Brinda K, Patnayak R, Chowhan AK (2016) A case of large carotid body tumor: surgical challenge. Indian J Vasc Endovasc Surg 3: 96-98.
- Dixon JL, Atkins MD, Bohannon WT, Buckley CJ, Lairmore TC (2016) Manejo quirúrgico de tumores de cuerpo carotídeo: una experiencia de 15 años en una sola institución que emplea un enfoque interdisciplinario. Proc (Bayl Univ Med Cent) 29: 16-20.
- Albsoul NM, Alsmady MM, Al-Aardah MI, Altaher RN (2009) Manejo y desenlace del paraganglioma corporal carotídeo. Eur J Sci Res 37: 567-574.
- Gratiot JH (1943) Carotid body tumors: collective review. Internat Abstr Surg 77: 177-186.
- Jianu DC, Jianu SN, Motoc AG, Dan TF, Poenaru M, et al. (2016) An evaluation on multidisciplinary management of carotid body paragangliomas: a report of seven cases. Rom J Morphol Embryol 57 (2 Suppl): 853-859.
- Toktas F, Yümün G, Gücü A, Göncü T, Eris C, et al. (2014) Protective surgical procedures for carotid body tumors: a case series. Erciyes Med J 36: 133-135.
- Dorobisz K, Dorobisz T, Temporale H, ZatoŪ ski T, et al. (2016) Dificultades diagnósticas y terapéuticas en paragangliomas corporales carotídeos, basadas en la experiencia clínica y una revisión de la literatura. Adv Clin Exp Med 25: 1173-1177.
- Shamblin WR, ReMine WH, Sheps SG, Harrison EG Jr (1971) Tumor corporal carotídeo (quimiodectoma). Análisis clínico-patológico de noventa casos. Am J Surg 122: 732-739.
- Luna-Ortiz K, Rascon-Ortiz M, Villavicencio-Valencia V, Herrera-Gomez A (2006) ¿La clasificación de Shamblin predice la morbilidad postoperatoria en tumores corporales carotídeos? Una propuesta para modificar la clasificación de Shamblin. Arco Otorrinolaringol 263 Eur: 171-175.
- Sajid MS, Hamilton G, Baker DM, Joint Vascular Research Group (2007) A multicenter review of carotid body tumour management. Eur J Vasc Endovasc Surg 34: 127-130.
- Ferrante AM, Boscarino G, Crea MA, Minelli F, Snider F (2015) Paragangliomas cervicales: experiencia en un solo centro con 44 casos. Acta Otorhinolaryngol Ital 35: 88-92.
- Tong Y (2012) Papel de la ecografía dúplex en el diagnóstico y evaluación del tumor corporal carotídeo: Revisión de la literatura. Intratable Rare Dis Res 1: 129-133.
- van der Mey AG, Jansen JC, van Baalen JM (2001) Management of carotid body tumors. Otolaryngol Clin North Am 34: 907-924. Gordon-Taylor G (1940) Sobre tumores carotídeos. Br J Surg 28: 163-172.
- van der Bogt KE, Vrancken Peeters MP, van Baalen JM, Hamming JF (2008) Resección de tumores corporales carotídeos: resultados de una técnica quirúrgica en evolución. Ann Surg 247: 877-884.
- Moore MG, Netterville JL, Mendenhall WM, Isaacson B, Nussenbaum B (2016) paragangliomas de cabeza y cuello: Una actualización sobre la evaluación y el manejo. Otorrinolaringol Head Neck Surg 154: 597-605.
- Carroll W, Stenson K, Stringer S (2004) Tumor maligno del cuerpo carotídeo. Head Neck 26: 301-306.
- Gilbo P, Morris CG, Amdur RJ, Werning JW, Dziegielewski PT, et al. (2014) Radioterapia para paragangliomas benignos de cabeza y cuello: una experiencia de 45 años. Cancer 120: 3738-3743.
- Persky MS, Setton A, Niimi Y, Hartman J, Frank D, et al. (2002) Tratamiento endovascular y quirúrgico combinado de paragangliomas de cabeza y cuello a un enfoque de equipo. Head Neck 24: 423-431.
- Kasper GC, Welling RE, Wladis AR, CaJacob DE, Grisham AD, et al. (2006) A multidisciplinary approach to carotid paragangliomas. Vasc Endovascular Surg 40: 467-474.
- Jackson RS, Myhill JA, Padhya TA, McCaffrey JC, McCaffrey TV, et al. (2015) The effects of preoperative embolization on carotid body paraganglioma surgery: A systematic review and meta-analysis. Otorrinolaringol Head Neck Surg 153: 943-950.
- Zeitler DM, Glick J, Har-El G (2010) Embolización preoperatoria en cirugía de tumores de cuerpo carotídeo: ¿es necesaria? Ann Otol Rhinol Laryngol 119: 279-283.
- Sen I, Stephen E, Malepathi K, Agarwal S, Shyamkumar NK, et al. (2013) Neurological complications in carotid body tumors: a 6-year single-center experience. J Vasc Surg 57: 64S-8S.
- Davila VJ, Chang JM, Stone WM, Fow RJ, Bower TC, et al. (2016) Current surgical management of carotid body tumors. J Vasc Surg 64: 1703-1710.
- Pacheco-Ojeda LA (2017) Tumores corporales carotídeos: Experiencia quirúrgica en 215 casos. J Craniomaxilofac Surg.
- Amato B, Serra R, Fappiano F, Rossi R, Danzi M, et al. (2015) Surgical complications of carotid body tumors surgery: a review. Int Angiol 34: 15-22.
Leave a Reply