¿Cuál Es El Elemento Más Reactivo De La Tabla Periódica?
El flúor se identifica como el elemento no metálico más reactivo y el elemento más electronegativo en la tabla periódica, lo que lo convierte en el agente oxidante más fuerte. El cesio es el metal más reactivo en la tabla periódica, tanto que trabajar con este metal a menudo termina en explosiones.
¿Qué le dijo un químico a otro cuando lo encontró agraviado? «¿Por qué te aflige el sodio? Creo que estás exagerando!»¿Ves lo que hice allí? A veces me pregunto por qué, a pesar de mi hilaridad, me resulta muy difícil hacer amigos
De todos modos, aparte de mis malas calificaciones, lo primero que me viene a la mente cuando pienso en química son batas de laboratorio, vasos con formas extrañas, como reflejos de espejos de carnaval y explosiones llameantes. De vez en cuando, alguien murmura «reacción» o «reactividad», términos tan omnipresentes que los encontrarás infiltrándose en libros de química hasta su última página. Esto es exactamente lo que nos preocupa en este momento.

Desprovisto de cualquier jerga técnica, una «reacción» es exactamente lo que significa, una respuesta. La reactividad, por otro lado, se puede definir como la medida de la facilidad con que una especie química participará en una reacción y formará enlaces químicos. Entonces, la pregunta es: ¿qué elemento es el más fácil de incitar? Pero primero…
¿Qué determina la reactividad de un elemento?
En términos simples, una reacción química es la oportunidad perfecta para que compradores y vendedores compren y vendan bienes. Los compradores y vendedores son elementos químicos. Los bienes son electrones y la moneda que se intercambia es energía.
El propósito de este comercio es lograr estabilidad, una configuración óptima de electrones, que se logra cuando la envoltura de valencia (exterior) de un elemento está completamente llena o vacía. Básicamente, un elemento puede comprar más electrones para llenar su penúltima shell o venderlos para vaciarla.

Cuantos menos electrones estén involucrados, menor será el gasto de energía. Cualquiera que esté familiarizado con la forma parsimoniosa de funcionamiento de la naturaleza adivinará que los oficios que requieren la menor cantidad de energía son los que tienen más probabilidades de ocurrir. Esto tiene sentido, ya que un elemento preferiría perder electrones y quedar vacío si su capa más externa está menos que medio llena, o ganar algunos para llenarse a sí mismo, si está más que medio lleno. Comprar seis cuando simplemente puedes perder dos sería una completa tontería, pero lo más importante, ¡caro!
Por lo tanto, la reactividad es una función de la facilidad con que un elemento pierde o gana electrones.
¿Cómo estimamos los incentivos de un elemento?
La tabla periódica y sus»tendencias»
¿Cómo averiguamos si un elemento es comprador o vendedor? Nos referimos a la tabla periódica.
La tabla periódica es un recordatorio de que los científicos están al borde del TOC y no pueden evitar organizar todo de una manera extremadamente ordenada y ordenada. La tabla periódica organiza cada elemento que conocemos de una manera colocada.
La tabla ordena los elementos de acuerdo con su número atómico, que es el mismo que el número de protones o electrones que abarcan. (¿No es raro que tiendan a ser exactamente iguales?)
Tendencia 1
El número de electrones en la valencia shell aumenta por uno, así como nosotros analizar a través de cada elemento en una fila, aunque el número de conchas sigue siendo el mismo. El número de conchas se puede deducir del número de fila. Por ejemplo, cada elemento de la segunda fila contendrá solo dos cáscaras y así sucesivamente.
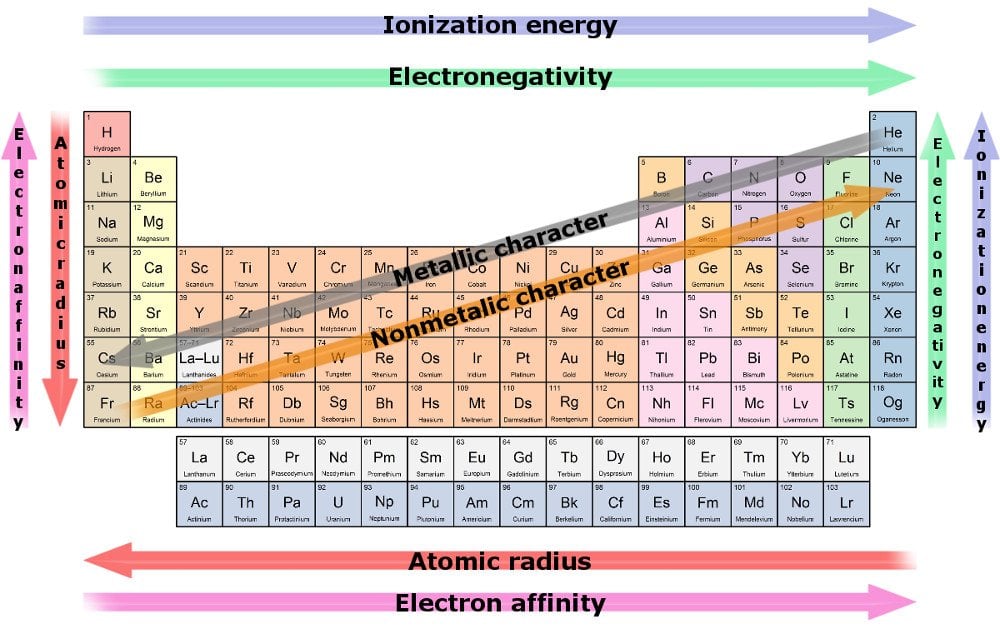
Una consecuencia de esta tendencia es que el radio atómico disminuye a medida que avanzamos hacia el último residente de una fila. La razón es que el aumento de electrones está siendo reflejado por el aumento de protones en el centro, mientras que los primeros deben amontonarse en la misma envoltura. En la guerra de tira y afloja entre los protones que tiran y los electrones que se incrementan, el primero gana, lo que resulta en una mayor atracción nuclear, acercando todas sus capas a él.
Por lo tanto, debido a una fuerte atracción, es más probable que un elemento compre o gane electrones a medida que nos movemos a lo largo de una fila. La medida de la capacidad de un elemento para atraer electrones hacia él se conoce como electronegatividad. El elemento más electro-negativo es el que tiene más probabilidades de robar electrones y reaccionar más rápido.
Tendencia 2
Otra tendencia es el aumento en el radio de los elementos a medida que nos movemos hacia abajo en una columna, mientras que el número de electrones de valencia sigue siendo el mismo, a pesar de que el número atómico sigue aumentando. Esto se debe a que el aumento de electrones es paralelo a un aumento de capas. Los metales pesados tienen un radio aumentado, especialmente aquellos en el fondo superior. Ilustran la atracción nuclear más pobre y, en consecuencia, tienen una retención deficiente de sus electrones más externos.

La medida de la capacidad de un elemento para perder electrones se conoce como electro-positividad, y aumenta a medida que bajamos por una columna. De nuevo, el elemento más electropositivo es el que tiene más probabilidades de abandonar sus electrones y reaccionar más rápido.
Ahora que conocemos las reglas, revelemos a los ganadores.
El flúor no metálico más reactivo
El flúor es el primer elemento del grupo halógeno. Es un gas amarillo pálido, diatómico, altamente corrosivo e inflamable con un olor acre. Su número atómico es 9, y tiene un atasco de 7 electrones en su envoltura de valencia. Además, reside en la segunda fila, lo que implica que todos sus 9 electrones están de alguna manera hacinados en solo 2 capas.
Un caparazón de valencia de 7 electrones requiere que gane solo un electrón para completar su caparazón final y lograr estabilidad, lo cual no es una gran hazaña si se considera su pequeño tamaño y vigoroso tirón nuclear. El flúor se identifica como el elemento más electronegativo en la tabla periódica, lo que lo convierte en el agente oxidante más fuerte. Es el no metal más reactivo.

El flúor es tan reactivo que puede quemar sustancias que uno generalmente pensaría que no son inflamables. ¡Puede quemar vidrio, agua e incluso arena! Su promiscuidad hace imposible almacenarlo o aislarlo en su forma más pura. Debido a su reactividad salvaje, su historia temprana de aislamiento y experimentación está llena de accidentes mortales. Sí… fatal.
El cesio de metal más reactivo
El cesio es un metal de color dorado que reacciona explosivamente con el aire y el agua. Su número atómico es 55. El cesio reside en la primera columna y en la penúltima fila. Como hemos discutido, el radio de un elemento tan bajo en la columna es bastante grande en comparación con los elementos anteriores.

(Crédito de la Foto : Dnn87 / Wikimedia Commons)
El radio grande hace que su tracción nuclear sea ineficaz y lo hace terriblemente torpe. Su gran tamaño lo hace altamente susceptible a la ionización. Es altamente aquiescente y fácilmente abandona el electrón en su envoltura de valencia para lograr estabilidad, lo que lo hace altamente reactivo. El cesio es el metal más reactivo en la tabla periódica, tanto que trabajar con este metal a menudo termina en explosiones.
Francium
Francium es el último elemento de la primera columna, situado justo debajo del cesio, lo que lo convierte en el átomo más grande de la columna. Lógicamente, se podría deducir que Francio debe poseer una reactividad superior en comparación con el cesio, pero este no es el caso.
Se estima que no hay más de una onza de ella en la corteza terrestre a la vez. Dado que es tan escaso de forma natural, los científicos deben producirlo para estudiarlo.

(Crédito de la Foto : MarlonMarin1 / Wikimedia Commons)
Sin embargo, incluso cuando está aislado de alguna manera, no dura mucho tiempo. Francium es de naturaleza radiactiva, tiene una vida media de solo 22 minutos, por lo que se descompone antes de que tenga la oportunidad de reaccionar. Además, la presencia de tantos protones hace que sus electrones se muevan a velocidades increíblemente altas. Como Einstein se dio cuenta, a escalas tan pequeñas y velocidades tan altas, comienzan a ocurrir cosas extrañas: los electrones se acurrucan un poco más cerca del núcleo de lo que uno esperaría lógicamente, lo que los hace un poco más difíciles de eliminar.
Por lo tanto, parece que Francio es el elemento más reactivo, por desgracia teóricamente.
alerta de Spoiler!
Es posible que haya notado que los dos elementos considerados más reactivos solo son ganadores en sus categorías específicas: metales y no metales. Lamento ser un aguafiestas, pero no hay una respuesta definitiva a quién es el elemento más reactivo entre todos, porque se necesitan dos para bailar el tango.
Se podría preguntar qué elemento es el más reactivo con el sodio? La respuesta es flúor, no cesio. O, tal vez quieras saber qué elemento es el más reactivo con nitrógeno. ¡Es Litio! Sorpresa!
El término reactividad a menudo se malinterpreta notoriamente. La pregunta es ambigua y algo incompleta, como se espera que muestre este artículo.
Leave a Reply