Compuestos Covalentes
Ahora tiene una breve idea de por qué los diferentes elementos se comportan de manera diferente. Pero, ¿sabe que una gran parte de esto se debe a la «naturaleza» de los enlaces en los compuestos? Al igual que usted y sus mejores amigos tienen una serie de diferencias debido a las cualidades «internas», así es el caso de los compuestos iónicos y covalentes. En este capítulo, aprenderemos más sobre el concepto de compuestos covalentes, veremos sus propiedades y más.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Esto se debe a que los átomos dentro de las moléculas covalentes están muy unidos. Cada molécula es de hecho bastante separada y la fuerza de atracción entre las moléculas individuales en un compuesto covalente tiende a ser débil.
Necesitamos muy poca energía para separar las moléculas. Esto se debe a las fuerzas de atracción entre las moléculas con la ausencia de carga eléctrica general. Los compuestos covalentes suelen ser moléculas gaseosas a temperatura y presión ambiente. También pueden ser líquidos con puntos de ebullición relativamente bajos.
Estas características podrían atribuirse a sus débiles fuerzas intermoleculares que mantienen unidos a estos átomos. Sin embargo, también tenemos muchos compuestos covalentes sólidos. Tienen puntos de fusión bajos. Sin embargo, es interesante observar que un pequeño número de estos tienen una estructura completamente diferente. Forman enormes estructuras donde un gran número de átomos se mantienen unidos. Esto es posible debido a la presencia de electrones compartidos.
Estas estructuras moleculares gigantes son básicamente retículos formados por moléculas que se mantienen unidas por una estructura de enlaces covalentes. Estos enlaces covalentes son muy fuertes. También tienden a ser muy duros con altos puntos de fusión que son diferentes de la mayoría de los compuestos covalentes. El ejemplo de este tipo de compuestos covalentes incluye el diamante y el grafito de la red de átomos de carbono. También incluyen sílice de la red de átomos de silicio y oxígeno.
Descargue la Hoja de trucos de Unión química en PDF haciendo clic en el botón de descarga a continuación


h3>
- Parámetros de Enlace
- Fundamentos de Enlace Químico
- Hibridación
- Enlace de hidrógeno
- Compuestos Iónicos o Electrovalentes
- Teoría de Orbitales Moleculares
- Polaridad de enlaces
- Estructuras de resonancia
- Enlace de valencia Teoría
- Teoría de VSEPR
Propiedades generales de los compuestos covalentes
- Los compuestos covalentes suelen tener puntos de fusión bajos. Una excepción a esto incluye moléculas de sílice y diamantes que tienen un alto punto de fusión.
- Estos compuestos tienen puntos de ebullición bajos. Esto se puede atribuir a su débil fuerza de atracción entre los diversos átomos enlazados. Las fuerzas de Van Der Waals unen estos átomos.
- Estos compuestos suelen ser gases y líquidos con bajos puntos de ebullición y fusión.
- Los compuestos covalentes sólidos tienen estructuras blandas como el grafito. Esto se debe a la presencia de una nube de electrones entre cada capa de átomos de carbono.
- Estos compuestos son no conductores de carga eléctrica. La ausencia de iones cargados es la razón principal detrás de esto. Una excepción a esto es el grafito, donde vemos una nube de electrones. Esto hace que el grafito sea un buen conductor.
- También son malos conductores de calor. Sus moléculas carecen de electrones libres y eso obstruye el flujo de energía térmica.
- Los compuestos covalentes no poseen características polares como propiedad general. Por lo tanto, estos compuestos son insolubles en agua. Las moléculas de agua no son absolutamente neutras y tienen una ligera carga negativa en el átomo de oxígeno y ligeras cargas positivas en los átomos de hidrógeno, y dado que los compuestos covalentes están compuestos de moléculas neutras o moléculas con cargas ligeras y, por lo tanto, no son atraídas fuertemente por las moléculas de agua.
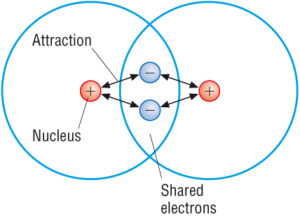
(Fuente: Google)
Propiedades físicas Y químicas
- Los compuestos covalentes líquidos se evaporan. Esto significa que las moléculas de líquidos y sólidos pierden de su superficie al aire.
- Estos compuestos tienen muy menos afinidad entre sus moléculas.
- Varios compuestos covalentes tienen sus propias moléculas de forma característica. Sus enlaces están dirigidos a ángulos preestablecidos.
- Algunos compuestos especialmente los medicamentos son solubles en agua. El resto son solubles en aceite.
- La mayoría de los compuestos covalentes son no polares o tienen muy poca tendencia a dividirse completamente para formar iones y, por lo tanto, nunca conducen electricidad.
- A temperatura y presión normales, encontraremos estos compuestos como líquidos o gases. Pero también hay sólidos y tienen pesos moleculares más altos.
- Los cristales de compuestos covalentes son de dos tipos: Uno que tiene una fuerza de van der Waal débil que los mantiene unidos como en el yodo. Estos son fácilmente fusibles y volátiles, el otro tiene una gran red de átomos que configuran las macromoléculas.
- Estos compuestos son solubles en disolventes orgánicos como éter y benceno.Los enlaces covalentes son de naturaleza direccional. Por lo tanto, exhiben el fenómeno del isomerismo.
- Los compuestos covalentes tienen una tasa de reacciones muy lenta, a diferencia de los diversos compuestos iónicos.
Ejemplos resueltos para Usted
Propiedades generales de los compuestos covalentes

(Fuente: Google)
Propiedades físicas Y químicas
Pregunta: ¿Por qué los compuestos covalentes no son solubles en agua?
Respuesta: Las moléculas de agua no son absolutamente neutras. Estas moléculas tienen una ligera carga negativa en el átomo de oxígeno y ligeras cargas positivas en los átomos de hidrógeno. Por otro lado, sabemos que los compuestos covalentes están formados por moléculas neutras o moléculas con cargas ligeras. Es por esta razón que estos compuestos no son atraídos fuertemente por las moléculas de agua.
Leave a Reply