CIMAvax-EGF: A novel therapeutic vaccine for advanced lung cancer
REPORT
CIMAvax-EGF: A novel therapeutic vaccine for advanced lung cancer
Gisela González1, Agustin Lage1, Tania Crombet1, Gryssel Rodríguez1, Beatriz García1, Ariadna Cuevas1, Lisel Viña1, Norkis Arteaga1, Elia Neninger2
1Center of Molecular Immunology, CIMAve. 216 corner 15, Atabey, Playa, POBox 16 040, Havana, Cuba
2Hermanos Ameijeiras HospitalSan Lázaro #701 e/ Belascoín y Marqués González, Centro Habana, Ciudad de La Habana, Cuba.
RESUMEN
Se muestran los resultados que permiten a la Agencia Reguladora Cubana (CECMED) otorgar el Registro Sanitario de la vacuna oncológica CIMAvax-EGF para el cáncer de pulmón no microcítico avanzado (CPNM). Este fue el primer registro de una vacuna terapéutica en Cuba y también el primer registro de una vacuna contra el cáncer de pulmón en el mundo. Por lo tanto, se ofrece una vacuna terapéutica única a los pacientes con cáncer de pulmón, que aumentará la supervivencia y su calidad de vida. Con este fin, se enfrentaron importantes desafíos preclínicos, clínicos, regulatorios, productivos y de negociación. Los resultados obtenidos en estos campos dieron lugar a 18 artículos científicos publicados en revistas de alto impacto y 4 objetos de invención, generando varias patentes en Cuba y otros países. En el entorno preclínico, se demostró inmunogenicidad, seguridad y efectos antitumorales en diferentes especies animales. La experiencia clínica comenzó en 1995. Hasta ahora, cinco ensayos clínicos de fase I a II han concluido en Cuba, dos de fase II también han concluido, uno en Cuba y otro en Canadá y el Reino Unido, y un ensayo de fase II a III con un calendario optimizado, así como un ensayo de fase III están actualmente en curso en Cuba. En el ámbito normativo, se diseñó y ejecutó una estrategia de registro acelerado. Para desarrollar este producto único se necesitaban conceptos normativos novedosos. Se llevó a cabo un proceso productivo escalable, reproducible y controlado, junto con un sistema de calidad que garantizaba el cumplimiento completo de las BPF. Los fondos para el desarrollo de productos procedían de la implementación de una nueva estrategia de negociación: la negociación de intangibles.
Palabras clave: Vacuna contra el cáncer, CPCNP, Registro Rápido, CIMAvax-EGF, Ensayo Clínico de Fase II-III
INTRODUCCIÓN
La relación entre el sistema formado por el receptor del Factor de Crecimiento Epidérmico (EGFR) y sus ligandos con el desarrollo del cáncer es bien conocida. En los tumores de origen epidermoide, hay una sobreexpresión del EGFR que se relaciona con el mal pronóstico y las recaídas tempranas después de la cirugía. Es por eso que este sistema se ha convertido en un objetivo importante para las terapias antitumorales.
Los mecanismos de proliferación celular se inician con la unión del FEAG al EGFR. Nuestro enfoque terapéutico consiste en una vacuna con una formulación de EGF que la hace inmunogénica e induce una respuesta inmune humoral. La producción de anticuerpos específicos anti-EGF que se unen al EGF autólogo impide que se una al EGFR, lo que desencadena los mecanismos de proliferación celular derivados de esa interacción (1-4).
Aquí presentamos los resultados del registro en Cuba de esta vacuna (CIMAvax-EGF). Esto formaba parte de una estrategia global que incluía nuevas contribuciones clínicas, regulatorias, tecnológicas y empresariales, y está respaldada por 18 artículos científicos internacionales y propiedad intelectual en todo el mundo. También describimos innovaciones en diferentes campos que permitieron el registro de CIMAvax-FEAG en Cuba y Perú.
RESULTADOS Y DISCUSIÓN
La vacunación con EGF es segura, inmunogénica y aumenta la supervivencia con una buena calidad de vida en pacientes con cáncer de pulmón en estadios avanzados
La experiencia clínica con CIMAvax-EGF en la terapéutica del cáncer de pulmón de células no pequeñas (CPNM) en estadios avanzados comenzó en 1995. Hasta ahora, se han concluido cinco ensayos clínicos de fase I a II en Cuba; se concluyeron 2 ensayos clínicos aleatorizados de fase II, uno en Cuba y otro en Canadá y el Reino Unido, y hay un ensayo de fase III en curso en Cuba. Más de 800 pacientes con cáncer avanzado han sido tratados con CIMAvax–EGF, lo que demuestra que es seguro, inmunogénico y capaz de aumentar la supervivencia con una buena calidad de vida.
El objetivo principal de los ensayos de fase I-II fue decidir la mejor formulación de la vacuna (proteína portadora y adyuvante), la dosis y la pauta terapéutica. Estos resultados demostraron las ventajas de la proteína P64k como la proteína portadora y Montanide ISA51 como el adyuvante. También se demostró el aumento de la inmunogenicidad de la ampliación de la dosis (5-7).
El análisis de los datos agrupados de todos los ensayos de fase I-II mostró un aumento significativo de la supervivencia en aquellos pacientes con mejores respuestas de anticuerpos o buenos respondedores de anticuerpos (GAR), y en pacientes con disminuciones más pronunciadas de las concentraciones de sueros de EGF () resultantes de la vacunación. También se demostró un aumento significativo de la supervivencia de todos los pacientes vacunados en comparación con un control histórico simultáneo (7).
Se realizó un ensayo clínico de fase II en 80 pacientes, que fueron aleatorizados para recibir CIMAvax-EGF y el mejor tratamiento de apoyo (BSC) (40 pacientes) o BSC solo (40 pacientes), después de concluir la quimioterapia de primera línea. Los hallazgos previos fueron corroborados en este ensayo. Aproximadamente el 50% de los pacientes vacunados eran GAR y sobrevivieron significativamente más que los pacientes que no alcanzaron la clasificación GAR (que se clasificaron como pacientes con baja respuesta a anticuerpos, PAR). Del mismo modo, los pacientes con la mayor disminución sobrevivieron significativamente más que los pacientes que no mostraron esta disminución (Tabla 1). Se observó una correlación inversa significativa entre los títulos de anticuerpos anti-EGF y , que se produjo en los pacientes vacunados pero no en los controles, demostrando así que fue causada por la vacunación (Figura 1).
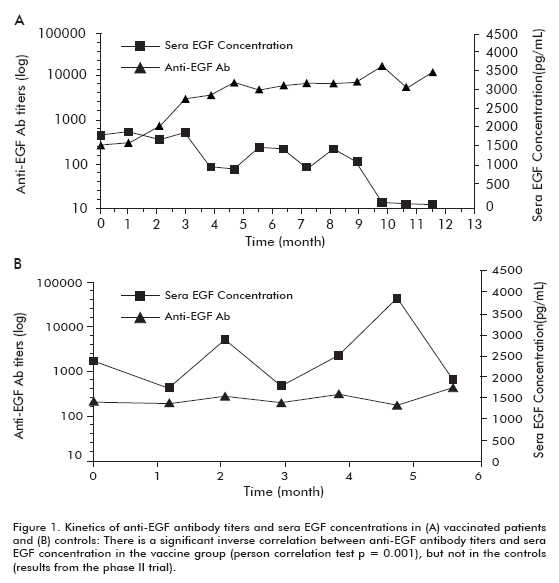
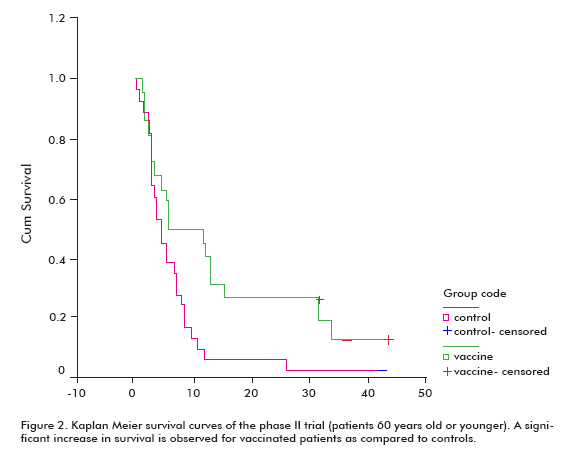
Hubo una tendencia a un aumento de la supervivencia en todos los pacientes vacunados (18,53 ± 11,47; media ± mediana), en comparación con los controles no vacunados (7,55 ± 5.33), que fue significativa en el grupo de pacientes de 60 años o menos (Log rank test; p < 0,05) (Figura 2) (8).
Como se evidencia en un ensayo de competencia in vitro, los sueros de pacientes vacunados inhibieron la unión del EGF al EGFR. Esta inhibición de la unión fue proporcional a los títulos de anticuerpos y a la supervivencia. Además, los sueros de pacientes vacunados inhibieron la fosforilación del EGFR en proporción a sus títulos de anticuerpos anti-EGF.
Se estudió el reconocimiento preferencial del sitio de unión EGF/EGFR (bucle B de la molécula EGF). Los pacientes cuyos sueros reconocen preferentemente el asa B sobrevivieron significativamente más que los pacientes que no reconocieron este epítopo (9).
Se concluyó recientemente un ensayo de optimización de dosis / cronograma en Cuba (fase I-II). En su diseño, se consideraron todos los elementos que aumentaban la inmunogenicidad en ensayos anteriores, que incluían: Montanida ISA51 como adyuvante, dosis aumentadas, cuatro lugares de inyección y administración de dos dosis de vacuna antes de la quimioterapia de primera línea, seguida de vacunación. Los resultados de este ensayo demostraron un aumento significativo de la inmunogenicidad, con un 95% de GAR que alcanzó diez veces los títulos máximos de anticuerpos anteriores. Todos los pacientes vacunados sobrevivieron significativamente más que los controles del ensayo de fase II (10).
También se encontró un aumento de la capacidad de los sueros de los pacientes para inhibir la unión al EGF/EGFR y la fosforilación del EGFR. En el séptimo mes, después de concluir la quimioterapia, la respuesta de anticuerpos cambió hacia el asa B de la molécula de EGF, lo que podría indicar una mejora en la calidad de la respuesta inmunitaria. Los resultados de este ensayo demostraron que existe un margen de mejora en la respuesta a CIMAvax-EGF que se puede alcanzar manipulando la dosis y el esquema terapéutico (10).
Los resultados de estos ensayos se están validando en un ensayo de fase III actualmente en curso en Cuba.
Diseño e implementación de una estrategia reguladora para el registro de vacunas para ponerla a disposición de todos los pacientes avanzados de cáncer de pulmón no microcítico
CIMAvax-EGF es una vacuna terapéutica para el cáncer de pulmón única en el mundo. Se diseñó e implementó una estrategia global, guiada por requisitos regulatorios, para el registro acelerado en Cuba. Una estrecha relación entre el patrocinador (CIM) y la Agencia Reguladora Cubana (CECMED) tuvo el propósito de establecer los requisitos para la obtención de un producto y su rápida aplicación en beneficio de pacientes con cáncer avanzado sin ninguna otra alternativa terapéutica. Esta estrategia incluía el diseño de un sistema de calidad, controles de calidad y especificaciones, así como requisitos de GMP para cubrir las diferentes etapas del desarrollo del producto. Esta estrategia global se puede utilizar en el desarrollo de otros productos similares.
La experiencia y documentación regulatoria acumulada condujo a la aprobación de ensayos clínicos en diferentes países. El expediente que contenía toda la información permitió registrar CIMAvax-FEAG en Cuba y Perú. Por lo tanto, podemos afirmar que tenemos una estrategia definida para el registro de medicamentos en diferentes países.
El proceso de producción GMP que genera un producto escalable, consistente y que cumple con las especificaciones
El primer desafío para diseñar un proceso de producción para CIMAvax-EGF fue contar con una preparación inmunogénica de EGF. Se obtuvo mediante la conjugación química del EGF recombinante humano con la proteína de membrana recombinante, P64k (de Neisseria meningitidis). El conjugado se inyecta junto con un adyuvante apropiado (actualmente, Montanide ISA 51 de Seppic, Francia).
Inicialmente se diseñó un proceso a escala de laboratorio. Posteriormente, se diseñó e implementó un proceso sanitario y reproducible escalable, que cumplía con las directrices GMP. También se diseñaron e implementaron ensayos analíticos in vitro e in vivo para evaluar la calidad de las materias primas y de los productos intermedios y finales.
Todas las modificaciones fueron evaluadas y respaldadas por la estrategia Reguladora actual. Los resultados del estudio de equivalencia, para comparar ambos productos, recibieron la aprobación por parte de CECMED de la aplicación del proceso escalado, y la aprobación del producto obtenida en este proceso para su uso clínico. La ampliación y optimización del proceso de producción dio paso a una publicación (11) y a un nuevo objeto de invención, con patentes posteriormente presentadas en diferentes países.
La negociación de intangibles nos otorgó fondos para el desarrollo de proyectos y también experiencia de aprendizaje en nuestro trabajo conjunto con autoridades reguladoras de diferentes países
Este proyecto se negoció con contrapartes extranjeras sobre la base del novedoso concepto de «negociación de intangibles», apoyado principalmente a través de la propiedad intelectual de nuestro producto que estaba en desarrollo. Esta estrategia de negociación consistió en otorgar licencias al proyecto para su desarrollo conjunto con otros países, lo que significa que las contrapartes extranjeras cubrieron los gastos de las acciones regulatorias y los ensayos clínicos en sus territorios. Como resultado de estas negociaciones, Cuba recibió pagos por hitos. Esta modalidad de negociación también nos permitió tener un intercambio constante con especialistas aquí y en el extranjero, aumentando así nuestra experiencia. Nuestros resultados positivos con esta modalidad de negociación podrían aplicarse a otros productos en curso en nuestro país.
RELEVANCIA DEL ESTUDIO
CIMAvax-EGF es la primera vacuna terapéutica para el tratamiento del cáncer registrada en Cuba, y la primera registrada en el mundo para el tratamiento del cáncer de pulmón. El cáncer de pulmón es un problema de salud sin resolver, con más de 1,3 millones de casos diagnosticados cada año y el mismo número de muertes en todo el mundo. En Cuba, es la principal causa de muerte por cáncer en ambos sexos, con una incidencia de más de 4.000 fallecidos por año. La terapia de elección para los pacientes diagnosticados en estadios avanzados es la quimioterapia de primera línea, que se puede administrar simultáneamente con radioterapia. Se trata de un tratamiento paliativo no curativo, con una respuesta completa a la quimioterapia muy poco frecuente y respuestas objetivas (completas o parciales) que ocurren en solo 25% de los pacientes.
CIMAvax-EGF ofrece un tratamiento alternativo para estos pacientes que ya han recibido quimioterapia de primera línea. Los efectos adversos graves de los tratamientos de quimioterapia y/o radioterapia son bien conocidos y deterioran gravemente la calidad de vida. En su lugar, la vacunación con CIMAvax-EGF solo genera efectos adversos leves o moderados, en lugar de graves, que se pueden resolver con cuidados de apoyo convencionales, al tiempo que mejora la supervivencia de los pacientes con cáncer de pulmón avanzado y ofrece una buena calidad de vida.
Hasta ahora, más de 800 cubanos han sido tratados con CIMAvax-EGF en más de 20 hospitales de todo el país. El Registro de CIMAvax-EGF permite extenderlo a todos los pacientes del país que fueron diagnosticados con cáncer de pulmón avanzado; convirtiendo a Cuba en el primer país del mundo con un programa nacional que utiliza esta alternativa terapéutica.
En cuanto a beneficios económicos, a través de las negociaciones de este Proyecto hemos obtenido 6.346 millones de dólares. La estrategia de negociación del proyecto es para su desarrollo conjunto con otros países, lo que significa que la contraparte extranjera cubre los gastos de los ensayos clínicos en su propio país, haciéndolo asequible. Estos ensayos requieren inversiones de millones de dólares, y esto solo es posible si cuenta con el apoyo de contrapartes extranjeras. Al mismo tiempo, esta estrategia ofrece más datos clínicos a Cuba, sin los gastos de llevar a cabo los ensayos aquí. Hasta ahora, se han realizado ensayos clínicos en Canadá, Reino Unido y Malasia. En un futuro próximo, comenzarán los ensayos clínicos en China y Europa.
Además, como parte de esta estrategia de concesión de licencias, las contrapartes extranjeras están a cargo del registro de productos en las regiones donde tienen derechos comerciales. Durante los procesos de registro y comercialización, Cuba recibirá pagos por hitos y posteriormente, como regalías de ventas.
El mercado mundial de vacunas contra el cáncer se considera del orden de miles de millones de dólares. El hecho de que Cuba tenga un producto único para el tratamiento avanzado del cáncer de pulmón puede proporcionarnos un potencial de exportación que puede financiar el uso de este producto en nuestro Sistema Nacional de Salud.
CONCLUSIONES
La vacunación con CIMAvax-EGF es segura, inmunogénica y conduce a un aumento de la supervivencia con buena calidad de vida en pacientes con tumores pulmonares en estadios avanzados. El diseño e implementación de una estrategia reguladora para el registro de esta vacuna la puso a disposición
para todos los casos de pacientes con cáncer de pulmón no microcítico avanzado en Cuba. Esta experiencia positiva podría aplicarse a otros productos similares en curso. Se desarrolló un proceso de producción escalable, consistente y reproducible, que cumplía con las directrices GMP, para generar un producto que cumpliera con las especificaciones. La experiencia en la negociación de intangibles ha sido muy positiva, y nos ha otorgado fondos para el desarrollo de proyectos, al tiempo que apoya la experiencia de aprendizaje derivada del trabajo conjunto con las autoridades reguladoras de diferentes países.
AGRADECIMIENTOS
Los autores quieren agradecer a los siguientes especialistas del Centro de Inmunología Molecular su contribución a este trabajo: Rolando Pérez, Loany Calvo, Suhamy Atencio, Belinda Sánchez, Irene Beausoleil, Ernesto Chico, Airama Alvisa, Ileana Cartroman, Sergio Cata, Ana Veloso, Reinaldo Cuervo, Yanelda López, Yosniel Hernández, Antonio Vallin, Alejandro Portillo, Liuva Madera, Guido Ferrer, Diana Borges, Niuvis Pérez, Tamara García, Idaine Cuenca, Mayra Santaelena, Joaquin Solozabal, Aida Rodríguez, María Elena García, Adis Torres, Eric Chong, Carmen Viada, Mauricio Catala, Soraida Acosta, Bárbara Wilkinson, Olga Torres, Normando Iznaga all of them from the Center of Molecular Immunology, and also to Daniel González, Lourdes B Costa, Galina M Moya, Rolando Páez, Gerardo Guillén, Vivian Pujol, Dinorah Torres del Centro de Ingeniería Genética y Biotecnología.
1. González G, Montero E, León K, Cohen IR, Lage A. Autoinmunización al Factor de Crecimiento Epidérmico, un componente del homúnculo im-munológico. Autoimmun Rev 2002; 1: 89-95.
2. Lage A, Crombet T, González G. Targeting epidermal growth factor receptor signalling: early results and future trends in oncology. Ann Med 2003; 5 (35): 327-36.
3. González G y Lage A. Vacunas contra el Cáncer para la Privación Inmunitaria de Hormonas: The EGF Vaccine Approach: Leading Topics in Cancer Research, Capítulo 11, Ed Nova Publishers, 2007.
4. González G y Lage A. Vacunas contra el cáncer para la privación inmunitaria del factor de crecimiento / hormona: un enfoque factible para el tratamiento del cáncer. Curr Cancer Drug Targets 2007; 7: 229-41.
5. González G, Crombet T, Torres F, Catala M, Alfonso L, Osorio M, et al. Vacuna contra el cáncer basada en el factor de crecimiento epidérmico para el tratamiento del cáncer de pulmón de células no pequeñas. Ann Oncol 2003; 14: 461-6.
6. Crombet T, Neninger E, Catalá M, García B, Leonard I, Martínez L, et al. Tratamiento de pacientes de CPCNP con una vacuna contra el cáncer basada en EGF. Informe de un ensayo de fase I. Cancer Biol Ther 2006; 5 (2): 136-41.
7. González G, Crombet T, Neninger E, Viada C, Lage A. Vacunación terapéutica con factor de crecimiento epidérmico (FGE) en cáncer de pulmón avanzado: análisis de datos agrupados de tres ensayos clínicos. Hum Vaccines 2007; 3 (1): 8-13.
8. Neninger E, De la Torre A, Osorio M, Catald M, Bravo I, Mendoza M, et al. Ensayo controlado aleatorizado de fase II de una vacuna con factor de crecimiento epidérmico para el cáncer de pulmón de células no pequeñas en estadio avanzado. J Clin Oncol 2008; 26: 1452-8.
9. García B, Neninger E, De la Torre A, Leonard I, Martínez R, Viada C, et al. La inhibición eficaz de la unión al Receptor del Factor de Crecimiento Epidérmico/Factor de Crecimiento Epidérmico por anticuerpos antifactor de Crecimiento Epidérmico está relacionada con una mejor supervivencia en pacientes avanzados con cáncer de pulmón no microcítico tratados con la vacuna del Factor de Crecimiento Epidérmico. Clin Cancer Res 2008; 14 (3): 840-6.
10. Neninger E, Verdecia BG, Crombet T, Viada C, Pereda S, Leonard I, et al. Combinación de una vacuna contra el cáncer basada en EGF con quimioterapia en cáncer de pulmón no microcítico avanzado. J Immunother 2009; 32: 92-9.
11. Rodríguez G, Albisa A, Viña L, Cuevas A, García B, García AT, et al. Manufacturing process development for an epidermal growth factor based cancer vaccine. Bio-pharm Int, Vaccines Suppl, Oct 2008.
Leave a Reply