Carbono: lo esencial
El carbono es un elemento del Grupo 14 y se distribuye muy ampliamente en la naturaleza. Se encuentra en abundancia en el sol, las estrellas, los cometas y las atmósferas de la mayoría de los planetas. El carbono está presente como dióxido de carbono en la atmósfera y disuelto en todas las aguas naturales. Es un componente de las rocas como carbonatos de calcio (piedra caliza), magnesio y hierro. La atmósfera de Marte es muy delgada, pero lo que hay contiene aproximadamente un 95% de CO2.
El carbón, el petróleo y el gas natural son principalmente hidrocarburos. El carbono es único entre los elementos en la gran variedad de compuestos que puede formar. La química orgánica, un subconjunto 1/112 de la química inorgánica, es el estudio del carbono y sus compuestos. Mientras que el silicio podría tomar el lugar del carbono en la formación de una serie de compuestos relacionados, actualmente no es posible formar compuestos estables con cadenas muy largas de átomos de silicio.
El carbono se encuentra libre en la naturaleza en tres formas alotrópicas: amorfo, grafito y diamante. El grafito es uno de los materiales más suaves conocidos, mientras que el diamante es uno de los más duros. El carbono, como diamantes microscópicos, se encuentra en algunos meteoritos. Los diamantes naturales se encuentran en antiguas «tuberías» volcánicas, como las que se encuentran en Sudáfrica. También se recuperan diamantes del fondo oceánico frente al Cabo de Buena Esperanza.

Un anillo de diamantes.
Más recientemente, se descubrió otra forma de carbono, buckminsterfullerene, C60. Esta forma de carbono es el tema de gran interés en los laboratorios de investigación de hoy en día.
El carbono puro está disponible en varias formas diferentes (alótropos). La forma más común de carbono puro es el α-grafito. Esta es también la forma termodinámicamente más estable. El diamante es una segunda forma de carbono, pero es mucho menos común. Otras formas de carbono incluyen los fullerenos. Mientras que el diamante y el grafito son redes infinitas, los fullerenos como el buckminsterfullereno, C60, es una especie molecular discreta. Las formas amorfas de carbono, como el hollín y el negro de lámpara, son materiales que consisten en partículas muy pequeñas de grafito.
La mayor parte del grafito es α-grafito y posee una estructura de capas en la que cada carbono está directamente unido a otros tres átomos de carbono a una distancia de 141,5 pm. La deslocalización en el enlace es evidente ya que las distancias Cc son iguales y más cortas que los enlaces simples carbono-carbono normales (típicamente 154 pm). La distancia entre las capas de átomos de carbono es de 335,4 pm. En la mayoría de grafito (α-grafito), las capas de átomos están dispuestas en un ABABAB… repita la moda, pero la forma β (romboédrica) el apilamiento es ABCABCABC… aunque las distancias carbono-carbono y el espaciado entre capas intermedias siguen siendo los mismos que en la forma α. La diferencia de entalpía entre α-y α-grafito es inferior a 1 kJ mol-1 (0,59 ± 0,17 kJ mol-1. No se conocen las formas de los elementos más pesados correspondientes al grafito y las estructuras de silicio, germanio y estaño gris están relacionadas con la estructura de diamante (abajo).

Arreglos de átomos en las gotas de carbono más comunes: α-grafito.
Como el diamante tiene una estructura ligeramente más compacta, su densidad es mayor que la del grafito. La apariencia del diamante es bien conocida y también es uno de los materiales más duros conocidos. Al igual que el grafito, es relativamente poco reactivo, pero se quema en el aire a 600-800°C. Cada átomo de carbono está unido a cuatro vecinos a una distancia de 154,45 pm de manera tetraédrica, por lo que cada cristal de diamante es una estructura de celosía gigante única. En principio (y en la práctica! el grafito se puede convertir en diamante mediante la aplicación de calor y presión. La celda unidad de diamante es cúbica con a = 356.68 pm. Casi todos los diamantes poseen esta estructura, pero un porcentaje muy pequeño muestra una estructura hexagonal relacionada con la wurtzita y estos se llaman lonsdaleita.

Estructuras de cristal de diamante.
Recientemente se caracterizó otro alótropo de carbono. Mientras que el diamante y el grafito son redes infinitas, el buckminsterfullereno, C60, es una especie molecular discreta. La molécula de buckminsterfullereno es una red de 12 pentágonos y 20 hexágonos plegados en una esfera. El efecto es muy similar al patchwork de 12 piezas pentagonales y 20 hexagonales de cuero que cosidas juntas forman un balón de fútbol. El nombre buckminsterfullerene (o buckyball) se acuñó debido a la relación entre la estructura del C60 y los diseños de cúpula geodésica de R. Buckminster Fuller. El Buckminsterfullereno está ahora disponible comercialmente y también se ha identificado en el espacio interestelar y el hollín.
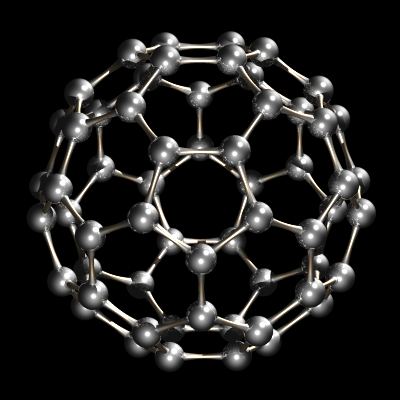
C60, Buckminsterfullerene.
También se conocen otros fullerenos (jaulas de carbono cerradas)como C60 y C84, y están disponibles comercialmente. El fullereno más pequeño posible es el C20 dodecaédrico, que consta de 12 pentágonos y ningún hexágono en absoluto. Los nanotubos están relacionados con los fullerenos. Son tubos que dan la apariencia de grafito laminado, aunque están hechos de grafito. Son de extremo abierto, mientras que los fullerenos son estructuras cerradas.
Una característica interesante de los fullerenos es su capacidad para encerrar átomos como el potasio y otros metales alcalinos para hacer estructuras endoédricas denotadas como K@C60.
En 1961, la Unión Internacional de Química Pura y Aplicada (IUPAC) adoptó el isótopo 12C como base para los pesos atómicos. El carbono-14, 14C, un isótopo con una vida media de 5730 años, se utiliza para fechar materiales como madera, especímenes arqueológicos, etc. El carbono-13, 13C, es particularmente útil para estudios de etiquetado isotópico, ya que no es radiactivo, sino que es un núcleo de espín I = 1/2 y, por lo tanto, un buen núcleo de RMN.
Leave a Reply