Biología para las Especialidades I
Resultados de aprendizaje
- Identificar los componentes de las reacciones químicas simples
Todos los elementos son más estables cuando su capa exterior está llena de electrones de acuerdo con la regla de octetos. Esto se debe a que es energéticamente favorable para los átomos estar en esa configuración y los hace estables. Sin embargo, dado que no todos los elementos tienen suficientes electrones para llenar sus capas más externas, los átomos forman enlaces químicos con otros átomos, obteniendo así los electrones que necesitan para alcanzar una configuración electrónica estable. Cuando dos o más átomos se unen químicamente entre sí, la estructura química resultante es una molécula. La molécula de agua conocida, H2O, consta de dos átomos de hidrógeno y un átomo de oxígeno; estos se unen para formar agua, como se ilustra en la Figura 1. Los átomos pueden formar moléculas donando, aceptando o compartiendo electrones para llenar sus capas externas.
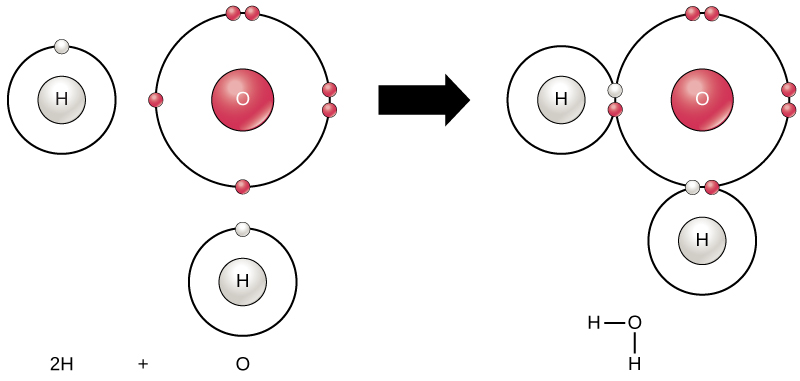
la Figura 1. Dos o más átomos pueden unirse entre sí para formar una molécula. Cuando dos hidrógenos y un oxígeno comparten electrones a través de enlaces covalentes, se forma una molécula de agua.
Las reacciones químicas ocurren cuando dos o más átomos se unen para formar moléculas o cuando los átomos unidos se rompen. Las sustancias utilizadas al principio de una reacción química se denominan reactivos (que se encuentran generalmente en el lado izquierdo de una ecuación química), y las sustancias que se encuentran al final de la reacción se conocen como productos (que se encuentran generalmente en el lado derecho de una ecuación química). Por lo general, se dibuja una flecha entre los reactivos y los productos para indicar la dirección de la reacción química; esta dirección no siempre es una «calle de sentido único».»Para la creación de la molécula de agua mostrada arriba, la ecuación química sería:
2H + O → H2O
Un ejemplo de una reacción química simple es la descomposición de moléculas de peróxido de hidrógeno, cada una de las cuales consta de dos átomos de hidrógeno unidos a dos átomos de oxígeno (H2O2). El peróxido de hidrógeno reactivo se descompone en agua, que contiene un átomo de oxígeno unido a dos átomos de hidrógeno (H2O), y oxígeno, que consiste en dos átomos de oxígeno unidos (O2). En la ecuación siguiente, la reacción incluye dos moléculas de peróxido de hidrógeno y dos moléculas de agua. Este es un ejemplo de una ecuación química equilibrada, en la que el número de átomos de cada elemento es el mismo en cada lado de la ecuación. De acuerdo con la ley de conservación de la materia, el número de átomos antes y después de una reacción química debe ser igual, de modo que, en circunstancias normales, no se creen ni destruyan átomos.
2H2O2 (peróxido de hidrógeno) → 2H2O (agua) + O2 (oxígeno)
Aunque todos los reactivos y productos de esta reacción son moléculas (cada átomo permanece unido al menos a otro átomo), en esta reacción solo el peróxido de hidrógeno y el agua son representativos de una subclase de moléculas conocidas como compuestos: contienen átomos de más de un tipo de elemento. El oxígeno molecular, por otro lado, como se muestra en la Figura 2, consiste en dos átomos de oxígeno doblemente unidos y no se clasifica como un compuesto, sino como un elemento.
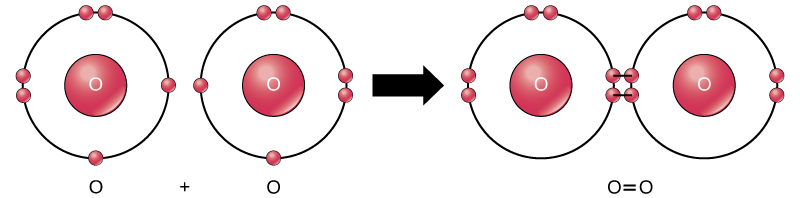
la Figura 2. Los átomos de oxígeno en una molécula de O2 están unidos por un doble enlace.
Algunas reacciones químicas, como la que se muestra arriba, pueden proceder en una dirección hasta que los reactivos se agoten. Las ecuaciones que describen estas reacciones contienen una flecha unidireccional y son irreversibles. Las reacciones reversibles son aquellas que pueden ir en cualquier dirección. En las reacciones reversibles, los reactivos se convierten en productos, pero cuando la concentración del producto supera un determinado umbral (característico de la reacción en particular), algunos de estos productos se convierten de nuevo en reactivos; en este punto, las designaciones de productos y reactivos se invierten. Este ir y venir continúa hasta que se produce un cierto equilibrio relativo entre los reactivos y los productos, un estado llamado equilibrio. Estas situaciones de reacciones reversibles a menudo se denotan por una ecuación química con una flecha de doble cabeza que apunta hacia los reactivos y los productos.
Por ejemplo, en la sangre humana, el exceso de iones de hidrógeno (H+) se une a iones de bicarbonato (HCO3–) formando un estado de equilibrio con ácido carbónico (H2CO3). Si se añadiera ácido carbónico a este sistema, parte de él se convertiría en bicarbonato e iones de hidrógeno.
HCO3 – + H + ↔ H2CO3
En las reacciones biológicas, sin embargo, rara vez se obtiene equilibrio porque las concentraciones de los reactivos o productos o ambos cambian constantemente, a menudo con un producto de una reacción que es un reactivo para otra. Para volver al ejemplo del exceso de iones de hidrógeno en la sangre, la formación de ácido carbónico será la dirección principal de la reacción. Sin embargo, el ácido carbónico también puede salir del cuerpo como gas dióxido de carbono (a través de la exhalación) en lugar de convertirse de nuevo en ion bicarbonato, impulsando así la reacción a la derecha por la ley química conocida como ley de acción de masas. Estas reacciones son importantes para mantener la homeostasis de nuestra sangre.
HCO3– + H+ ↔ H2CO3 ↔ CO2 + H2O
En Resumen: Reacciones químicas y moléculas
La capa exterior de electrones dicta con qué facilidad y qué tipo de enlaces químicos se formará un átomo en particular. La formación de compuestos a menudo se describe visualmente en ecuaciones químicas que muestran los reactivos que participan en las reacciones químicas para formar productos.
Intentarlo
Contribuir!
Mejora esta pagaprender más
Leave a Reply