1.14: Distinguir entre pH y pKa
Acidez relativa y Valores de pKa
Una aplicación de la Ecuación de Henderson-Hasselbach es la capacidad de determinar la acidez relativa de los compuestos comparando sus valores de pKa. Cuanto más fuerte es un ácido, mayor es la ionización, menor es el pKa y menor es el pH que el compuesto producirá en solución. A continuación se muestran algunos valores seleccionados de pKa para compuestos en el estudio de la química orgánica. Dado que las reacciones orgánicas se pueden realizar en ambientes no acuosos, el pH puede exceder de 14 y los compuestos orgánicos pueden tener valores de pKa superiores a 16. Es una variación de esa línea de El Mago de Oz, » Ya no vivimos en el agua.»





Es una muy buena idea memorizar los rangos aproximados de pKa de los compuestos anteriores. Una palabra de precaución: al usar la tabla pKa, asegúrese absolutamente de que está considerando el par conjugado ácido / base correcto. Si se le pide que diga algo sobre la basicidad del amoníaco (NH3) en comparación con la del ion etóxido (CH3CH2O-), por ejemplo, los valores de pKa relevantes a considerar son 9.2 (el pKa del ion amonio) y 16 (el pKa del etanol). A partir de estos números, usted sabe que el etóxido es la base más fuerte. No cometa el error de usar el valor de pKa de 38: este es el pKa de amoníaco que actúa como ácido, y le dice cuán básico es el ion NH2 (¡muy básico!)
* Una nota sobre el pKa de agua: El pKa de agua es 14. Los textos de bioquímica y química orgánica a menudo enumeran el valor como 15.7. Estos textos han factorizado incorrectamente el valor molar de la concentración de agua en la constante de equilibrio. La derivación correcta de la constante de equilibrio implica la actividad del agua, que tiene un valor de 1.
Ejemplo
Mientras que este curso comienza con grupos funcionales individuales, eventualmente trabajaremos con compuestos interesantes que contienen múltiples grupos funcionales. Reconocer qué hidrógenos pueden ionizarse como protones ácidos y cuáles NO, es una habilidad útil. Observe en este ejemplo que necesitamos evaluar la acidez potencial en cuatro lugares diferentes de la molécula.
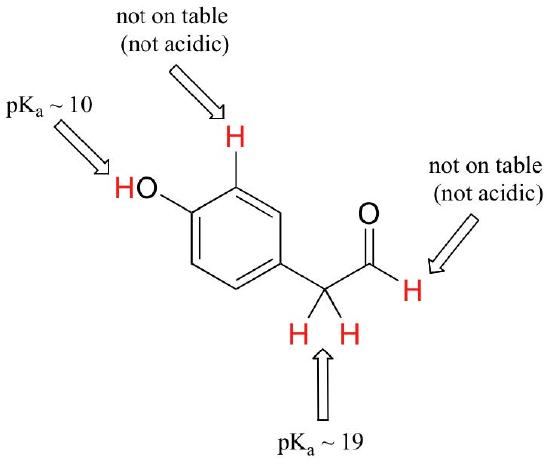
Los aldehídos y los protones aromáticos no son ácidos en absoluto (los pKavalues están por encima de 40, no en nuestra mesa). Los dos protones en el carbono al lado del carbonilo son ligeramente ácidos, con valores de pKa alrededor de 19-20 de acuerdo con la tabla. El protón más ácido está en el grupo fenol, por lo que si el compuesto se sometiera a un equivalente molar único de base fuerte, este es el protón que se donaría.
Acidic & Entornos básicos: Todo es Relativo en Reactividad
Porque nuestro objetivo es comprender la reactividad química dinámica, NO necesitamos conocer la cantidad específica de las formas protonadas y no protonadas de un compuesto. Simplemente necesitamos saber qué forma es la que predomina. Cuando el pH del ambiente es menor que el pKa del compuesto, el ambiente se considera ácido y el compuesto existirá predominantemente en su forma protonada. Cuando el pH del ambiente es mayor que el pKa del compuesto, el ambiente se considera básico y el compuesto existirá predominantemente en su forma desprotonada.
Por ejemplo, el pKa del ácido acético es de aproximadamente 5. A un pH de 1, el ambiente se considera ácido y el ácido acético existe predominantemente en su forma protonada. A pH 8, el ambiente se considera básico, y el ácido acético se desprotona para formar acetato (CH3CO2 -). Por el contrario, el pKa del fenol es 10. A pH 8, el ambiente se considera ácido para el fenol y permanece principalmente protonado.
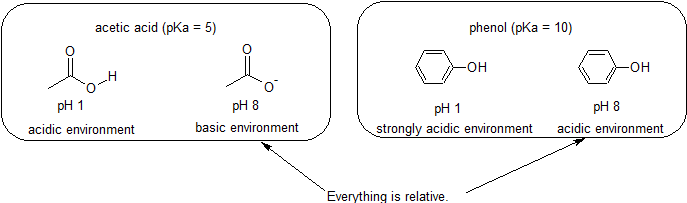
También es importante recordar que la química orgánica NO tiene que ocurrir en el agua, por lo que los valores de pKa pueden ser tan altos como 50.
Ejercicio
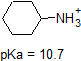
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
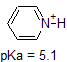 |
|||
 |
|||
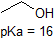 |
|||
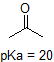 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
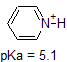 |
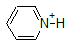 |
 |
 |
 |
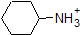 |
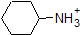 |
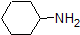 |
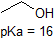 |
 |
 |
 |
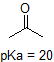 |
 |
 |
 |
Leave a Reply