Ácido oxálico
Meera Senthilingam
Esta semana, nos dirigimos a Francia y descubrimos un compuesto que afectó la salud de un comandante muy conocido
Lars Öhrström
El primero de septiembre de 1870 fue un día sombrío para Charles Louis Napoléon Bonaparte. En Sedán, una pequeña ciudad francesa cerca de la frontera belga, el comandante del ejército francés, Patrice de Mac-Mahon, resultó herido y el emperador enfermo y débil, más conocido como Napoleón III, tuvo que rendirse y entregarse como prisionero al indomable dúo prusiano von Moltke y Bismarck. Así que la guerra de 1870 se perdió y el equilibrio de poder de Europa se inclinó significativamente hacia el este, y todos sabemos cómo terminó.

Fuente: ©
Sedán, Francia
¿Fue todo esto debido a los grandes depósitos cristalinos de oxalato de calcio que se habían formado en los riñones de Napoleón? Probablemente no: parece que la guerra se perdió tan pronto como se declaró debido a la superioridad técnica y organizativa prusiana.
Sin embargo, el Emperador no estaba muy interesado en tomar las armas en primer lugar, con algunos de sus asesores como jefes belicistas. Es difícil saber qué tan bien pudo resistir y contrarrestarlos mientras estaba acosado por la condición muy dolorosa conocida como cálculos renales.
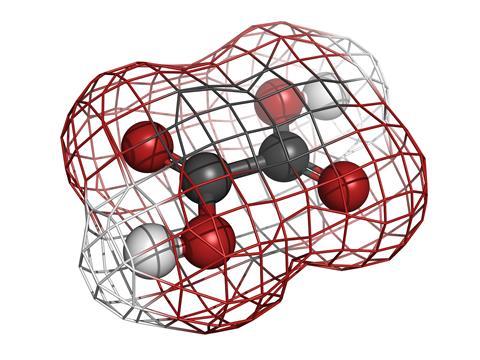
Es más fácil recurrir a los cálculos renales, ya que son susceptibles a métodos detallados de interrogación científica, como la difracción de rayos X. Están formados por dos componentes simples, iones de calcio positivos, Ca2+ e iones de oxalato negativos, dando un compuesto convenientemente conocido simplemente como oxalato de calcio.
El ácido oxálico es el tema de este podcast y los aniones de oxalato son lo que obtienes, junto con los iones H+, cuando disuelves cristales de este ácido fuerte en agua. El ácido oxálico es una molécula pequeña con la fórmula C2O4H2, pero quizás esté mejor representada como HOOC-single-bond-COOH: solo dos grupos de ácido carboxílico unidos para convertirlo en el diácido orgánico más simple. Es posible que conozcas esta sustancia química como el compuesto que hace que el ruibarbo tenga un sabor ácido especial, pero también se encuentra en las espinacas y en varias otras verduras que la mayoría de nosotros comemos felizmente. También es parte de nuestro metabolismo normal y se produce de forma completamente natural en nuestros cuerpos.
Fuente: ©
Lleva el nombre de una planta, la acedera común de madera, una pequeña hierba cuyas hojas tienen un sabor ácido distintivo, revitalizante si te pierdes en el bosque, y que tiene el nombre latino Oxalis acetosella.
La característica más distintiva de esta pequeña molécula es su forma. Se parece un poco a dos Y unidas por la superposición de sus bases. Los átomos de carbono están en las dos intersecciones y los átomos de oxígeno en los cuatro extremos con los protones (o iones H+) colgando uno por uno en cualquiera de estos oxígenos. Además, es completamente plano y cuando ha perdido sus protones para convertirse en el anión oxalato, tiene cargas menos ubicadas en dos de sus átomos de oxígeno.
La mayoría de las aplicaciones técnicas del ácido oxálico dependen de su planitud y carga negativa, al igual que los problemas renales de Napoleón. En el período previo a la batalla de Sedán, von Moltke se había enfrentado con éxito al ejército francés mediante un clásico movimiento de pinzas, atacando desde dos lados en lugar de en el centro. De la misma manera, los iones de oxalato tienen dos pares de electrones en cada uno de los átomos negativos de oxígeno que atacan fácilmente, desde dos lados, cualquier ion metálico que se interponga en su camino. Y al igual que en Sedán, seguirán más iones de oxalato, rodeando el metal con dos, tres o cuatro iones de oxalato, dependiendo de su tamaño.
Este efecto se puede utilizar para eliminar los compuestos de hierro no deseados, especialmente el óxido, de los utensilios de cocina e incluso del mármol. Como carroñeros, el ácido oxálico u oxalatos son componentes en muchas formulaciones de limpieza técnica y todas estas soluciones funcionan en el supuesto de que los compuestos de oxalato metálico formados son solubles en agua y, por lo tanto, se pueden eliminar fácilmente.

Fuente: ©
No tanto de oxalato de calcio. Los iones de calcio positivos realmente aman a los átomos de oxígeno de oxalato más negativos, y hasta tal punto que no les importa si los átomos de oxígeno de oxalato llevan una carga negativa o no. Así que no solo habrá un movimiento de pinza hacia adelante hacia un ion de calcio, sino también hacia atrás, uniéndose a otro en esa dirección. Como cada ion de calcio es bastante grande, cuatro iones de oxalato se ensamblarán alrededor de cada ion metálico (en comparación con tres para el hierro), cada uno se unirá a otros dos iones de calcio en la otra dirección. De esta manera, el oxalato de calcio crecerá en una red infinita que será completamente insoluble en agua. A medida que más y más iones de calcio e iones de oxalato pasan a través del riñón, los cristales crecerán hasta que la afección se vuelva bastante dolorosa.
Pero no se alarme, aparte de en algunas condiciones médicas muy especiales, una ingesta normal, o incluso alta, de iones de calcio y ácido oxálico de fuentes naturales no parece aumentar el riesgo de cálculos renales.
La insolubilidad de los oxalatos también encuentra uso en la tecnología. Los elementos de tierras raras, o lantanoides, son cada vez más importantes en muchas aplicaciones técnicas. A menudo, la primera etapa en su procesamiento y refinación, después de una lixiviación inicial de los minerales, es precipitar estos elementos como sus oxalatos, porque al igual que con el oxalato de calcio, son muy insolubles.
Aparte de su desafortunado encuentro con el oxalato de calcio, Napoleón III es conocido en la historia de la química como el instigador del desarrollo de la margarina y por impulsar un método económico y práctico para fabricar aluminio a escala industrial, en su época el más caro de todos los metales. No vio que se lograra este objetivo posterior, pero es notable que el producto químico que le causó tanto dolor, el ácido oxálico, también se use en la fabricación y coloración de la capa de óxido dura, resistente a la abrasión y a la corrosión, también conocida como revestimiento anodizado, que ahora es tan importante en muchas de nuestras aplicaciones de aluminio.
Meera Senthilingam
Así que la salud y la industria se unieron. Ese fue Lars Öhrström de Chalmers Tekniska Högskola en Suecia, trayéndote la química debilitante de los riñones del ácido oxálico. La próxima semana, Lars regresa con un compuesto totalmente capaz de protegerse a sí mismo.
Lars Öhrström
No está claro cuándo se fabricó el ferroceno por primera vez, pero parece haber sido registrado como un «lodo amarillo» a finales de la década de 1940 por técnicos de procesos que inspeccionaban tuberías en una galleta de carburo de Unión, que se utilizó en la fabricación de ciclopentadieno de hidrocarburo pequeño a partir de diciclopentadieno.
Causó un gran revuelo, ya que antes no se conocía ninguna molécula estable compuesta solo de un hidrocarburo y un metal de transición, y este compuesto se podía mantener en el aire a temperatura ambiente sin encenderse espontáneamente. También sobrevivió al encuentro de asesinos notorios de moléculas organometálicas como el agua, los ácidos o las bases.
Meera Senthilingam
Y descubra la química que lo habilita en la próxima semana Chemistry in its Element. Hasta entonces, gracias por escucharme, soy Meera Senthilingam
Leave a Reply