VSEPR 2
Der folgende Inhalt ist die Substanz der Vorlesung 34 Allgemeine Chemie. In dieser Vorlesung setzen wir die Diskussion von VSEPR mit jenen Atomen fort, die das Oktett überschreiten können.
Wenn sich ein Element in oder jenseits der 3. Periode des Periodensystems befindet, kann es die Oktettregel überschreiten, was bedeutet, dass es mehr als 4 Bindungen zu anderen Atomen eingehen kann. In VSEPR gibt es zwei Strukturen, die wir kennen müssen, die in diese Kategorie fallen: AX5 und AX6.
AX5
Wie bei früheren Modellen beginnen die erweiterten Oktettmodelle mit Bindungen an allen Punkten um das Zentralatom herum:
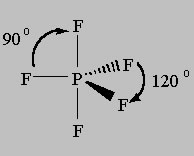
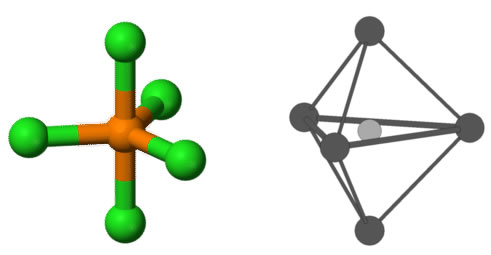
Das EPG und MG für dieses Modell wird als Trigonal Bipyramidal bezeichnet, da die Linie von den axialen (oben-unten) Atomen zu den äquatorialen (um die Mitte) Atomen zwei 3-seitige Pyramiden zeigt:
Wenn wir von hier aus beginnen, Bindungen zu entfernen und sie durch einzelne Paare zu ersetzen, bleibt die EPG mit 5 Bereichen der Elektronendichte konstant, aber die Molekülgeometrie ändert sich. Es wurden Studien durchgeführt, um zu bestimmen, wo das erste Atom entfernt werden würde, und es wurde festgestellt, dass die Struktur energetisch am günstigsten wäre, wenn ein äquatoriales Atom zuerst, zweitens und dann drittens verloren würde.
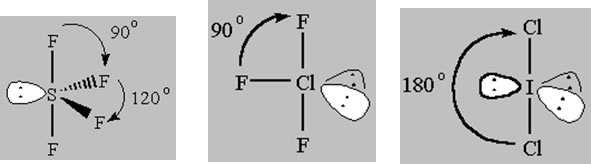
Wippe MG (AX4E), T-förmiges MG (AX3E2)und dann Linear (AX2E3)
AX6
Für das letzte der VSEPR-Modelle, die wir betrachten werden, sind 6 periphere Atome an das Zentralatom gebunden.
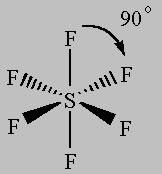
Die Zeichnung der Positionen der Atome in dieser Anordnung sieht ähnlich aus wie das kartesische Koordinatensystem:
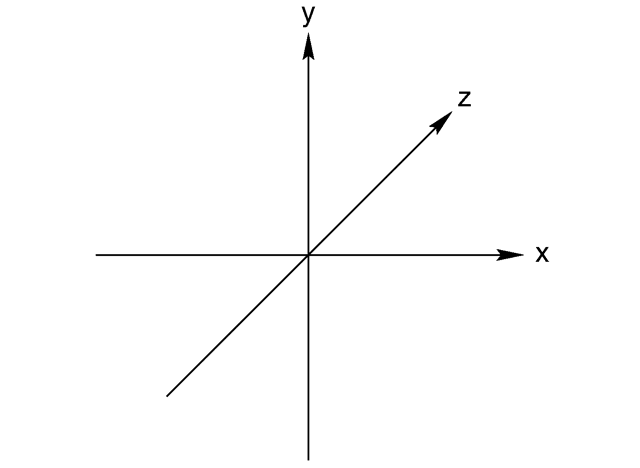
Mit den peripheren Atomen an jedem Achsenende.
Wie bei den Vorgängermodellen werden EPG und MG gleich benannt, wenn alle 6 Atome an das Zentralatom gebunden sind. In diesem Fall wird die Struktur oktaedrisch (8 Seiten) genannt.
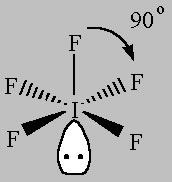
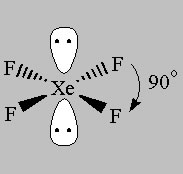
Wenn Sie Atome entfernen und einzelne Paare zurücklassen, erscheinen die folgenden Strukturen:
 |
 |
|
Square Pyramidal (AX5E)
|
Square Planar (AX4E2)
|
Leave a Reply