Servier – Phlebolymphologie
Laden Sie diese Ausgabe herunter Zurück zur Zusammenfassung
Thrombose der unteren Extremitäten:
update und aktuelle
Empfehlungen
Bourgoin-Jallieu, Frankreich
Zusammenfassung
Anfangs wurde die oberflächliche Venenthrombose (SVT) als gutartige Erkrankung oder häufige Komplikation von Krampfadern angesehen. Jüngste Studien haben den potenziellen Schweregrad der SVT gezeigt und ihren Platz innerhalb der venösen thromboembolischen (VTE) Erkrankungen sowie der tiefen Venenthrombose (DVT) und der Lungenembolie (PE) definiert. Eine begleitende TVT wurde bei 25% bis 30% der Patienten bei der Präsentation und eine PE bei 4% bis 7% der Patienten festgestellt. Nachfolgende VTE wurden bei 3 bis 20% der Patienten berichtet, abhängig von der Nachbeobachtungsdauer. Bis vor kurzem wurden zahlreiche gerinnungshemmende Strategien getestet, ohne dass ein klinischer Nutzen eindeutig nachgewiesen werden konnte. Die kürzlich durchgeführte CALISTO-Studie (Vergleich von Arixtra bei oberflächlicher Venenthrombose der unteren Extremitäten mit Placebo) validierte jedoch ein auf Fondaparinux basierendes Antikoagulans-Therapieprotokoll mit 2, 5 mg täglich über 45 Tage, was zu aktualisierten Empfehlungen für die Behandlung von SVT führte. In diesem Artikel wird ein Update zum Management der SVT im Unterschenkelbereich sowie zu den aktuellen Empfehlungen und Richtlinien vorgestellt. Kurz gesagt, alle Patienten mit SVT sollten einen bilateralen Duplex-Scan erhalten, um die Diagnose von SVT zu bestätigen, den genauen Ort und das Ausmaß der SVT zu bestimmen und das Vorhandensein einer TVT zu diagnostizieren oder auszuschließen. Bei Patienten mit symptomatischer SVT von mindestens 5 cm Länge wird empfohlen, 45 Tage lang eine prophylaktische Dosis Fondaparinux oder Heparin mit niedrigem Molekulargewicht ohne Antikoagulation (Grad 2B) zu verschreiben, und wenn die Kosten für die Behandlung mit Fondaparinux akzeptabel sind, wird empfohlen, Fondaparinux 2, 5 mg täglich im Vergleich zu Heparin mit niedrigem Molekulargewicht (Grad 2C) zu verwenden. Die Empfehlungen und Richtlinien haben diesen Behandlungen jedoch einen niedrigen Grad zugewiesen, und es bleiben Fragen zum SVT-Management. Es wurden einige Risikofaktoren für die spätere Entwicklung einer VTE identifiziert, aber es sind weitere Untersuchungen erforderlich, um Untergruppen von Patienten mit einer höheren Inzidenz einer VTE nach einer SVT zu definieren.
Einleitung
Die oberflächliche Venenthrombose (SVT) wurde als gutartige Erkrankung oder häufige Komplikation von Krampfadern angesehen; Neuere Studien haben jedoch ihren potenziellen Schweregrad gezeigt und ihren Platz innerhalb der venösen thromboembolischen (VTE) Erkrankungen sowie der tiefen Venenthrombose (DVT) und der Lungenembolie (PE) definiert.
Antikoagulanzien-Therapie ist heute weit verbreitet anstelle von nichtsteroidalen Antirheumatika (NSAID), die bis zum letzten Jahrzehnt häufig verwendet wurden. Eine aktuelle Studie hat zum ersten Mal ein therapeutisches Protokoll validiert.1 Es bleiben jedoch Fragen zum SVT-Management: (i) Ist eine Antikoagulanzientherapie erforderlich, um alle Patienten mit SVT der unteren Extremitäten zu behandeln? ii) sollten prophylaktische oder therapeutische Dosen angewendet werden?; (iii) was ist die empfohlene Behandlungsdauer?; (iv) sollte die Behandlung für SVT bei Krampfadern und Nicht-Krampfadern gleich sein?; (v) Können die Risikofaktoren für VTE-Komplikationen nach SVT vorhergesagt werden?; und (vi) ist eine Operation zur Behandlung einer akuten SVT noch angezeigt?
In diesem Artikel werden die Gründe für das Update für das Management von SVTs der Beine und die aktuellen Empfehlungen und Richtlinien vorgestellt.
Inzidenz von oberflächlichen Venenthrombosen der unteren Extremitäten
SVT gilt als häufige Erkrankung, aber die tatsächliche Inzidenz in der erwachsenen Bevölkerung bleibt unbekannt. Eine kürzlich in Frankreich durchgeführte Studie2 zeigte, dass die jährliche Diagnoserate 0, 6% betrug. Sie war bei Frauen höher und nahm mit zunehmendem Alter unabhängig vom Geschlecht zu. Überraschenderweise war die jährliche Diagnoserate der SVT niedriger als erwartet und niedriger als die jährliche Diagnoserate der DVT (etwa die Hälfte der DVT). Laut einer anderen französischen Studie, die mit vergleichbaren Methoden durchgeführt wurde, betrug die jährliche Inzidenz einer TVT der unteren Extremitäten 1,24% bzw. 0,6%.3
Oberflächliche Venenthrombose mit begleitender tiefer Venenthrombose bei Präsentation
Die Studien POST (Prospective Observational Superficial Thrombophlebitis) und OPTIMEV (OPTimisation de l’Interrogatoire dans l’évaluation du risque throMbo- Embolique Veineux), zwei große beobachtende und epidemiologische Studien, haben kürzlich wesentliche Daten zur SVT veröffentlicht.4,5 In der POST-Studie wurden insgesamt 844 Patienten mit SVT der Beine analysiert4, und bei 25% der Patienten mit SVT bei der Präsentation wurde eine TVT oder PE identifiziert, und bei 9,7% der Patienten wurde eine proximale TVT diagnostiziert. Wir müssen betonen, dass DVT bei 41,9% der Patienten mit DVT nicht an SVT angrenzte. Insgesamt 788 Patienten mit SVT wurden in die OPTMEV-Studie eingeschrieben,5 in der bei 29% der Patienten eine SVT mit einer TVT assoziiert war, wobei bei 59,5% dieser Patienten eine distale TVT auftrat (128/215; der genaue Ort der TVT fehlte bei 12 Patienten).
Diese Daten bestätigen frühere Studien, die zeigen, dass DVT bei 23% bis 36% der Patienten mit SVT assoziiert war, und zeigen Kohärenz zwischen den verschiedenen Studien (Tabelle I).2,4-10
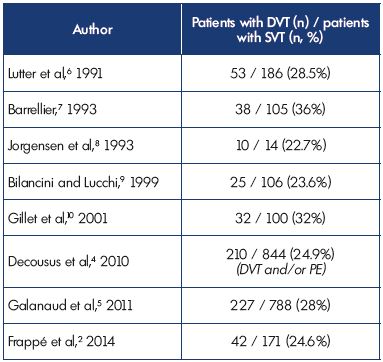
Tabelle I. Oberflächliche Venenthrombose mit begleitender tiefer Vene
Thrombose bei Präsentation.
Abkürzungen: TVT, tiefe Venenthrombose; PE, Lungenembolie; SVT,
oberflächliche Venenthrombose.
Oberflächliche Venenthrombose im Zusammenhang mit Lungenembolie bei Präsentation
Bei Einschluss wurde bei 3,9% und 6% eine symptomatische PE diagnostiziert.9% der Patienten in den POST- und OPTIMEV-Studien. SVT mit PE, aber ohne DVT, machte jedoch nur 2,2% aller SVTs mit DVT oder PE aus. Diese Daten bestätigen die Ergebnisse früherer Studien (Tabelle II).2,4-7,9,10
In der Praxis ist eine Duplex-Scan-Untersuchung bei Patienten mit SVT obligatorisch, um die Diagnose zu bestätigen (Abbildung 1), den genauen Ort und das Ausmaß der SVT zu bestimmen und das Vorhandensein einer TVT zu diagnostizieren oder auszuschließen.
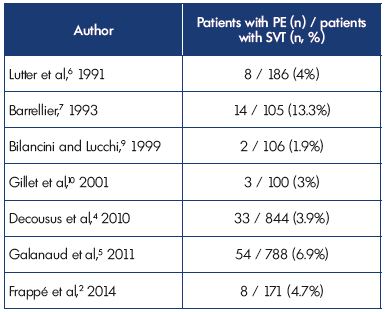
Tabelle II. Oberflächliche Venenthrombose mit begleitender pulmonaler
Embolie bei Präsentation.
Abkürzungen: PE, Lungenembolie; SVT, oberflächliche Venenthrombose.
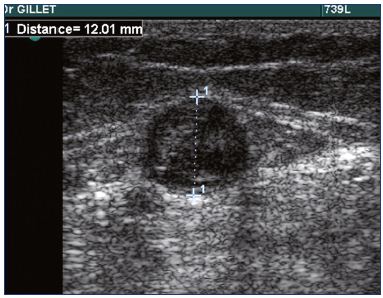
Abbildung 1. Ultraschall der Thrombose der kleinen Vena saphena.

Ergebnis und venöses thromboembolisches Rezidiv
In der Literatur liegt die Rate des thromboembolischen Rezidivs je nach Dauer des Follow-ups zwischen 3% und 20%. In einer persönlichen Studie 13 berichteten wir über das Auftreten symptomatischer VTEs bei 16, 4% der Patienten mit isolierter SVT mit einer durchschnittlichen Nachbeobachtungszeit von 14, 5 Monaten. Die VTE-Ereignisse umfassten TVT (31%), PE (6%), eine weitere SVT in einem anderen Saphena-System (37,5%) und eine wiederkehrende SVT im selben Saphena-System (25%).
In der POST-Studie,4 8.3% der Patienten mit einer isolierten SVT bei Einschluss entwickelten nach 3 Monaten mindestens 1 symptomatisches VTE-Ereignis (symptomatische TVT, 2,8%; symptomatische PE, 0,5%; symptomatische Verlängerung der SVT, 3,3%; und symptomatisches Wiederauftreten der SVT, 1,9%). In der OPTIMEV-Studie entwickelten 5 3% der Patienten mit einer isolierten SVT und 5, 4% der Patienten mit einer mit TVT assoziierten SVT bei Präsentation eine VTE nach 3 Monaten; Die Rate der VTEs betrug 12, 5% bei der 3-Jahres-Nachbeobachtung. In der Studie von Dewar und Panpher 14 trat bei 4% der Patienten mit isolierter SVT nach 6-monatiger Nachbeobachtung eine symptomatische TVT auf.
Diese epidemiologischen Befunde zeigen den potenziellen Schweregrad der SVT. Sie sollten nicht länger als gutartiger Zustand angesehen werden. Folglich ist ihr Platz innerhalb der VTE-Krankheiten jetzt klar definiert.
Risikofaktoren für die Entwicklung eines thromboembolischen Ereignisses
Eine multivariate Analyse der POST-Studie4 identifizierte männliches Geschlecht, Vorgeschichte von TVT oder PE, früheren Krebs und keine Krampfadern als Risikofaktoren für eine symptomatische VTE nach 3 Monaten, einschließlich Wiederauftreten oder Verlängerung der SVT. In der STENOX-Studie (Oberflächliche Thrombophlebitis, die mit ENOXaparin behandelt wurde) wurden 15 Fälle einer VTE (TVT oder PE), männliches Geschlecht und schwere chronische Veneninsuffizienz als unabhängige prädiktive Faktoren für eine VTE nach 3 Monaten identifiziert. Nur eine schwere chronisch venöse Insuffizienz war ein unabhängiger prädiktiver Faktor für TVT oder PE. In einer gepoolten Analyse der POST- und OPTIMEV-Studien zeigten 16 Galanaud et al., dass männliches Geschlecht, Krebs, persönliche Vorgeschichte von VTE und saphenofemorale oder saphenopopliteale Beteiligung das Risiko einer nachfolgenden VTE oder DVT / PE in einer univariaten Analyse signifikant erhöhten. In multivariaten Analysen erhöhte nur männliches Geschlecht signifikant das Risiko eines nachfolgenden VTE- oder DVT / PE-Rezidivs. Für Krebs und eine persönliche Vorgeschichte von VTE lagen die bereinigten Hazard Ratios nur geringfügig unter dem Niveau der statistischen Signifikanz (P = 0,06 für beide), was darauf hindeutet, dass für diese Faktoren der Studie lediglich eine ausreichende statistische Aussagekraft fehlte.
In der STEFLUX-Studie (Superficial Thromboembolism FLUXum) wurden 17 mit einem Body-Mass-Index (BMI) zwischen 25 und 30 kg/m2 und einem Komposit aus einer früheren SVT und / oder VTE und / oder einer VTE in der Familienanamnese als signifikante unabhängige Risikofaktoren für ein VTE-Ereignis identifiziert (Komposit aus symptomatischer und asymptomatischer TVT, PE und SVT-Rezidiv oder -extension).
Venenstatus
Es wurde berichtet, dass der Krampfaderstatus das Risiko einer TVT bei der Präsentation beeinflusst. In den POST4- und OPTIMEV-Studien waren 5 SVTs, die in einer Nicht–Krampfadern (NVV-SVT) auftraten, häufiger mit einer begleitenden TVT oder PE assoziiert als SVTs, die in einer Krampfadern (VV-SVT) auftraten. Ähnliche Ergebnisse wurden von Gorty et al.18
Bei der 3-monatigen Nachbeobachtung in der OPTIMEV-Studie war isolierte NVV-SVT nicht mit einem höheren Risiko für unerwünschte Ergebnisse (dh Tod, VTE-Rezidiv und Blutungen) verbunden. Isolierte NVV-SVT hatte eine höhere Assoziation mit symptomatischer DVT oder PE-Rezidiv (2,7% vs. 0,6%), aber dieses Ergebnis erreichte keine statistische Signifikanz (P = 0,07).
In der POST-Studie wurde das Fehlen von Krampfadern als Risikofaktor für die nachfolgende Entwicklung einer symptomatischen VTE bei Patienten mit einer isolierten symptomatischen SVT bei Präsentation identifiziert (P=0,049). In der STEFLUX-Studie 17 war das Fehlen von Krampfadern ein Risikofaktor für VTE (P = 0,004), nachdem die Behandlung mit niedermolekularem Heparin abgebrochen wurde.
In der Placebogruppe der CALISTO-Studie (Vergleich von Arixtra bei oberflächlicher Venenthrombose der unteren Extremitäten mit Placebo)traten 1 thromboembolische Komplikationen häufiger auf, wenn die SVT die Vena saphena magna (GSV) betraf, bis auf 10 cm des saphenofemoralen Übergangs (SFJ) ausgedehnt wurde, Venen oberhalb des Knies betraf und bei Patienten mit VTE in der Vorgeschichte.
Venöse Stase ist der primäre Mechanismus der SVT bei Patienten mit Krampfadern. Entzündung kann eine wesentliche Rolle bei der Thrombusbildung bei Patienten ohne Krampfadern spielen; dadurch entsteht ein höheres Risiko für eine klinisch schwerwiegendere Thromboembolie. Das Screening auf Thrombophilie wird für die routinemäßige Behandlung von Patienten mit NVV-SVT nicht empfohlen, obwohl Daten aus der Literatur zeigten, dass Thrombophilie in dieser Situation häufig vorkommt. In einer persönlichen prospektiven Studie10 identifizierten wir Thrombophilie bei 50% der Patienten mit NVV-SVT, während nur 15% der Patienten mit VV-SVT Thrombophilie hatten. In einer weiteren prospektiven Studie mit 42 Patienten mit NVV-SVT,19 identifizierten wir Thrombophilie bei 20 (47,6%) Patienten. Die häufigste Thrombophilie war auf die heterozygote Faktor-V-Leiden-Mutation zurückzuführen. In einer Studie mit 63 Patienten mit isolierter NVV-SVT identifizierten 20 Martinelli et al. Thrombophilie bei 30% der Patienten. Ein Screening auf Thrombophilie ist nach Ausschluss eines okkulten Krebses ratsam, insbesondere bei Patienten mit Thrombusprogression trotz geeigneter Antikoagulanzientherapie.11,21
Behandlung der oberflächlichen Venenthrombose
Die Behandlung der SVT war schon immer ein kontroverses Thema. Es werden große Unterschiede in der Behandlung berichtet, insbesondere in Bezug auf die Antikoagulanzientherapie. Die POST-Studie4, die zwischen März 2005 und Oktober 2006 in Frankreich durchgeführt wurde, lieferte interessante Informationen zur SVT-Behandlung. Insgesamt 634 Patienten hatten bei Aufnahme eine isolierte SVT. Informationen über die Behandlung, die sie während des 3-monatigen Beobachtungszeitraums erhielten, lagen für 597 Patienten vor, wobei 90, 5% der Patienten ein oder mehrere Antikoagulanzien erhielten. Von den Patienten, die eine Antikoagulanzientherapie erhielten, erhielten 63% therapeutische Dosen, 36,7% prophylaktische Dosen und 16,8% Vitamin-K-Antagonisten. Die Behandlungsdauer war sehr variabel. Insgesamt 47.2% der Patienten erhielten ein topisches NSAID, 8,2% ein orales NSAID und 10% hatten eine venöse Operation (Stripping oder High-Ligation).
Diese Daten zeigten die Notwendigkeit, die Rolle der Antikoagulanzientherapie im SVT-Management zu klären. Die Anwendung einer Antikoagulanzientherapie bei Patienten mit SVT wurde erstmals 1962 von Zollinger et al.22 berichtet, nachdem das Auftreten einer PE beobachtet worden war, die bei 34 (10,1%) einer Serie von 335 Patienten mit SVT tödlich verlief. Bis vor kurzem, obwohl zahlreiche gerinnungshemmende Strategien getestet worden waren, einschließlich unfraktioniertem Heparin oder niedermolekularem Heparin, bei prophylaktischen oder therapeutischen Dosen für verschiedene Zeiträume, Keine hatte eindeutig einen klinischen Nutzen gezeigt.
Die STENOX-Studie23 war eine randomisierte Doppelblindstudie mit 427 Patienten, in der niedermolekulares Heparin (Enoxaparin in therapeutischen und prophylaktischen Dosen) mit NSAID und Placebo verglichen wurde. Die Patienten wurden 10 Tage lang mit einem 3-monatigen Follow-up behandelt. Nach 10 Tagen gab es mehr VTEs in der Placebogruppe (P24 verglich therapeutische vs. prophylaktische Dosen von Nodraparin bei 163 Patienten mit einer isolierten SVT im GSV, und die Patienten wurden 1 Monat lang behandelt. Im 3-Monats-Follow-up waren die Ergebnisse in beiden Gruppen ähnlich (7, 2% bzw. 8, 6% Auftreten einer VTE; P = 0, 7), was keinen Nutzen der therapeutischen Dosierung zeigte. Während des Follow-ups wurde ein „Catch-up“ – oder Rebound-Phänomen beobachtet, da viele VTEs berichtet wurden, insbesondere in der Gruppe der Patienten, die mit der therapeutischen Dosierung behandelt wurden. Ein „Aufholphänomen“ wurde auch nach Absetzen der Behandlung mit niedermolekularem Heparin nach 1 Monat in der STEFLUX-Studie beobachtet.25 Diese Befunde sprechen wie die der STENOX-Studie für die Wahl prophylaktischer Dosen von niedermolekularem Heparin bei SVT. Das Auftreten der Mehrheit der VTEs während der 2 und 3 Monate nach Absetzen der Behandlung mit niedermolekularem Heparin in der Gruppe, die therapeutische Dosen erhält, unterstreicht erneut die Frage der optimalen Dauer der Antikoagulanzientherapie.
Die randomisierte, doppelblinde CALISTO-Studie1 verglich Fondaparinux 2, 5 mg täglich über 45 Tage mit Placebo bei 3002 Patienten mit einer isolierten symptomatischen SVT der unteren Extremitäten, die mindestens 5 cm lang war. Die Hauptausschlusskriterien waren die Behandlung von Krebs innerhalb der letzten 6 Monate, TVT oder PE innerhalb der letzten 6 Monate, SVT innerhalb von 3 cm vom SFJ und schwere Niereninsuffizienz (Kreatinin-Clearance 26) Die 2, 5-mg-Dosis von Fondaparinux wurde unter der Annahme ausgewählt, dass eine prophylaktische Dosis zur Behandlung von Patienten mit SVT ausreichen würde. Darüber hinaus zeigte sich, dass diese Dosis bei der Vorbeugung von VTEs nach größeren orthopädischen Eingriffen wirksamer ist als eine prophylaktische Dosis von niedermolekularem Heparin und ebenso wirksam wie die therapeutische Dosis von niedermolekularem Heparin bei Patienten mit akuten Koronarsyndromen, was darauf hindeutet, dass 2,5 mg Fondaparinux den Empfehlungen des American College of Chest Physicians (ACCP) von 200827 entsprechen würden, die die Verwendung von prophylaktischen oder mittleren Dosen von niedermolekularem Heparin zur Behandlung von Patienten mit SVT befürworten. Die Dauer von 45 Tagen wurde gewählt, da eine Behandlungsdauer von 30 Tagen oder weniger zu kurz sein könnte, da die meisten symptomatischen VTEs nach Absetzen der Behandlung auftreten. Das primäre Wirksamkeitsergebnis war ein Komposit aus Tod jeglicher Ursache, einer symptomatischen PE, einer symptomatischen TVT, einer symptomatischen Verlängerung des SFJ oder einem symptomatischen Wiederauftreten der SVT am Tag 47. Es gab eine 77-tägige Nachbeobachtungszeit für die Patienten.
Der primäre Wirksamkeitsendpunkt trat bei 0,9% der Patienten in der Fondaparinux-Gruppe und bei 5% der Patienten auf.9% in der Placebogruppe (P28
Es ist interessant, die Änderung der Empfehlungen gegenüber den ACCP-Richtlinien 2008 zu bemerken.27 Wir müssen jedoch berücksichtigen, dass es sich um minderwertige Empfehlungen handelt (Grad 2B oder 2C).
In der Aktualisierung der systematischen Überprüfung der Cochrane-Datenbank zur „Behandlung der oberflächlichen Thrombophlebitis des Beins“kamen 29,30 Di Nisio et al. zu denselben Schlussfolgerungen. Diese Überprüfung basierte auf der Analyse von 30 randomisierten kontrollierten Studien mit 6507 Teilnehmern mit SVT der Beine. Die Autoren schlussfolgern, dass eine prophylaktische Dosis von Fondaparinux, die über 6 Wochen verabreicht wird, eine gültige therapeutische Option für SVT der Beine zu sein scheint. Die Evidenz zu oralen Behandlungen, topischer Behandlung oder Operation ist zu begrenzt und liefert keine Informationen zur Verwendung in der klinischen Praxis über die Auswirkungen dieser Behandlungen auf das Fortschreiten von VTE und SVT.
Operation versus Antikoagulanzientherapie
Eine Überprüfung von Studien, in denen eine Operation mit einer Antikoagulanzientherapie verglichen wurde, zeigt keinen Nutzen für eine chirurgische Behandlung. Die Raten der SVT-Progression waren ähnlich, während die Inzidenz von VTE und Komplikationen bei Operationen höher war.31 Lozano et al. zeigten 4 Wochen lang keinen Unterschied zwischen Operation und Enoxaparin.32
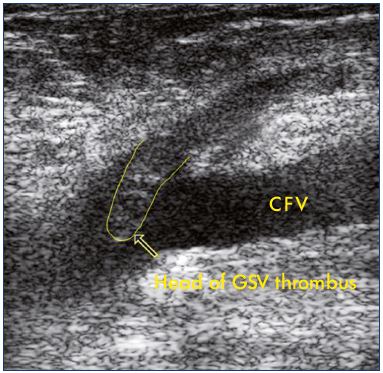
Abbildung 2. Ultraschall einer Verlängerung einer Thrombose der Vena Saphena magna in die Vena femoralis communis.
Abkürzungen: CFV, Vena femoralis communis; GSV, Vena saphena magna
Abbildung 3. Thrombose der saphenofemoralen Verbindung.
Bild mit freundlicher Genehmigung von Dr. Nicolini.

In der Praxis empfehlen die meisten Experten, Patienten mit SVT, die am SFJ oder SPJ verlängert wurden, 3 Monate lang mit einer Antikoagulanzientherapie in therapeutischen Dosen zu behandeln.
Fazit
SVT sollte nicht länger als gutartige Erkrankung angesehen werden. Jüngste epidemiologische Studien, an denen eine große Anzahl von Patienten teilnahm, haben den potenziellen Schweregrad von SVTs gezeigt und ihren Platz innerhalb der VTE-Erkrankungen klar definiert. Eine begleitende TVT wurde bei 25% bis 30% der Patienten bei der Präsentation und eine PE bei 4% bis 7% der Patienten festgestellt. Folglich sollten alle Patienten mit SVT bilaterale Duplex-Scans durchführen lassen, um die Diagnose von SVT zu bestätigen, den genauen Ort und das Ausmaß der SVT zu bestimmen und das Vorhandensein einer TVT zu diagnostizieren oder auszuschließen. Heute hat sich das SVT-Management geändert, wobei die Antikoagulanzientherapie anstelle von NSAIDs weit verbreitet ist. Bis zur jüngsten CALISTO-Studie hatte kein Antikoagulans-Protokoll einen klaren klinischen Nutzen gezeigt. Die Empfehlungen wurden aktualisiert, nachdem die CALISTO-Studie das Antikoagulans-Therapieprotokoll validiert hatte, das auf Fondaparinux 2, 5 mg täglich über einen Zeitraum von 45 Tagen beruhte. Bei Patienten mit einer symptomatischen SVT der Beine von mindestens 5 cm Länge wird eine prophylaktische Dosis Fondaparinux oder niedermolekulares Heparin über 45 Tage ohne Antikoagulation empfohlen (Grad 2B). Wenn die Kosten für die Behandlung mit Fondaparinux akzeptabel sind, wird die Anwendung von Fondaparinux 2,5 mg täglich über eine prophylaktische Dosis von niedermolekularem Heparin empfohlen (Grad 2C). Die Empfehlungen und Leitlinien sind jedoch von geringer Qualität, und es bleiben Fragen zum SVT-Management. Einige Risikofaktoren für die spätere Entwicklung einer VTE wurden identifiziert, aber es sind weitere Untersuchungen erforderlich, um Untergruppen von Patienten mit einer höheren Inzidenz von VTE nach SVT klar zu definieren.
1. D ecousus H, Prandoni P, Mismetti P, et al; CALISTO-Studiengruppe. Fondaparinux zur Behandlung von oberflächlichen Venenthrombosen in den Beinen. In: N Engl J Med. 2010;363:1222-1232.
2. Frappé P, Buchmüller-Cordier A, Bertoletti L, et al; STEPH-Studiengruppe. Jährliche Diagnoserate der oberflächlichen Venenthrombose der unteren Extremitäten: die STEPH Community-basierte Studie. J Thromb Haemost. 2014;12:831-838.
3. In: EPI-GETBO Study Group. Inzidenz venöser Thromboembolien: eine gemeindebasierte Studie in Westfrankreich. Thromb Hämost. 2000;83:657- 660.
4. D ecousus H, Quéré I, Presles E, et al; POST-Studiengruppe. Oberflächliche Venenthrombose und venöse Thromboembolie: eine große, prospektive epidemiologische Studie. In: Ann Intern Med. 2010;152:218-224.
5. G alanaud JP, Genty C, Sevestre MA, et al; OPTIMEV SFMV Ermittler. Prädiktive Faktoren für gleichzeitige Deepvein-Thrombose und symptomatisches venöses thromboembolisches Wiederauftreten bei oberflächlicher Venenthrombose. Thromb Hämost. 2011;105:31-39.
6. Lutter KS, Kerr TM, Roedersheimer R, Lohr JM, Sampson MG, Cranley JJ. Oberflächliche Thrombophlebitis durch Duplex-Scanning diagnostiziert. Chirurgie. 1991;100:42-46.
7. Barrellier MT. Thrombosis veineuses superficielles des membres inférieurs . Aktuelle Vasc Int. 1993;17:7-9.
8. Jorgensen JO, Hanel KC, Mogan AM, Jagd JM. Die Inzidenz von tiefen Venenthrombosen bei Patienten mit oberflächlicher Thrombophlebitis der unteren Extremitäten. J Vasc Surg. 1993;18:70-73.
9. Bilancini S, Lucchi M. Les thrombosis veineuses superficielles sont-elles polymorphes ? Phlébologie. 1999;52:41-43.
10. G illet JL, Perrin M, Cayman R. Oberflächliche Venenthrombose der unteren Extremitäten: prospektive Analyse bei 100 Patienten . J Mal Vasc. 2001;26:16-22.
11. Kalodiki E, Stvrtinova V, Allegra C, et al. Oberflächliche Venenthrombose: eine Konsenserklärung. Int Angiol. 2012;31:203-216.
12. Nicolaides A. Oberflächliche Venenthrombose bei der Prävention und Behandlung von venösen Thromboembolien. Int Angiol. 2013;32:237-242.
13. G illet JL, Perrin M, Cayman R. Thromboembolisches Rezidiv nach oberflächlicher Thrombophlebitis der unteren Extremitäten. In: J Phlebology. 2002;2:103-118.
14. D ewar C, Panpher S. Inzidenz von tiefen Venenthrombosen bei Patienten mit oberflächlicher Thrombophlebitis diagnostiziert, nachdem zu einer Notaufnahme ambulante tiefe Venenthrombose Service präsentiert. Emerg Med J. 2010;27:758-761.
15. Quenet S, Laporte S, Décousus H, Leizorovicz A, Epinat M, Mismetti P; STENOX-Gruppe. Faktoren, die venöse thrombotische Komplikationen bei Patienten mit isolierter oberflächlicher Venenthrombose vorhersagen. J Vasc Surg. 2003;38:944- 949.
16. G alanaud JP, Bosson JL, Genty C, et al. Oberflächliche Venenthrombose und rezidivierende venöse Thromboembolie: eine gepoolte Analyse von zwei Beobachtungsstudien. J Thromb Haemost. 2012;10:1004-1011.
17. Cosmi B, Filippini M, Campana F, et al; STEFLUX Ermittler. Risikofaktoren für wiederkehrende Ereignisse bei Patienten mit oberflächlicher Venenthrombose in der randomisierten klinischen Studie SteFlux (Oberflächliche Thromboembolie Fluxum). Thromb Res. 2014;133:196-202.
18. G orty S, Patton-Adkins J, DaLanno M, Starr J, Dean S, Satiani B. Oberflächliche Venenthrombose der unteren Extremitäten: Analyse von Risikofaktoren und Wiederauftreten und Rolle der Antikoagulation. In: Vasc Med. 2004;9:1-6.
19. G illet JL, Allaert FA, Perrin M. Oberflächliche Thrombophlebitis bei Nicht-Krampfadern der unteren Extremitäten. Eine prospektive Analyse bei 42 Patienten . J Mal Vasc. 2004;29:263-272.
20. Martinelli I., Cattaneo M., Taioli E., de Stefano V., Chiusolo P., Mannucci P.M. Genetische Risikofaktoren für oberflächliche Venenthrombose. Thromb Hämost. 1999;82:1215-1217.
21. Milio G, Siragusa S, Malato A, Grimaudo S, Pinto A. Oberflächliche Venenthrombose: Rolle des vererbten Mangels an natürlichen Antikoagulanzien bei der Ausdehnung auf tiefe Venen. Int Angiol. 2009;28:298- 302.
22. Zollinger RW, Williams RD, Briggs DO. Probleme bei der Diagnose und Behandlung von Thrombophlebitis. Arch Surg. 1962;85:34-40.
23. D ecousus H; Enoxaparin-Studiengruppe. Ein randomisierter Doppelblind-Pilotvergleich eines niedermolekularen Heparins, eines nichtsteroidalen entzündungshemmenden Mittels, und eines Placebos bei der Behandlung oberflächlicher Venenthrombosen. Arch Int Med. 2003;163:1657-1663.
24. Prandoni P, Tormene D, Pesavento R; Vesalio Investigators Gruppe. Hohe vs. niedrige Dosen von niedermolekularem Heparin zur Behandlung der oberflächlichen Venenthrombose der Beine: eine doppelblinde, randomisierte Studie. J Thromb Haemost. 2005;3:1152-1157.
25. Weitere Informationen zu: Cosmi B, Filippini M, Tonti D, Avruscio G, Ghirarduzzi A, Bucherini E. Eine randomisierte doppelblinde Studie mit niedermolekularem Heparin (Parnaparin) bei oberflächlicher Venenthrombose: STEFLUX (Oberflächliche Thromboembolie und Fluxum). J Thromb Haemost. 2012;10:1026-1035.
26. D ecousus H, Frappé P, Accassat S, et al. Epidemiologie, Diagnose, Behandlung und Management von oberflächlichen Venenthrombosen der Beine. Beste Pract Res Clin Haematol. 2012;25:275-284.
27. Kearon C, Kahn SR, Agnelli G, Goldhaber S, Raskob GE, Comerota AJ; Amerikanisches College für Brustärzte. Antithrombotische Therapie bei venösen thromboembolischen Erkrankungen: Evidenzbasierte Richtlinien für die klinische Praxis des American College of Chest Physicians (8. Auflage). Brust. 2008;133(suppl 6):454S-545S.
28. Kearon C, Akl EA, Comerota AJ, et al; Amerikanisches College für Brustärzte. Antithrombotische Therapie bei VTE-Erkrankungen: Antithrombotische Therapie und Prävention von Thrombosen, 9. Aufl.: American College of Chest Physicians Evidenzbasierte Richtlinien für die klinische Praxis. Brust. 2012;141(Ergänzung 2):e419S-e494S.
29. D i Nisio M, Wichers IM, Middeldorp S. Behandlung der oberflächlichen Thrombophlebitis des Beines. Cochrane Database Syst Rev. 2013;30;4:CD004982.
30. D i Nisio M, Middeldorp S. Behandlung der oberflächlichen Thrombophlebitis der unteren Extremitäten. JAMA. 2014;311:729- 730.
31. Sullivan V, Denk PM, Sonnad SS, Eagleton MJ, Wakefield TW. Ligation versus Antikoagulation: behandlung der oberflächlichen Thrombophlebitis oberhalb des Knies, an der das tiefe Venensystem nicht beteiligt ist. J Am Coll Surg. 2001;193:556-562.
32. Lozano FS, Almazan A. Heparin mit niedrigem Molekulargewicht im Vergleich zur saphenofemoralen Trennung zur Behandlung der größeren Saphena-Thrombophlebitis oberhalb des Knies: eine prospektive Studie. Vasc Endovaskuläre Chirurgie 2003;37: 415- 420.
33. Chengelis DL, Bendick PJ, Glover JL, Braun OW, Ranval TJ. Progression der oberflächlichen Venenthrombose zu tiefer Venenthrombose. J Vasc Surg. 1996;24:745-749.
34. Hingorani A, Ascher E. Oberflächliche venöse Thrombophlebitis. In: Gloviczki P, Hrsg. Handbuch der venösen Erkrankungen. Richtlinien des American Venous Forum. 3. Aufl. London, Vereinigtes Königreich: Hodder Arnold; 2009: 314-319.
Leave a Reply