NOAA Global Monitoring Laboratory – Halocarbons and other Atmospheric Trace Species
Chlorofluorocarbons (CFCs)
(published in The Chapman & Hall Encyclopedia of Environmental Science, edited by David E. Alexander and Rhodes W. Fairbridge, pp pp.78-80, Kluwer Academic, Boston, MA, 1999.)
Chlorofluorocarbons (CFCs) are nontoxic, nonflammable chemicals containing atoms of carbon, chlorine, and fluorine. Sie werden bei der Herstellung von Aerosolsprays, Treibmitteln für Schäume und Verpackungsmaterialien, als Lösungsmittel und als Kältemittel verwendet. FCKW werden als Halogenkohlenwasserstoffe klassifiziert, eine Klasse von Verbindungen, die Atome von Kohlenstoff- und Halogenatomen enthalten. Einzelne FCKW-Moleküle sind mit einem eindeutigen Nummerierungssystem gekennzeichnet. Zum Beispiel gibt die FCKW-Zahl von 11 die Anzahl der Atome von Kohlenstoff, Wasserstoff, Fluor und Chlor an (z. B. CCl3F als FCKW-11). Der beste Weg, sich an das System zu erinnern, ist die „Regel von 90“ oder addieren Sie 90 zur FCKW-Nummer, wobei die erste Ziffer die Anzahl der Kohlenstoffatome (C), die zweite Ziffer die Anzahl der Wasserstoffatome (H) und die dritte Ziffer ist Anzahl der Fluoratome (F). Die Gesamtzahl der Chloratome (Cl) wird durch den Ausdruck berechnet: Cl = 2(C + 1) – H – F. Im Beispiel hat FCKW-11 einen Kohlenstoff, keinen Wasserstoff, ein Fluor und daher 3 Chloratome. Kühlschränke in den späten 1800er und frühen 1900er Jahren verwendeten die giftigen Gase Ammoniak (NH3), Methylchlorid (CH3Cl) und Schwefeldioxid (SO2) als Kältemittel. Nach einer Reihe tödlicher Unfälle in den 1920er Jahren, als Methylchlorid aus Kühlschränken austrat, begann die Suche nach einem weniger toxischen Ersatz als Zusammenarbeit von drei amerikanischen Unternehmen – Frigidaire, General Motors und Du Pont. FCKW wurden erstmals 1928 von Thomas Midgley Jr. von General Motors als sicherere Chemikalien für Kühlschränke in großen kommerziellen Anwendungen synthetisiert1. Frigidaire erhielt am 31. Dezember 1928 das erste Patent mit der Nummer 1.886.339 für die Formel für FCKW. 1930 gründeten General Motors und Du Pont die Kinetic Chemical Company, um Freon (ein Handelsname von Du Pont für FCKW) in großen Mengen herzustellen. Bis 1935 hatten Frigidaire und seine Konkurrenten in den USA 8 Millionen neue Kühlschränke verkauft, die Freon-12 (FCKW-12) der Kinetic Chemical Company und der Unternehmen, die für die Herstellung dieser Verbindung lizenziert waren, verwendeten. Im Jahr 1932 verwendete die Carrier Engineering Corporation Freon-11 (FCKW-11) in der weltweit ersten in sich geschlossenen Hausklimaanlage, dem „Atmospheric Cabinet“.; Aufgrund der FCKW-Sicherheitsbilanz für die Ungiftigkeit wurde Freon zum bevorzugten Kühlmittel in großen Klimaanlagen. In vielen amerikanischen Städten wurden die Gesundheitsvorschriften überarbeitet, um Freon als einziges Kühlmittel zu bezeichnen, das in öffentlichen Gebäuden verwendet werden kann. Nach dem Zweiten Weltkrieg wurden FCKW als Treibmittel für Insektensprays, Farben, Haarspülungen und andere Gesundheitsprodukte verwendet. In den späten 1950er und frühen 1960er Jahren ermöglichten die FCKW eine kostengünstige Lösung für den Wunsch nach Klimaanlagen in vielen Automobilen, Häusern und Bürogebäuden. Später nahm das Wachstum des FCKW-Einsatzes weltweit mit Spitzenwerten, einem Jahresumsatz von etwa einer Milliarde Dollar (USA) und mehr als einer Million Tonnen produzierten FCKW zu.
Während FCKW in den meisten Anwendungen sicher zu verwenden sind und in der unteren Atmosphäre inert sind, reagieren sie in der oberen Atmosphäre oder Stratosphäre signifikant. Im Jahr 1974 wurden zwei Chemiker der University of California, Professor F. Sherwood Rowland und Dr. Mario Molina, zeigte, dass die FCKW nach ihrer photolytischen Zersetzung durch UV-Strahlung eine Hauptquelle für anorganisches Chlor in der Stratosphäre sein könnten. Darüber hinaus würde ein Teil des freigesetzten Chlors aktiv Ozon in der Stratosphäre2 zerstören. Ozon ist ein Spurengas, das sich hauptsächlich in der Stratosphäre befindet (siehe Ozon). Ozon absorbiert schädliche ultraviolette Strahlung in den Wellenlängen zwischen 280 und 320 nm des UV-B-Bandes, die bei Pflanzen und Tieren biologische Schäden verursachen kann. Ein Verlust von stratosphärischem Ozon führt dazu, dass schädlichere UV-B-Strahlung die Erdoberfläche erreicht. Aus FCKW freigesetztes Chlor zerstört Ozon in katalytischen Reaktionen, bei denen 100.000 Ozonmoleküle pro Chloratom zerstört werden können.
Eine große Frühjahrsverarmung des stratosphärischen Ozons wurde jedes folgende Jahr schlimmer. Dieser Ozonverlust wurde 1985 vom britischen Forscher Joe Farman und seinen Kollegen beschrieben3. Es wurde von anderen als ìthe Antarctic ozone holeî bezeichnet. Das Ozonloch war anders als der Ozonverlust in den mittleren Breiten. Der Verlust war in der Antarktis aufgrund vieler Faktoren größer als in den mittleren Breiten: die ungewöhnlich kalten Temperaturen der Region, die dynamische Isolierung dieses ìholeî und die synergistischen Reaktionen von Chlor und Brom4. Der Ozonverlust wird auch in Polarregionen durch Reaktionen mit polaren stratosphärischen Wolken (PSCs)5 und in mittleren Breiten nach Vulkanausbrüchen verstärkt. Die Notwendigkeit, die FCKW zu kontrollieren, wurde dringend.
1987 unterzeichneten 27 Nationen einen globalen Umweltvertrag, das Montrealer Protokoll zur Reduzierung von Substanzen, die die Ozonschicht abbauen6, der vorsah, das Produktionsniveau dieser Verbindungen von 1986 vor dem Jahr 2000 um 50% zu senken. Dieses internationale Abkommen enthielt Beschränkungen für die Produktion von FCKW-11, -12, -113, -114, -115, und die Halone (Chemikalien, die als Feuerlöschmittel verwendet werden). Ein 1990 in London angenommener Änderungsantrag war energischer und forderte die Abschaffung der Produktion bis zum Jahr 2000. Die chlorierten Lösungsmittel, Methylchloroform (CH3CCl3) und Tetrachlorkohlenstoff (CCl4) wurden der London-Lösung zugesetzt.
Große Mengen reaktiven stratosphärischen Chlors in Form von Chlormonoxid (ClO), die nur durch die Zerstörung von Ozon durch die FCKW in der Stratosphäre entstehen konnten, wurden im Winter 1992 von Instrumenten an Bord des NASA-Flugzeugs ER-2 und des UARS (Upper Atmospheric Research Satellite) über einigen Regionen Nordamerikas beobachtet7,8. Die Umweltbedenken für FCKW ergeben sich aus ihrer langen atmosphärischen Lebensdauer (55 Jahre für FCKW-11 und 140 Jahre für FCKW-12, CCl2F2)9, was unsere Fähigkeit einschränkt, ihre Häufigkeit in der Atmosphäre und den damit verbundenen zukünftigen Ozonverlust zu reduzieren. Dies führte zu der Kopenhagener Änderung, die die Produktion weiter einschränkte und später im Jahr 1992 genehmigt wurde. Die Herstellung dieser Chemikalien endete größtenteils am 1. Januar 1996. Die einzigen genehmigten Ausnahmen betrafen die Produktion in Entwicklungsländern und einige freigestellte Anwendungen in der Medizin (z. B. Asthma-Inhalatoren) und in der Forschung. Das Montrealer Protokoll enthielt Durchsetzungsbestimmungen durch Anwendung von Wirtschafts- und Handelssanktionen, falls ein Unterzeichnerland diese verbotenen Chemikalien handelt oder herstellt. Insgesamt haben 148 Unterzeichnerstaaten das Montrealer Protokoll unterzeichnet. Atmosphärische Messungen von FCKW-11 und FCKW-12, die 1993 gemeldet wurden, zeigten, dass ihre Wachstumsraten sowohl aufgrund freiwilliger als auch aufgrund vorgeschriebener Emissionsminderungen zurückgingen9. Viele FCKW und ausgewählte chlorierte Lösungsmittel haben sich bis 1994 entweder eingependelt (Abbildung 1) oder ihre Konzentration erniedrigt9,10.
Die Nachfrage nach FCKW wurde durch Recycling und Wiederverwendung vorhandener FCKW-Bestände sowie durch den Einsatz von Ersatzstoffen gedeckt. Einige Anwendungen, z. B. Entfetten von Metallen und Reinigen von Lösungsmitteln für Leiterplatten, bei denen früher FCKW verwendet wurden, verwenden heute halogenkohlenwasserstofffreie Flüssigkeiten, Wasser (manchmal als Dampf) und verdünnte Zitronensäuren. Die Industrie entwickelte zwei Klassen von Halogenkohlenwasserstoffersatzstoffen – die teilhalogenierten Fluorchlorkohlenwasserstoffe (H-FCKW) und die teilhalogenierten Kohlenwasserstoffe (H-FCKW). Die HFCKW enthalten neben Chlor-, Fluor- und Kohlenstoffatomen auch Wasserstoffatome. Der Vorteil der Verwendung von H-FCKW besteht darin, dass der Wasserstoff mit troposphärischem Hydroxyl (OH) reagiert, was zu einer kürzeren Lebensdauer in der Atmosphäre führt. H-FCKW-22 (CHClF2) hat eine atmosphärische Lebensdauer von etwa 13 Jahren11 und wird seit 1975 in bedarfsarmen Klimaanlagen und einigen Kühlanwendungen eingesetzt. H-FCKW enthalten jedoch immer noch Chlor, wodurch sie Ozon zerstören können. Der Kopenhagener Änderungsantrag fordert, dass ihre Produktion bis zum Jahr 2030 eingestellt wird. Die HFKW gelten aufgrund ihrer kurzen Lebensdauer und ihres Chlormangels als einer der besten Ersatzstoffe zur Reduzierung des stratosphärischen Ozonverlusts. In den Vereinigten Staaten wird HFC-134a in allen neuen inländischen Automobilklimaanlagen verwendet. Zum Beispiel wächst HFC-134a 1995 schnell mit einer Wachstumsrate von ungefähr 100% pro Jahr mit einer atmosphärischen Lebenszeit von ungefähr 12 years12. (Die „Regel von 90“ gilt auch für die chemische Formel von H-FCKW und H-FCKW. Die Verwendung der FCKW, einiger chlorierter Lösungsmittel und Halone sollte in den nächsten zehn Jahren obsolet werden, wenn das Montrealer Protokoll von allen Parteien eingehalten wird und Ersatzstoffe verwendet werden. Die Wissenschaft, die zur Grundlage des Montrealer Protokolls wurde, führte 1995 zum Nobelpreis für Chemie. Der Preis wurde gemeinsam an die Professoren F. S. Rowland an der University of California at Irvine, M. Molina am Massachusetts Institute of Technology, Cambridge, und Paul Crutzen am Max-Planck-Institut für Chemie in Mainz, Deutschland, für ihre Arbeiten zur Atmosphärenchemie, insbesondere zur Bildung und Zersetzung von Ozon (insbesondere durch FCKW und Stickoxide).
1Midgley, T. und Henne, A., Organische Fluoride als Kältemittel, Industrielle und technische Chemie, 22, 542-547, 1930.
2Molina, M.J. und F.S. Rowland, Stratosphärische Senke für Fluorchlormethane: Chloratom katalysierte Zerstörung von Ozon, Nature, 249, 810-814, 1974.
3Farman, J.C., B.G. Gardiner und J.D. Shanklin, Große Verluste an Gesamtozon in der Antarktis zeigen saisonale ClOx / NOx-Wechselwirkung, Nature, 315,207-210, 1985.
4McElroy, MB, RJ Salawitch, SC Wofsy und JA Logan, Reduktionen des antarktischen Ozons durch synergistische Wechselwirkungen von Chlor und Brom, Nature, 321, 759-762, 1986.
5Solomon, S., R.R. Garcia, F.S. Rowland und D.J. Wuebbles, Über die Erschöpfung des antarktischen Ozons, Nature, 321, 755-758, 1986.
6montreales Protokoll über Stoffe, die die Ozonschicht abbauen, 15 Seiten, Umweltprogramm der Vereinten Nationen (UNEP), New York, 1987.
7Toohey, D.W., L.M. Avallone, L.R. Lait, P.A. Newman, M.R. Schoeberl, D.W. Fahey, E.L. Woodbridge und J.G. Anderson, Die saisonale Entwicklung von reaktivem Chlor in der Stratosphäre der nördlichen Hemisphäre, Wissenschaft, 261, 1134-1136, 1993.
8Waters, J., L. Froidevaux, W. Lesen, G. Manney, L. .Elson, D. Blume, R. Jarnot, und R. Harwood, Stratosphärische ClO Andozone aus dem Mikrowellen-Echolot auf dem Upper Atmosphere Research Satellite, Nature, 362, 597-602, 1993.
9Elkins, J.W., T.M. Thompson, T.H. Swanson, J.H. Butler, B.D. Hall, S.O. Cummings, D.A. Fisher und A.G. Raffo, Abnahme der Wachstumsraten atmosphärischer Fluorchlorkohlenwasserstoffe 11 und 12, Nature, 364, 780-783, 1993.
10Prinn, R.G., R.F. Weiss, B.R. Miller, J. Huang, F.N. Alyea, D.M. Cunnold, P.J. Fraser, D.E. Hartley und P.G. Simmonds, Atmosphärische Trends und Lebensdauern von CH3CCl3 und globalen OH-Konzentrationen, Science, 269, 187-192, 1995.
11Montzka, S.A., R.C. Myers, J.H. Butler, S.C. Cummings und J.W. Elkins, Globale troposphärische Verteilung und Kalibrierungsskala von HCFC-22, Geophysical Research Letters, 20 (8), 703-706, 1993.
12Montzka, S.A., R.C. Myers, J.H. Butler, J.W. Elkins, L.T. Lock, A.D. Clarke und A.H. Goldstein, Beobachtungen von HFC-134a in der entfernten Troposphäre, Geophysical Research Letters, 23, 169-172, 1996.
Vorgeschlagene zusätzliche Lektüre:
Cagin, S. und P. Dray, Zwischen Erde und Himmel: Wie FCKW unsere Welt veränderten und die Ozonschicht bedrohten, 512 pp., Pantheon Press, New York, 1993. Scientific Assessment of Ozone Depletion: 1994, herausgegeben von D. L. Albritton, R. T. Watson und R. J. Aucamp, 37, 451 pp., Weltorganisation für Meteorologie (WMO), Genf, 1995.
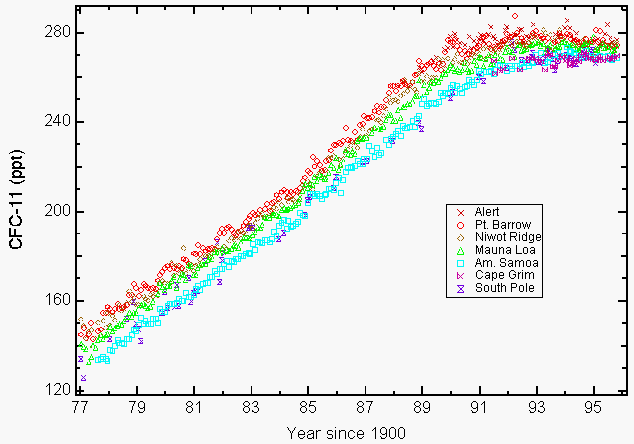
Abbildung 1: Die Anreicherung von Fluorchlorkohlenwasserstoff-11 (FCKW-11) in der Atmosphäre nimmt infolge freiwilliger und vorgeschriebener Emissionsreduktionen ab. Monatliche Mittelwerte, die als Trockenmischungsverhältnisse in Teilen pro Billion (ppt) für FCKW-11 in Bodennähe für vier NOAA / CMDL-Stationen (Pt. Weitere Wetterinfos für Barrow, Alaska; Cape Matatula, Amerikanisch-Samoa; und Südpol) und drei kooperative Stationen (Alert, Northwest Territories, Kanada (Atmospheric Environment Service); Niwot Ridge, Colorado (Universität von Colorado); Cape Grim Baseline Air Pollution Station, Tasmanien, Australien, (Commonwealth Scientific and Industrial Research Organization)9. (Mit freundlicher Genehmigung von NOAA / CMDL)
Leave a Reply