Natriumhydroxid
Natriumhydroxid Chemische Eigenschaften, Verwendung, Herstellung
Chemische Eigenschaften
Natriumhydroxid ist ein weißes, geruchloses, nichtflüchtiges alkalisches Material, das in fester Form als Pellets, Flocken, Klumpen oder Stäbchen vermarktet wird. Seine Löslichkeit in Wasser beträgt 111 Gew.-% und ein Dampfdruck von 0 mmHg (NIOSH, 1994).
Es kann mit Tricholethylen (TCE) zu brennbarem Dichloracetylen und mit Metallen zu Wasserstoffgas reagieren (OEHHA, 1993). Seine Reaktivität mit Metallen sollte in Bezug auf Lagereinheiten und Behälter berücksichtigt werden.
Natriumhydroxid ist üblicherweise als wässrige Lösung erhältlich, die als Natronlauge, Natronlauge oder einfach als Lauge bekannt ist. Es hat verschiedene Verwendungen, einschließlich Neutralisation von Säure; die Herstellung von Papier, Textilien, Kunststoffen, Ätzmitteln, Farbstoffen, Farben, Farbentfernern und Seife; Raffination von Erdöl; Galvanisieren; Metallreinigung; Waschen; und Geschirrspülen. Eine aufkeimende Verwendung hat in der illegalen Herstellung von Methamphetamin gewesen.
Verwendung
Natriumhydroxid (NaOH) ist eine der nützlichsten industriellen Natriumverbindungen. Es ist auch als Lauge oder Natronlauge bekannt und gehört zu den stärksten basischen Alkalien (hoher pH-Wert) auf dem Haushaltsmarkt. Es wird als Abfluss- und Ofenreiniger verwendet und verseift Fette in derherstellung von Seife. Es muss mit Vorsicht angewendet werden, da es auch schwere Hautverbrennungen verursachen kann.
Beschreibung
Natriumhydroxid, auch bekannt als Lauge und Natronlauge, ist eine stark ätzende Substanz, die in kleinen Mengen in Kosmetika verwendet wird, um den pH-Wert eines Produkts zu bestimmen und zu halten.Natriumhydroxid ist eine extrem wichtige Verbindung in unserem Leben, weil es so viele Anwendungen hat. Es ist eine sehr häufige Basis in der chemischen Industrie und wird für viele Dinge verwendet, von denen viele in unserem täglichen Leben vorkommen. Eine der bekanntesten Anwendungen von Natriumhydroxid ist seine Verwendung in verstopften Abflüssen. Es kommt in vielen verschiedenen Marken von Abflussreinigern, aber einer der häufigsten ist Drano. Es kommt auch in Form von Laugenseife, mit der praktisch alles gewaschen werden kann, vom Geschirr bis zum Gesicht.
Natriumhydroxid-Struktur
Bei Raumtemperatur ist Natriumhydroxid ein weißer kristalliner geruchloser Feststoff, der Feuchtigkeit aus der Luft aufnimmt. Es ist eine hergestellte Substanz. Natriumhydroxid ist eine anorganische Verbindung, die verwendet wird, um den pH-Wert zu kontrollieren oder als Puffermittel in Kosmetika und Körperpflegeprodukten zu dienen. Es wurde in der Vergangenheit bei der Formulierung von Seifen verwendet, wird jedoch derzeit in einer Vielzahl von Formeln verwendet, darunter Badezusätze, Reinigungsprodukte, Duftstoffe, Fußpuder, Haarfärbemittel und -farben, Make-up, Nagelprodukte, persönliche Reinigungsprodukte, Shampoos, Rasierprodukte, Enthaarungsmittel, Hautpflegeprodukte und Sonnenschutzmittel sowie chemische Haarglätter und Haarwellensätze. Es ist auch ein beliebter Bestandteil in industriellen Lösungsmitteln als chemische Basis für Seifen, Ofenreiniger, Waschmittel und Abflussreiniger wegen seiner Fähigkeit, Fett, Öle, Fette und proteinbasierte Ablagerungen aufzulösen, nach Wikipedia. Weniger häufig wird Natriumhydroxid als Bestandteil in Zahnpasten gesehen.Natriumhydroxid ist von der FDA zugelassen und hat die GRAS-Einstufung (Generally Recognized as Safe) als direkter Lebensmittelzusatzstoff erhalten. Es wird jedoch hauptsächlich zum Waschen und chemischen Schälen von Produkten verwendet. Es ist für die Verwendung in Kosmetika und Körperpflegeprodukten in unterschiedlichen Konzentrationen zugelassen: 5 Gew.-% in Nagelhautlösungsmitteln, 2 Gew.-% in Haarglätter für den allgemeinen Gebrauch, 4,5 Gew.-% in Haarglätter für den professionellen Gebrauch, bis zu einem pH-Wert von 12,7 in Enthaarungsmitteln und bis zu pH 11 in anderen Anwendungen als pH-Regler.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
Chemische Eigenschaften
Natriumhydroxid, NaOH, auch als Natronlauge oder Natriumhydrat (und früher als Lauge bekannt) bezeichnet, ist ein weißer, massiver, zerfließender kristalliner Feststoff, der in Wasser, Alkohol und Glycerin löslich ist. Es schmilzt bei 318 ° C (606 VON) und ist die am weitesten verbreitete und verfügbare alkalische Chemikalie. Das meiste Natriumhydroxid wird als Nebenprodukt von Chlor durch die Verwendung von Elektrolysezellen hergestellt;Die Zellen sind vom Membran-, Quecksilber- oder Membrantyp. Etwas Natriumhydroxid wird als in den Zellen produziert markiert;Das meiste wird verdampft und als 50% ige und 73% ige Lösungen oder als wasserfreie Perlen verkauft. Die meisten ätzenden Endanwendungen erfordern Lösungen mit relativ geringen Konzentrationen. Natronlauge wird als analytisches Reagenz und chemisches Zwischenprodukt, in Scheuer- und Reinigungsbädern, in Gummirückgewinnungs- und Erdölraffinierungsbädern, in Abschreckbädern zur Wärmebehandlung von Stahl, in Schneid- und löslichen Ölen, in Seifen und Reinigungsmitteln und in einer Vielzahl anderer Anwendungen verwendet.
Chemische Eigenschaften
NaOH ist ein weißes, geruchloses, zerfließendes Material, das als Pellets, Flocken, Klumpen oder Stäbchen verkauft wird. Wässrige Lösungen sind als Natronlauge bekannt
Chemische Eigenschaften
Natriumhydroxid tritt als weiße oder fast weiße Schmelzmasse auf. Es ist in kleinen Pellets, Flocken, Stöcken und anderen Formen oder Formen erhältlich. Es ist hart und spröde und zeigt einen kristallinen Bruch. Natriumhydroxid ist sehr zerfließend und absorbiert bei Lufteinwirkung schnell Kohlendioxid und Wasser.
Physikalische Eigenschaften
Weiße orthorhombische Kristalle, hergestellt in Form von Pellets, Klumpen, Stäbchen, Perlen, Spänen, Flocken oder Lösungen; hygroskopisch; sehr ätzend; absorbiert schnell CO2 und Wasser aus der Luft; Dichte 2,13 g / cm3; schmilzt bei 323 ° C; verdampft bei 1388 ° C; Dampfdruck 1 torr bei 739 ° C und 5 torr bei 843 ° C; sehr wasserlöslich (110 g / 100 ml bei Raumtemperatur), Wärmeerzeugung bei Auflösung; wässrige Lösungen stark alkalisch, pH-Wert von 0,5% ige Lösung etwa 13 und 0,05% ige Lösung etwa 12; löslich in Methanol, Ethanol und Glycerin (23,8 g/100 ml Methanol und 13.9 g/100 ml Ethanol bei Umgebungstemperatur.).
Verwendungen
Natronlauge ist eine der am weitesten verbreitetechemikalien. Es wird verwendet, um Säuren zu neutralisieren; Natriumsalze herzustellen; Metalle als ihre Hydroxide auszufällen; in der Erdölraffination; in der Verseifung von Estern; bei der Behandlung von Cellulose, Kunststoffen und Kautschuk; und in zahlreichen synthetischen und analytischen Anwendungen.
Verwendungen
Natriumhydroxid wird kommerziell als wasserfreie Flocken oder Pellets oder als 50% ige oder 73% ige wässrige Lösungen verkauft. Es hat unzählige industrielle Anwendungen und ist eine der Top-10-Chemikalien in Bezug auf Produktion und Verwendung auf globaler Ebene. Etwa 15 Millionen Tonnen Natriumhydroxid werden jährlich verwendet. Seine größte Verwendung, die etwa die Hälfte seiner Produktion verbraucht, dient als Basis für die Herstellung anderer Chemikalien. Es wird verwendet, um den pH-Wert zu kontrollieren und Säuren in chemischen Prozessen zu neutralisieren. Die Papierindustrie nutzt Natriumhydoxid in großem Umfang für den Aufschlussprozess. Natriumhydroxid wird verwendet, um Fasern zu trennen, indem das verbindende Lignin gelöst wird. Es wird in ähnlicher Weise bei der Herstellung von Viskose aus Zellulose verwendet. Natriumhydroxid ist eine Schlüsselchemikalie in der Seife industry.In die verseifung prozess, triglyceride erhalten von tier und pflanzen sind erhitzt in abasic lösung zu geben glycerin und seife:
Natrium hydroxid ist verwendet in die textil industrie für bleichen und behandlung von textilien zu makethem farbstoff mehr leicht. Die Erdölindustrie verwendet Natriumhydroxid in Bohrschlämmen und Asa-Bakterizid. Natriumhypochlorit (NaOCl) wird ausgiebig zur Reinigung und als Desinfektionsmittel verwendet.Gewöhnliches Haushaltsbleichmittel besteht aus etwa 5% Natriumhypochloritlösung. Natriumhypochlorit wird durch Umsetzung von Chlor mit Natriumhydroxid hergestellt: Cl2 (g) + 2NaOH (aq) →NaOCl (aq) + NaCl (aq) + H2O (l). Natriumhydroxid wird in der Lebensmittelindustrie zur Reinigung verwendetund Schälen von Obst und Gemüse. Natriumhydroxid ist ein geringfügiger Bestandteil in vielen Gemeinsamenhaushaltsprodukte, aber in einigen kann es mehr als die Hälfte des Produkts ausmachen. Dranokristalle enthalten zwischen 30% und 60% Natriumhydroxid und einige Abflussreiniger können aus 100% Natriumhydroxid bestehen.
Verwendungen
Natriumhydroxid ist ein in Wasser lösliches Alkali mit einer Löslichkeit von 1 g in 1 ml Wasser. es wird verwendet, um die bitteren Chemikalien in Oliven zu zerstören, die zu schwarzen Oliven werden sollen. es neutralisiert auch Säuren in verschiedenen Lebensmitteln.
Verwendungen
Natriumhydroxid wird verwendet, um den pH-Wert eines Produkts so einzustellen, dass es für die Haut akzeptabler ist. Es wird allgemein als Ätznatron bezeichnet und dient oft als chemisches Reagenz bei der Herstellung von Seife. Wenn es zu konzentriert ist, kann es zu schweren Hautreizungen kommen.
Verwendung
Natriumhydroxid ist eine der wichtigsten Industriechemikalien. In Volumen ist es in den Top Ten der in den Vereinigten Staaten produzierten Chemikalien. Es wird bei der Herstellung einer großen Anzahl von Verbindungen, einschließlich mehrerer Natriumsalze, bei der Behandlung von Cellulose zur Herstellung von Rayon und Zellophan sowie bei der Herstellung von Seifen, Waschmitteln, Zellstoff und Papier verwendet. Natriumhydroxid ist ein übliches Neutralisationsmittel für Säuren in Säure-Base-Titrationen und Erdölraffination. Eine andere Hauptanwendung extrahiert Metalle von ihren Erzen, in denen Alkalifusion, wie Fusion mit Ätznatron, häufig angewendet wird, um die Erze zu öffnen. Zusätzlich wird Natriumhydroxid verwendet, um Metalle als Hydroxide auszufällen. Andere Verwendungen sind die Rückgewinnung von Gummi, das Auflösen von Casein in der Kunststoffherstellung, das Raffinieren von Pflanzenölen, die Verarbeitung von Textilien, als Laufmittel in der Ionenchromatographie, beim Ätzen und Galvanisieren sowie als Laborreagenz. Natriumhydroxid wird auch als starke Base in vielen organischen Synthesen und basisch katalysierten Reaktionen verwendet.
Verwendungen
NaOH-Lösungen werden verwendet, um Säuren zu neutralisieren und Natriumsalze herzustellen, z. B. bei der Erdölraffination, um Schwefel und organische Säuren zu entfernen; Cellulose bei der Herstellung von Viskose und Zellophan zu behandeln; bei der Rückgewinnung von Gummi, um das Gewebe aufzulösen; bei der Herstellung von Kunststoffen zum Auflösen von Casein. NaOH-Lösungen hydrolysieren Fette und bilden Seifen; Sie fällen Alkaloide (Basen) und die meisten Metalle (als Hydroxide) aus Wasserlösungen ihrer Salze. Pharmazeutisches Hilfsmittel (Alkalisierer).
Zubereitung
Natriumhydroxid wird zusammen mit Chlor durch Elektrolyse von Natriumchloridlösung hergestellt. Verschiedene Arten von Elektrolysezellen werden kommerziell verwendet. Sie umfassen die Quecksilberzelle, die Membranzelle und die Membranzelle.
Eine gesättigte Solelösung wird elektrolysiert. Chlorgas wird an der Anode und Natriumionen an der Kathode freigesetzt. Bei der Zersetzung von Wasser entstehen Wasserstoff- und Hydroxidionen. Das Hydroxidion verbindet sich mit dem Natriumion und bildet NaOH. Die gesamten elektrolytischen Reaktionen können dargestellt werden als:
2Na+ + 2Cl-+ 2H2O → Cl2 (g) + H2 (g) + 2NaOH (aq)
Die Quecksilberzelle verläuft in zwei Stufen, die getrennt in zwei Zellen auftreten. Die erste ist als Solezelle oder Primärelektrolyseur bekannt, in der sich Natriumionen auf der Quecksilberkathode unter Bildung von Amalgam ablagern, während an der Anode Chlorgas freigesetzt wird:
Na+ + Cl–→ Na-Hg (Kathode) + ½Cl2(g) (Anode)
In der zweiten Zelle, der sogenannten Zersetzerzelle, wird eine Graphitkathode verwendet, während Natriumamalgam als Anode dient. Wasser reagiert mit dem Natriummetall des Amalgams im Zersetzer:
Na-Hg + H2O → Na+ + OH– + ½H2 + Hg
In Chlor-Alkali-Membranzellen wird ein Diaphragma verwendet, um an der Anode freigesetztes Chlor von dem an der Kathode erzeugten Natriumhydroxid und Wasserstoff zu trennen. Ohne Diaphragma verbindet sich das gebildete Natriumhydroxid mit Chlor zu Natriumhypochlorit und Chlorat. In vielen Zellen werden Asbestmembranen für eine solche Trennung verwendet. Viele Arten von Membranzellen sind verfügbar.Natriumhydroxid wird entweder als wasserfreier Feststoff oder als 50% ige wässrige Lösung hergestellt.
Definition
Der wichtigste Handelkaustik.
Herstellungsverfahren
Natriumhydroxid wird durch Elektrolyse von Sole unter Verwendung von Inertelektroden hergestellt. Chlor wird als Gas an der Anode entwickelt undwasserstoff wird als Gas an der Kathode entwickelt. Die Entfernung von Chlorid- und Wasserstoffionen hinterlässt Natrium- und Hydroxidionen in Lösung.Die Lösung wird getrocknet, um das feste Natriumhydroxid herzustellen.Eine zweite Methode verwendet die Kellner-Solvay-Zelle. Gesättigte Natriumchloridlösung wird zwischen einer Kohlenstoffanode und einer einströmenden Quecksilberkathode elektrolysiert. In diesem Fall wird das Natrium an thecathode eher als der Wasserstoff wegen der Bereitschaft ofsodium produziert, sich im Quecksilber aufzulösen. Das Natrium-Quecksilber-Amalgam wird dann Wasser ausgesetzt und es entsteht eine Natronlauge.
Reaktionen
Natriumhydroxid ist stark alkalisch und kann mit Säuren zu Salzen und Wasser reagieren.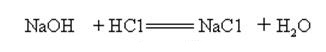
Natriumhydroxid reagiert mit sauren Oxiden zu Salz und Wasser, so dass Natriumhydroxid verwendet werden kann, um saure Gase im Labor oder industriell zu absorbieren.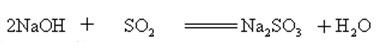
Natriumhydroxid kann mit wässrigen Lösungen vieler Metallsalze unter Bildung von Natriumsalzen und Metallhydroxiden reagieren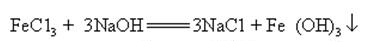
Wenn Natriumhydroxid und Ammoniaksalz zusammen erhitzt werden, kann Ammoniak freigesetzt werden 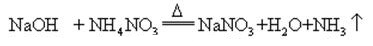
Natriumhydroxid ist stark ätzend, so dass die Glasflaschen, in denen Natriumhydroxid gelagert wird, stark korrosiv sind lösungen müssen Gummistopfen sein, und Glasstopfen sollten nicht verwendet werden, um zu verhindern, dass sich eine chemische Reaktion öffnet. Natriumhydroxid ist ein wichtiger industrieller Rohstoff und kann durch Elektrolyse von Salzlösung industriell hergestellt werden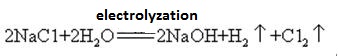
Allgemeine Beschreibung
Ein weißer Feststoff. Korrosiv gegenüber Metallen und Gewebe. Verwendet in der chemischen Herstellung, Erdölraffination, Reinigungsmitteln, Abflussreinigern.
Luft & Wasserreaktionen
In Wasser löslich. Die Auflösung kann genügend Wärme freisetzen, um Dämpfe und Spritzer zu verursachen und angrenzendes brennbares Material zu entzünden.
Reaktivitätsprofil
NATRONLAUGE (Natriumhydroxid) ist eine starke Base. Reagiert schnell und exotherm mit organischen und anorganischen Säuren. Absorbiert leicht Feuchtigkeit aus der Luft, um ätzende Halbfeststoffe zu bilden, die Aluminium und Zink unter Entwicklung von brennbarem Wasserstoffgas angreifen. Katalysiert die Polymerisation von Acetaldehyd und anderen polymerisierbaren Verbindungen; Diese Reaktionen können heftig ablaufen, beispielsweise polymerisiert Acrolein mit extremer Gewalt, wenn es mit alkalischen Materialien wie Natriumhydroxid in Kontakt kommt . Reagiert mit großer Gewalt mit Phosphorpentaoxid, wenn es durch lokale Erwärmung initiiert wird . Der Kontakt (als Trockenmittel) mit Tetrahydrofuran, das oft Peroxide enthält, kann gefährlich sein — bei einer solchen Verwendung des chemisch ähnlichen Kaliumhydroxids sind Explosionen aufgetreten. Durch Mischen mit einer der folgenden Substanzen in einem geschlossenen Behälter stiegen Temperatur und Druck an: Eisessig, Essigsäureanhydrid, Acrolein, Chlorhydrin, Chlorsulfonsäure, Ethylencyanhydrin, Glyoxal, Salzsäure (36%), Flusssäure (48,7%), Salpetersäure (70%), Oleum, Propiolacton, Schwefelsäure (96%) . Versehentlicher Kontakt zwischen einer ätzenden Reinigungslösung (wahrscheinlich Natriumhydroxid enthaltend) und Pentol verursachte eine heftige Explosion. . Das Erhitzen mit einem Gemisch aus Methylalkohol und Trichlorbenzol während eines Syntheseversuchs führte zu einem plötzlichen Druckanstieg und einer Explosion . Heiße und/oder konzentrierte NaOH kann Hydrochinon bei erhöhter Temperatur exotherm zersetzen. In: NFPA Pub. 491M, 1975, 385)
Gefahr
Ätzend auf Gewebe in Gegenwart von Feuchtigkeit, stark reizend auf Gewebe (Augen, Haut, Schleimhäute und obere Atemwege), giftig durch Verschlucken.
Gesundheitsgefahr
Starke ätzende Wirkung auf kontaktiertes Gewebe. EINATMEN: Staub kann die oberen Atemwege und die Lunge selbst schädigen und von leichten Nasenreizungen bis hin zu Lungenentzündungen führen. VERSCHLUCKEN: schwere Schädigung der Schleimhäute; schwere Narbenbildung oder Perforation können auftreten. AUGENKONTAKT: verursacht schwere Schäden.
Gesundheitsgefahr
Natriumhydroxid ist eine stark ätzende Substanzdas verursacht Schäden an menschlichen Geweben.Seine Wirkung auf die Haut ist etwas andersvon sauren Verbrennungen. Es gibt keine unmittelbaren Schmerzen,aber es dringt in die Haut ein. Es gerinnt nichtprotein, um sein weiteres Eindringen zu verhindern,und so kann die ätzende Verbrennung schwer werdenund langsame Heilung. Das Verschütten seiner konzentrierten Lösungen in die Augen kann zu schweren Reizungen oder bleibenden Verletzungen führen.
Es ist giftig durch Verschlucken sowie Inhalierenvon seinem Staub. Obwohl die orale Toxizität einer 5-10% igen Natronlauge bei Versuchstieren gering war, können hohe Dosierungen bei höheren Konzentrationen Erbrechen, Erschöpfung und Kollaps verursachen. Die orale letale Dosisein Kaninchen ist 500 mg / kg (NIOSH 1986).
Natriumhydroxid-Stäube oder Aerosole sindreizend auf Augen, Nase und Rachen. Verlängerte Exposition gegenüber hohen Konzentrationen in der Luftkann zu Geschwüren des Nasengangs führen.
Brandgefahr
Nicht brennbar, Stoff selbst brennt nicht, kann sich aber beim Erhitzen zersetzen und korrosive und/oder giftige Dämpfe erzeugen. Einige sind Oxidationsmittel und können brennbare Stoffe (Holz, Papier, Öl, Kleidung usw.) entzünden.). Bei Kontakt mit Metallen kann brennbares Wasserstoffgas entstehen. Behälter können beim Erhitzen explodieren.
Entflammbarkeit und Explosionsfähigkeit
Natriumhydroxid und Kaliumhydroxid sind als Feststoffe oder wässrige Lösungen nicht entflammbar.
Pharmazeutische Anwendungen
Natriumhydroxid wird häufig in pharmazeutischen Formulierungen verwendet, um den pH-Wert von Lösungen einzustellen. Es kann auch verwendet werden, um mit schwachen zu reagierensäuren zu Salzen.
Industrielle Anwendungen
Natronlauge (NaOH) gilt als der stärkste alkalische pH-Regler. Ätznatronist eine sehr aktive Substanz und ist stark ätzend. Der Großteil der Natronlauge wird hergestelltdurch Elektrolyse von gesättigten Solen (NaCl). Natronlauge hat eine sehr starke pH-regulierende Fähigkeit (d. H. von pH 7 bis pH 14) bei einer relativ niedrigen Dosierung im Vergleich zu anderen alkalischen Substanzen. Kommerziell ist Ätznatron in wasserfreier Form erhältlich, aber in den meisten Bergbauanwendungen wird die Ätznatron als 50% ige Lösung geliefert.
In der mineralverarbeitenden Industrie wird Natriumhydroxid hauptsächlich zur Alkalitätskontrolle bei der Verarbeitung von nichtmetallischen Mineralien verwendet. In der Grundmetallflotation wird die Verwendung Vonnatriumhydroxid ist selten.
Sicherheitsprofil
Intraperitoneal verabreicht. Mäßig giftig durch Verschlucken. Mutationsdaten gemeldet. Ein ätzendes Reizmittel für Haut, Augen und Schleimhäute. Wenn es zur Zersetzung erhitzt wird, emittiert es giftige Nanodämpfe.
Sicherheit
Natriumhydroxid ist in der Pharma- und Lebensmittelindustrie weit verbreitet und wird bei niedrigen Konzentrationen allgemein als ungiftiges Material angesehen. In hohen Konzentrationen ist es ein ätzender Reizstoffdie Haut, Augen und Schleimhäute.
LD50 (Maus, IP): 0,04 g / kg
LD50 (Kaninchen, oral): 0,5 g / kg
Mögliche Exposition
NaOH wird verwendet, um Säuren zu neutralisieren und Natriumsalze in der Erdölraffination, Viskose; Zellophan, Kunststoffproduktion; und bei der Rückgewinnung von Lösungen ihrer Salze. Es wird bei der Herstellung von mercerisierter Baumwolle, Papier, Sprengstoffen und Farbstoffen bei der Metallreinigung verwendet; elektrolytische Extraktion von Zink; Verzinnen; Oxidbeschichtung; Waschen, Bleichen, Geschirrspülen; und es wird in der chemischen Industrie verwendet.
lagerung
Spritzschutzgläser und undurchlässige Handschuhe sollten beim Umgang mit diesen Stoffen stets getragen werden, um Augen- und Hautkontakt zu vermeiden. Operationen mit Metallhydroxidlösungen, die das Potenzial haben, Aerosole zu erzeugen, sollten in einer Begasungsumgebung durchgeführt werden, um eine Exposition durch Einatmen zu verhindern. NaOH und KOH erzeugen erhebliche hitzewenn in wasser gelöst; beim mischen mit wasser, immer hinzufügen ätzmittel langsam zu thewater und rühren kontinuierlich. Fügen Sie dem Feststoff niemals Wasser in begrenzten Mengen hinzuhydroxide. Behälter mit Hydroxiden sollten an einem kühlen, trockenen Ort gelagert werden,getrennt von Säuren und unverträglichen Substanzen.
Lagerung
Natriumhydroxid sollte in einem luftdichten nichtmetallischen Behälter an einem kühlen, trockenen Ort gelagert werden. Wenn es der Luft ausgesetzt wird, absorbiert Natriumhydroxid schnell Feuchtigkeit und verflüssigt sich, wird jedoch anschließend aufgrund der Absorption von Kohlendioxid und der Bildung von Natriumcarbonat wieder fest.
Versand
UN1823 NaOH, Feststoff, Gefahrenklasse: 8; Etiketten: 8-Korrosives Material. UN1824 NaOH, Lösung, Gefahrenklasse: 8; Etiketten: 8-Korrosives Material
Reinigungsmethoden
Häufige Verunreinigungen sind Wasser und Natriumcarbonat. Natriumhydroxid kann gereinigt werden, indem 100 g in 1 l reinem EtOH gelöst und die Lösung unter Vakuum durch eine feine Sinterglasscheibe filtriert wird, um unlösliche Carbonate und Halogenide zu entfernen. (Dieser und nachfolgende Arbeitsgänge sollten in einer trockenen, CO2-freien Box durchgeführt werden.) Die Lösung wird unter leichtem Erhitzen im Vakuum eingeengt, wobei eine dicke Aufschlämmung des Monoalkoholats erhalten wird, die auf eine grobe Sinterglasscheibe überführt und mutterlaugenfrei evakuiert wird. Nachdem die Kristalle mehrmals mit gereinigtem Alkohol gewaschen wurden, um Spuren von Wasser zu entfernen, werden sie im Vakuum unter milder Erwärmung etwa 30 Stunden lang getrocknet, um das Alkoholat zu zersetzen, wobei ein feines weißes kristallines Pulver zurückbleibt . ÄTZEND. Natronlauge (ätzend), 14.77. Carbonation kann durch Durchgang durch eine Anionenaustauschersäule (wie Amberlite IRA-400; OH-Form) entfernt werden. Die Säule sollte durch langsames Vorleiten von Natronlauge frisch aus der Chloridform hergestellt werden, bis das Abwasser keinen Test auf Chloridionen ergibt. Nach Gebrauch kann die Säule durch Waschen mit verdünnter HCl, dann Wasser regeneriert werden. In ähnlicher Weise werden andere Metallionen entfernt, wenn eine 1 M (oder mehr verdünnte) NaOH-Lösung durch eine Säule aus Dowex-Ionenaustauscher-A-1-Harz in seiner Na + -Form geleitet wird. Alternativ kann die Carbonatkontamination reduziert werden, indem NaOH-Stäbchen (analytische Reagenzqualität) schnell mit H2O gespült und dann in destilliertem H2O gelöst werden oder indem eine konzentrierte wässrige NaOH-Lösung hergestellt und die klare überstehende Flüssigkeit abgezogen wird. (Unlösliches Na2CO3 bleibt zurück. Die Carbonatkontamination kann reduziert werden, indem ein leichter Überschuss an konzentriertem BaCl2 oder Ba (OH) 2 zu einer NaOH-Lösung gegeben wird, gut geschüttelt wird und der BaCO3 -Niederschlag sich absetzen kann. Wenn das Vorhandensein von Ba in der Lösung nicht akzeptabel ist, kann eine elektrolytische Reinigung verwendet werden. Beispielsweise wird Natriumamalgam durch Elektrolyse von 3 L 30% iger NaOH mit 500 ml reinem Quecksilber als Kathode und einer Platinanode hergestellt, die 15 Faradays bei 4 Ampere in einer dickwandigen Polyethylenflasche passiert. Anschließend wird die Flasche mit Einlass- und Auslassrohren versehen, wobei die verbrauchte Lösung durch CO2-freies N2 ausgespült wird. Das Amalgam wird dann gründlich mit einer großen Menge entionisiertem Wasser gewaschen (wobei der Elektrolysestrom eingeschaltet ist, um den Na-Verlust zu minimieren). Schließlich wird ein sauberer Stahlstab in der Lösung mit dem Amalgam in Kontakt gebracht (um die Wasserstoffentwicklung zu erleichtern), wobei die Reaktion bis zum Erreichen einer geeigneten Konzentration fortgesetzt werden kann, bevor sie in ein Vorratsgefäß überführt und nach Bedarf verdünnt wird .
Unverträglichkeiten
Eine starke Base und ein starkes Oxidationsmittel. Heftige Reaktion mit Säure. Unverträglich mit Wasser; brennbare Flüssigkeiten; organische Halogene, Nitromethan und Nitroverbindungen, Brennstoffe. Absorbiert schnell Kohlendioxid und Wasser aus der Luft. Kontakt mit Feuchtigkeit oder Wasser kann Wärme erzeugen. Korrosiv gegenüber Metallen. Kontakt mit Zink, Aluminium, Zinn und Blei in Gegenwart von Feuchtigkeit unter Bildung von explosivem Wasserstoffgas. Greift einige Formen von Kunststoffen, Gummi oder Beschichtungen an.
Inkompatibilitäten
Natriumhydroxid ist eine starke Base und ist mit jedem unverträglichverbindung, die leicht Hydrolyse oder Oxidation erfährt. Es reagiert mit Säuren, Estern und Ethern, insbesondere in wässriger Lösung.
Abfallentsorgung
In den Wassertank einleiten, neutralisieren und anschließend mit Wasser in den Abwasserkanal spülen.
Regulatorischer Status
GRAS gelistet. Zur Verwendung als Lebensmittelzusatzstoff in Europa zugelassen.Enthalten in der FDA-Datenbank für inaktive Inhaltsstoffe (Dentalpräparate; Injektionen; Inhalationen; nasale, ophthalmische, orale, otische, rektale, topische und vaginale Präparate). Enthalten in nichtparenteralenund parenterale Arzneimittel, die in Großbritannien zugelassen sind. Enthalten in derkanadische Liste der akzeptablen nicht-medizinischen Inhaltsstoffe.
Leave a Reply