Kovalente Verbindungen
Sie haben jetzt eine kurze Vorstellung davon, warum sich verschiedene Elemente unterschiedlich verhalten. Aber wissen Sie, ein großer Teil davon wegen der „Natur“ der Bindungen in den Verbindungen ist. Genau wie Sie und Ihre besten Freunde aufgrund der „inneren“ Eigenschaften eine Reihe von Unterschieden aufweisen, ist dies bei ionischen und kovalenten Verbindungen der Fall. In diesem Kapitel erfahren Sie mehr über das Konzept der kovalenten Verbindungen, ihre Eigenschaften und vieles mehr.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Dies liegt daran, dass die Atome innerhalb der kovalenten Moleküle sehr eng zusammengehalten werden. Jedes Molekül ist in der Tat ziemlich getrennt und die Anziehungskraft zwischen den einzelnen Molekülen in einer kovalenten Verbindung ist tendenziell schwach.
Wir benötigen sehr wenig Energie, um die Moleküle zu trennen. Dies liegt an den Anziehungskräften zwischen den Molekülen ohne elektrische Gesamtladung. Kovalente Verbindungen sind üblicherweise gasförmige Moleküle bei Raumtemperatur und Druck. Sie können auch Flüssigkeiten mit relativ niedrigen Siedepunkten sein.
Diese Eigenschaften könnten auf ihre schwachen intermolekularen Kräfte zurückgeführt werden, die diese Atome zusammenhalten. Wir haben jedoch auch viele feste kovalente Verbindungen. Sie haben niedrige Schmelzpunkte. Es ist jedoch interessant festzustellen, dass eine kleine Anzahl von ihnen eine völlig andere Struktur hat. Sie bilden riesige Strukturen, in denen eine große Anzahl von Atomen zusammengehalten wird. Dies ist aufgrund des Vorhandenseins gemeinsamer Elektronen möglich.
Diese riesigen Molekülstrukturen sind im Grunde Gitter aus Molekülen, die durch kovalente Bindungen Struktur zusammengehalten werden. Diese kovalenten Bindungen sind sehr stark. Sie neigen auch dazu, sehr hart mit hohen Schmelzpunkten zu sein, die sich von den meisten kovalenten Verbindungen unterscheiden. Das Beispiel dieser Art von kovalenten Verbindungen umfasst Diamant und Graphit eines Kohlenstoffatomnetzwerks. Sie umfassen auch Siliciumdioxid von Silizium und Sauerstoffatomen Netzwerk.
Laden Sie den Spickzettel für chemische Bindungen als PDF herunter, indem Sie auf den Download-Button unten klicken


Durchsuchen Sie weitere Themen unter Chemische Bindung und Molekülstruktur
- Bindungsparameter
- Grundlagen der chemischen Bindung
- Hybridisierung
- Wasserstoffbindung
- Ionische oder elektrovalente Verbindungen
- Molekülorbitaltheorie
- Polarität von Bindungen
- Resonanzstrukturen
- Valenzbindung Theorie
- VSEPR-Theorie
Allgemeine Eigenschaften kovalenter Verbindungen
- Kovalente Verbindungen haben normalerweise niedrige Schmelzpunkte. Eine Ausnahme bilden Moleküle aus Kieselsäure und Diamanten, die einen hohen Schmelzpunkt haben.
- Diese Verbindungen haben niedrige Siedepunkte. Dies ist auf ihre schwache Anziehungskraft zwischen den verschiedenen gebundenen Atomen zurückzuführen. Van-Der-Waals-Kräfte binden diese Atome.
- Diese Verbindungen sind üblicherweise Gase und Flüssigkeiten mit niedrigen Siedepunkten und Schmelzpunkten.
- Die festen kovalenten Verbindungen haben weiche Strukturen wie Graphit. Dies liegt an der Anwesenheit einer Elektronenwolke zwischen jeder Schicht von Kohlenstoffatomen.
- Diese Verbindungen sind Nichtleiter elektrischer Ladung. Das Fehlen geladener Ionen ist der Hauptgrund dafür. Eine Ausnahme bildet Graphit, wo wir eine Elektronenwolke sehen. Diese machen Graphit zu einem guten Leiter.
- Sie sind auch schlechte Wärmeleiter. Ihren Molekülen fehlen freie Elektronen und das behindert den Fluss der Wärmeenergie.
- Kovalente Verbindungen besitzen keine polaren Eigenschaften als allgemeine Eigenschaft. Daher sind diese Verbindungen in Wasser unlöslich. Wassermoleküle sind nicht absolut neutral und haben eine leichte negative Ladung am Sauerstoffatom und leichte positive Ladungen an den Wasserstoffatomen und da kovalente Verbindungen aus neutralen Molekülen oder Molekülen mit geringen Ladungen bestehen und daher nicht stark von Wassermolekülen angezogen werden.
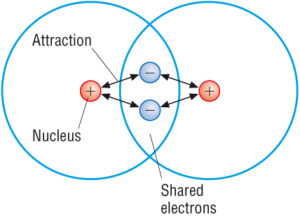
(Quelle: Google)
Physikalische Und chemische Eigenschaften
- Die flüssigen kovalenten Verbindungen verdampfen. Dies bedeutet, dass die Moleküle von Flüssigkeiten und Feststoffen von ihrer Oberfläche in die Luft gelangen.
- Diese Verbindungen haben eine sehr geringe Affinität zwischen ihren Molekülen.
- Verschiedene kovalente Verbindungen haben ihre eigenen charakteristisch geformten Moleküle. Ihre Bindungen sind in voreingestellten Winkeln gerichtet.
- Einige Verbindungen, insbesondere Arzneimittel, sind in Wasser löslich. Der Rest ist in Öl löslich.
- Die meisten kovalenten Verbindungen sind unpolar oder neigen nur sehr wenig zur vollständigen Spaltung unter Bildung von Ionen und leiten daher niemals Elektrizität.
- Bei normaler Temperatur und normalem Druck finden wir diese Verbindungen entweder als Flüssigkeiten oder als Gase. Aber es gibt auch Feststoffe und sie haben höhere Molekulargewichte.
- Die kovalenten Verbindungen Kristalle sind von zwei Arten: Eine, die schwache van der Waal Kraft hält diese zusammen wie in Jod hat. Diese sind leicht schmelzbar und flüchtig, die andere hat ein großes Netzwerk von Atomen, die die Makromoleküle bilden.
- Diese Verbindungen sind in organischen Lösungsmitteln wie Ether und Benzol löslich.
- Kovalente Bindungen sind gerichteter Natur. Daher zeigen sie das Phänomen der Isomerie.
- Kovalente Verbindungen haben im Gegensatz zu den verschiedenen ionischen Verbindungen eine sehr langsame Reaktionsgeschwindigkeit.
Gelöste Beispiele für Sie
Frage: Warum sind kovalente Verbindungen in Wasser nicht löslich?
Antwort: Wassermoleküle sind nicht absolut neutral. Diese Moleküle haben eine leichte negative Ladung am Sauerstoffatom und leichte positive Ladungen an den Wasserstoffatomen. Andererseits wissen wir, dass die kovalenten Verbindungen aus neutralen Molekülen oder Molekülen mit geringen Ladungen bestehen. Aus diesem Grund werden diese Verbindungen nicht stark von Wassermolekülen angezogen.
Leave a Reply