Kohlenstoff: das Wesentliche
Kohlenstoff ist ein Element der Gruppe 14 und in der Natur sehr weit verbreitet. Es ist in Hülle und Fülle in der Sonne, Sterne, Kometen und Atmosphären der meisten Planeten gefunden. Kohlenstoff ist als Kohlendioxid in der Atmosphäre vorhanden und in allen natürlichen Gewässern gelöst. Es ist ein Bestandteil von Gesteinen als Carbonate von Kalzium (Kalkstein), Magnesium und Eisen. Die Atmosphäre des Mars ist sehr dünn, aber was es gibt, enthält etwa 95 % CO2.Kohle, Erdöl und Erdgas sind hauptsächlich Kohlenwasserstoffe. Kohlenstoff ist einzigartig unter den Elementen in der Vielzahl der verschiedenen Verbindungen, die er bilden kann. Die organische Chemie, eine 1/112-Untergruppe der anorganischen Chemie, ist das Studium von Kohlenstoff und seinen Verbindungen. Während Silizium bei der Bildung einer Vielzahl verwandter Verbindungen an die Stelle von Kohlenstoff treten kann, ist es derzeit nicht möglich, stabile Verbindungen mit sehr langen Ketten von Siliziumatomen zu bilden.Kohlenstoff kommt in der Natur in drei allotropen Formen vor: amorph, Graphit und Diamant. Graphit ist eines der weichsten bekannten Materialien, während Diamant eines der härtesten ist. Kohlenstoff, wie mikroskopisch kleine Diamanten, wird in einigen Meteoriten gefunden. Natürliche Diamanten werden in alten vulkanischen „Pfeifen“ wie in Südafrika gefunden. Diamanten werden auch vom Meeresboden vor dem Kap der Guten Hoffnung geborgen.

Ein Diamantring.In jüngerer Zeit wurde eine andere Form von Kohlenstoff, Buckminsterfullerene, C60, entdeckt. Diese Form von Kohlenstoff ist heute in Forschungslabors von großem Interesse.
Reiner Kohlenstoff ist in verschiedenen Formen (allotropen) erhältlich. Die häufigste Form von reinem Kohlenstoff ist α-Graphit. Dies ist auch die thermodynamisch stabilste Form. Diamant ist eine zweite Form von Kohlenstoff, aber viel seltener. Andere Formen von Kohlenstoff umfassen die Fullerene. Während Diamant und Graphit unendliche Gitter sind, sind Fullerene wie Buckminsterfullerene, C60, eine diskrete molekulare Spezies. Amorphe Formen von Kohlenstoff wie Ruß und Ruß sind Materialien, die aus sehr kleinen Graphitpartikeln bestehen.Der meiste Graphit ist α-Graphit und besitzt eine Schichtstruktur, in der jeder Kohlenstoff direkt an drei andere Kohlenstoffatome in einem Abstand von 141,5 pm gebunden ist. Eine Delokalisierung in der Bindung ist offensichtlich, da die CC-Abstände gleich und kürzer sind als bei normalen Kohlenstoff-Kohlenstoff-Einzelbindungen (typcally 154 pm). Der Abstand zwischen den Kohlenstoffatomschichten beträgt 335,4 pm. In den meisten Graphit (α-Graphit) sind die Schichten der Atome in einem ABABAB angeordnet… wiederholen, aber die β-Form (rhomboedrisch) die Stapelung ist ABCABCABC… obwohl die Kohlenstoff-Kohlenstoff-Abstände und der Zwischenschichtabstand gleich bleiben wie in der α-Form. Die Enthalpiedifferenz zwischen α- und α-Graphit beträgt weniger als 1 kJ mol-1 (0,59 ± 0,17 kJ mol-1. Formen der schwereren Elemente, die Graphit entsprechen, sind nicht bekannt und die Strukturen von Silizium, Germanium und Grauzinn hängen mit der Diamantstruktur zusammen (unten).

Atomanordnungen in den häufigsten Kohlenstoffzuteilungen: α-Graphit.
Da Diamant eine etwas kompaktere Struktur hat, ist seine Dichte größer als die von Graphit. Das Aussehen von Diamant ist bekannt und es ist auch eines der härtesten bekannten Materialien. Wie Graphit ist es relativ unreaktiv, brennt aber an Luft bei 600-800 ° C. Jedes Kohlenstoffatom ist tetraedrisch an vier Nachbarn in einem Abstand von 154,45 pm gebunden, so dass jeder Diamantkristall eine einzelne Riesengitterstruktur ist. Im Prinzip (und in der Praxis!) graphit kann durch Anwendung von Wärme und Druck in Diamant umgewandelt werden. Die Einheitszelle des Diamanten ist kubisch mit a = 356,68 pm. Fast alle Diamanten besitzen diese Struktur, aber ein sehr kleiner Prozentsatz zeigt eine hexagonale Struktur, die mit Wurtzit verwandt ist, und diese werden Lonsdaleit genannt.

Kristallstrukturen von Diamant.
Kürzlich wurde ein weiteres Allotrop von Kohlenstoff charakterisiert. Während Diamant und Graphit unendliche Gitter sind, ist Buckminsterfullerene, C60, eine diskrete molekulare Spezies. Das Buckminsterfulleren-Molekül ist ein Netz aus 12 Fünfecken und 20 Sechsecken, die zu einer Kugel gefaltet sind. Der Effekt ist dem Patchwork aus 12 fünfeckigen und 20 sechseckigen Lederstücken sehr ähnlich, die zusammengenäht einen Verbandsfußball (Fußball) bilden. Der Name buckminsterfullerene (oder Buckyball wurde wegen der Beziehung zwischen der Struktur von C60 und R geprägt. Buckminsterfullerene ist jetzt im Handel erhältlich und wurde auch im interstellaren Raum und Ruß identifiziert.
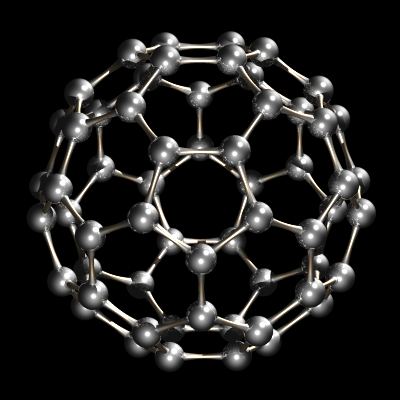
C60, Buckminsterfullerene.Andere Fullerene (geschlossene Kohlenstoffkäfige) wie C60 und C84 sind ebenfalls bekannt und im Handel erhältlich. Das kleinste mögliche Fulleren ist das dodekaedrische C20, das aus 12 Fünfecken und überhaupt keinen Sechsecken besteht. Nanoröhren sind mit Fullerenen verwandt. Es handelt sich um Rohre, die das Aussehen von gewalztem Graphit haben, obwohl sie aus Graphit bestehen. Sie sind offen, während Fullerene geschlossene Strukturen sind.Ein interessantes Merkmal von Fullerenen ist ihre Fähigkeit, Atome wie Kalium und andere Alkalimetalle einzuschließen, um endohedrale Strukturen zu bilden, die als K @ C60 bezeichnet werden.1961 übernahm die Internationale Union für reine und angewandte Chemie (IUPAC) das Isotop 12C als Grundlage für Atomgewichte. Kohlenstoff-14, 14C, ein Isotop mit einer Halbwertszeit von 5730 Jahren, wird verwendet, um Materialien wie Holz, archäologische Proben usw. zu datieren. Kohlenstoff-13, 13C, ist besonders nützlich für Isotopenmarkierungsstudien, da es nicht radioaktiv ist, sondern ein Spin I = 1/2-Kern und daher ein guter NMR-Kern ist.
Leave a Reply