First-Line-Behandlung von metastasiertem kastratenresistentem Prostatakrebs
Im Jahr 2019 macht Prostatakrebs (PCa) fast 1 von 5 neuen Krebsdiagnosen bei Männern in den USA aus.1 In den letzten Jahren ist die Inzidenzrate von Prostatakrebs (PCa) insgesamt um etwa 7% pro Jahr zurückgegangen.1 Der starke Rückgang der Inzidenz wurde allgemein auf verminderte Prostata-spezifische Antigen (PSA) -Tests von 2008 bis 2013 zurückgeführt. Die verringerte Verwendung des PSA-Screenings wurde durch die Empfehlungen der United States (US) Preventive Services Task Force gegen das routinemäßige PSA-Screening verursacht. Dies war eine Grade-D-Empfehlung speziell bei Männern im Alter von 75 Jahren und älter, die 2008 erklärt und später 2011 auf alle Männer ausgeweitet wurde, da Bedenken hinsichtlich Überdiagnose und Überbehandlung aufkamen.2 Obwohl die Prävalenz von PSA-Tests von 2013 bis 2015 nicht mehr abnahm und sich stabilisierte, 3 ist der Effekt der Screening-Reduktion auf die Inzidenz fortgeschrittener Erkrankungen noch unklar. Eine Analyse eines großen Krebsregisters, das 89% der US-Bevölkerung abdeckt, ergab, dass der allgemeine Rückgang der PCa-Inzidenz tatsächlich einen Anstieg der Ferndiagnosen ab 2010 über Alter und Rasse hinweg maskiert.4
Unabhängig von der gegebenen Behandlung entwickeln etwa 20% -30% der Patienten mit lokalisierter PCa eine metastasierende Erkrankung, die üblicherweise mit einer Hormontherapie behandelt wird.5 Dies kann durch chirurgische Kastration (bilaterale Orchiektomie) oder durch medizinische Kastration unter Verwendung einer Androgenentzugstherapie (ADT) erfolgen. Beide Methoden erreichen einen Kastratenspiegel von Serumtestosteron, der als Standard für die Behandlung von metastasiertem hormonsensitivem PCa (mHSPC) angesehen wird. mHSPC ist jedoch dazu bestimmt, zum metastasierten kastratenresistenten Prostatakrebs (mCRPC) überzugehen.6 Der kastratenresistente Prostatakrebs (CRPC) -Zustand ist definiert als Fortschreiten der Krankheit trotz Erreichen des Kastraten-Testosteronspiegels (Serumtestosteron < 50 ng / dl oder 1.7 nmol / l) und kann sich entweder als kontinuierlicher Anstieg des Serum-PSA-Spiegels, als Fortschreiten einer vorbestehenden Erkrankung und / oder als Auftreten neuer Metastasen darstellen.7 CRPC hat ein medianes Überleben von ungefähr drei Jahren8 und ist mit einer signifikanten Verschlechterung der Lebensqualität verbunden.9 Der genaue Mechanismus des Übergangs von mHSPC zu mCRPC ist noch unklar. Es ist jedoch bekannt, dass der Androgenrezeptor (AR) trotz Kastratenspiegel von Androgenen aktiv bleibt und weiterhin die PCa-Progression in CRPC vorantreibt.10 Dies hat zur Entwicklung neuer Wirkstoffe geführt, die darauf abzielen, die Androgenproduktion weiter zu verringern oder die AR-Funktion zu blockieren. Es gibt jedoch andere biologische Wege, die unabhängig von der Androgensignalisierung funktionieren und auch zu CRPC führen.
Mehrere signifikante Verschiebungen sind in den Behandlungsmöglichkeiten des mHSPC-Raums aufgetreten, was zu einem erheblichen Überlebensvorteil führte (siehe Link „Die sich schnell entwickelnde Managementstrategie für metastasierten hormonsensitiven Prostatakrebs“), einschließlich der Einführung der Chemotherapie in der CHAARTED-Studie11 und der STAMPEDE-Studie,12 der Zugabe von Abirateronacetat und Prednison in der LATITUDE-Studie13 und der STAMPEDE-Studie, 14 der Zugabe von Enzalutamid in der ARCHES-Studie15 und der ENZAMET-Studie, 16 und schließlich die Zugabe von apalutamid, ein orales nichtsteroidales Antiandrogen, das wie Enzalutamid bindet direkt an die Ligandenbindungsdomäne des AR und verhindert AR-Translokation, DNA-Bindung und AR-vermittelte Transkription.17 Die TITAN-Studie zeigte einen Nutzen für das Gesamtüberleben (OS) bei mit Apalutamid behandelten mHSPC-Patienten.18 Apalutamid hat auch in der placebokontrollierten Phase-3-Studie SPARTAN19 einen Nutzen gegenüber Placebo bei nicht metastasiertem CRPC (nmCRP) gezeigt, ähnlich dem Nutzen, den Patienten mit nicht metastasiertem kastratenresistentem Prostatakrebs (nmCRPC) in der PROSPER-Studie mit Apalutamid gezeigt haben20 (siehe Link „Die neuartigen Behandlungen für nicht metastasierten kastratenresistenten Prostatakrebs“). Diese Behandlungsfortschritte im mHSPC- und nmCRPC-Setting haben die Frage aufgeworfen, welche Behandlungsoptionen Patienten im mCRPC-Setting angeboten werden sollten.21
Die Behandlung von Männern mit CRPC hat sich in den letzten 15 Jahren dramatisch verändert. Vor 2004, als Patienten die primäre ADT versagten, wurden Behandlungen ausschließlich zur Linderung verabreicht. Die wegweisenden Studien von Tannock et al.22 und Petrylak et al.23 im Jahr 2004 waren die ersten, die eine Docetaxel-Chemotherapie bei mCRPC-Patienten einführten, von denen gezeigt wurde, dass sie ihr Überleben verbessern. Da Docetaxel jedoch von der FDA zugelassen wurde, wurden fünf weitere vorteilhafte Wirkstoffe, die einen Überlebensvorteil zeigen, basierend auf randomisierten klinischen Studien von der FDA zugelassen (Tabelle 1). Dazu gehören Enzalutamid und Abirateron, die spezifisch die Androgenachse beeinflussen, Sipuleucel-T, das das Immunsystem stimuliert;24 Cabazitaxel, ein weiteres Chemotherapeutikum;25 und Radium-223, eine Radionuklidtherapie.26 Andere Behandlungen für mCRPC haben gezeigt, dass sie die Ergebnisse verbessern, wurden jedoch noch von der FDA zugelassen und werden in einer weiteren Überprüfung erörtert. Aufgrund des erheblichen Anstiegs mehrerer von der FDA zugelassener Therapeutika bei Patienten mit CRPC stehen Kliniker vor einer Vielzahl von Behandlungsoptionen und einer Vielzahl potenzieller Sequenzen dieser Wirkstoffe, was die klinische Entscheidungsfindung bei mCRPC erheblich komplexer macht.
Tabelle 1. Mittel, die für die Behandlung von metastasiertem kastratenresistentem Prostatakrebs in den USA zugelassen wurden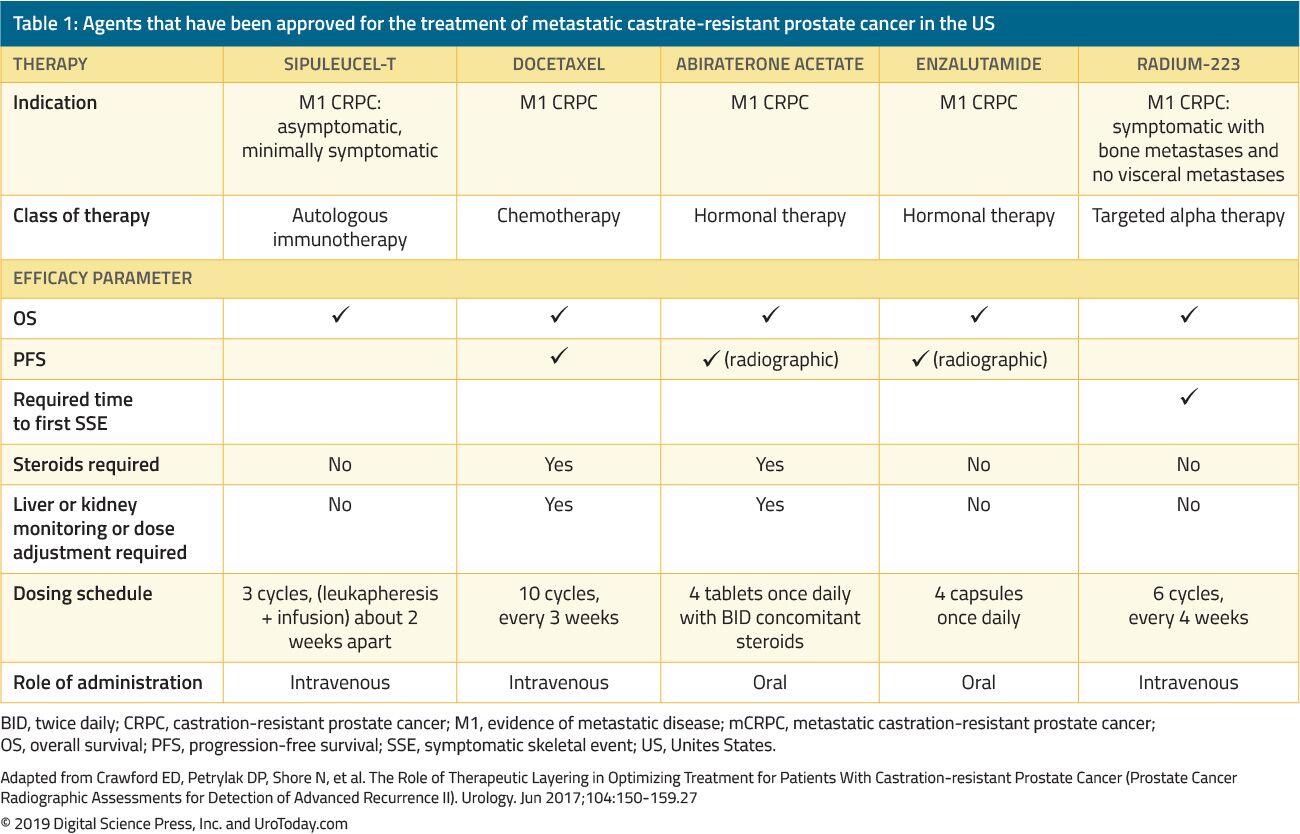
mCRPC ist in der Regel eine schwächende Krankheit, und die Patienten werden höchstwahrscheinlich von einer Managementstrategie profitieren, die von einem multidisziplinären Team aus Urologen, medizinischen Onkologen, Strahlenonkologen, Krankenschwestern, Psychologen und Sozialarbeitern formalisiert wird.28 Es ist unbedingt erforderlich, die Optionen für eine Palliationsbehandlung zu erörtern, wenn eine zusätzliche systemische Behandlung in Betracht gezogen wird, einschließlich der Behandlung von Schmerzen, Verstopfung, Anorexie, Übelkeit, Depression und Müdigkeit.Ein weiterer entscheidender Punkt, der bei der Festlegung der geeigneten Behandlungssequenz in diesem Krankheitsraum zu berücksichtigen ist, sind die damit verbundenen Kosten. Unter Verwendung von Modellen, die zusätzliche Behandlungslinien vor oder nach Docetaxel enthielten, betrugen die mittleren Kosten der mCRPC-Behandlung während eines mittleren Zeitraums von 28,1 Monaten ungefähr 48.000 USD pro Patient.29 Diese Kosten sind recht hoch, da Patienten möglicherweise mehrere Therapielinien erhalten und im Verlauf ihrer Krankheit fortlaufende medizinische Leistungen in Anspruch nehmen.30
Nur zwei Studien haben einen marginalen Überlebensvorteil für Patienten gezeigt, die auf LHRH-Analoga bleiben, anstatt Second- und Third-Line-Therapien hinzuzufügen.31, 32 Studien haben gezeigt, dass CRPC gegen ADT nicht resistent, sondern überempfindlich ist.10 Der behandlungsvermittelte Selektionsdruck während der ADT bewirkt, dass sich die AR verstärkt, und um sicherzustellen, dass die Situation nicht eskaliert, wird ADT weiterhin in der mCRPC-Einstellung verabreicht. Der behandlungsvermittelte Selektionsdruck setzt sich auch über die gesamte Lebensdauer des Tumors fort und verstärkt die Notwendigkeit, Therapien korrekt zu sequenzieren. Da jedoch prospektive Daten fehlen, überwiegt der winzige potenzielle Nutzen einer fortgesetzten Kastration immer noch das minimale Risiko dieser Behandlung. Darüber hinaus wurden alle anschließend zugelassenen Behandlungen bei Männern mit anhaltender ADT untersucht, was einen weiteren Grund für die Fortsetzung darstellt. Bevor wir uns mit den tatsächlich verfügbaren Behandlungsmöglichkeiten befassen, ist es wichtig zu erkennen, dass bei mCRPC-Patienten, die völlig asymptomatisch sind, noch unklar ist, wann mit der Therapie begonnen werden soll. Es ist noch nicht bekannt, ob eine frühere Behandlung überlegen ist oder ob wir warten sollten, bis der Patient symptomatisch wird und Schmerzen entwickelt. Vor Beginn der Behandlung sollten wir die bestehenden Komorbiditäten des Patienten und die erwarteten Nebenwirkungen des Therapiebeginns berücksichtigen. Patienten mit mCRPC im Frühstadium in der COU-AA-302-Studie, die Abirateron erhielten, überlebten typischerweise fast ein Jahr länger als diejenigen, die Placebo erhielten (medianes OS, 53,6 Monate vs. 41,8 Monate, HR, 0,61; 95% CI, 0,43 bis 0,87; P = .006).33 So profitierten mCRPC-Patienten im Frühstadium von einem früheren Beginn von Abirateron. In der gleichen Studie Patienten mit asymptomatischen oder leicht symptomatischen mCRPC, mit Baseline-PSA < 15,6 ng/ml Abirateron führte auch zu einer schnelleren Rate und ein höheres Maß an PSA-Rückgang als Placebo.34 Obwohl die derzeit verfügbaren Daten begrenzt sind, deuten sie höchstwahrscheinlich darauf hin, dass der Beginn der Behandlung eher früher als später vorteilhafter ist.33, 34
Zugelassene First-Line-Behandlungsoptionen für metastasierten kastratenresistenten Prostatakrebs
Abirateron
Abirateron ist ein Antiandrogen, das ein Inhibitor des Enzyms 17α-Hydroxylase / C17,20-Lyase (CYP17) ist. Die Phase-III-Studie COU-AA-302 untersuchte Abirateron bei 1.088 chemo-naïven, asymptomatischen oder leicht symptomatischen mCRPC-Patienten ohne viszerale Metastasen. In dieser Studie wurden die Patienten randomisiert Abirateronacetat oder Placebo, beide kombiniert mit Prednisone35 (Abbildung 1). Die Patienten wurden entweder nach dem Leistungsstatus 0 oder 1 der Eastern Cooperative Oncology Group (ECOG) und nach asymptomatischer oder leicht symptomatischer Erkrankung geschichtet.35 OS und radiologisches progressionsfreies Überleben (rPFS) waren die co-primären Endpunkte. Die Studie zeigte, dass nach einer medianen Nachbeobachtungszeit von 22, 2 Monaten eine signifikante Verbesserung des rPFS im Abirateron-Arm auftrat (Median 16, 5 vs. 8, 2 Monate, HR 0, 52, p < 0, 001). Bei der abschließenden Analyse nach einer medianen Nachbeobachtungszeit von 49,2 Monaten war der OS-Endpunkt signifikant positiv (34,7 vs. 30,3 Monate, HR: 0,81, 95% -KI: 0,70-0,93, p = 0,0033).36 Es ist wichtig, sich daran zu erinnern, dass mCRPC ein breites prognostisches Spektrum umfasst, auch wenn es Chemotherapie-naïv ist.37 In einer Analyse des Abirateron-Arms der COU-AA-302-Studie hatten Patienten, die zu Studienbeginn keine Schmerzen, normale alkalische Phosphatase- und LDH-Spiegel und weniger als 10 Knochenmetastasen aufwiesen, ein medianes OS von 42, 6 Monaten.37 Patienten mit mehr Risikofaktoren für eine Progression hatten jedoch ein signifikant kürzeres medianes OS.37 Bei der Beurteilung des Toxizitätsprofils von Abirateron schien es mehr unerwünschte Ereignisse im Zusammenhang mit einem Überschuss an Mineralocorticoiden und Leberfunktionsstörungen zu geben, aber diese waren meist Nebenwirkungen der Stufen 1-2. Schließlich wurde gezeigt, dass Abirateron auch bei älteren Menschen (> 75 Jahre) gleichermaßen wirksam ist.38
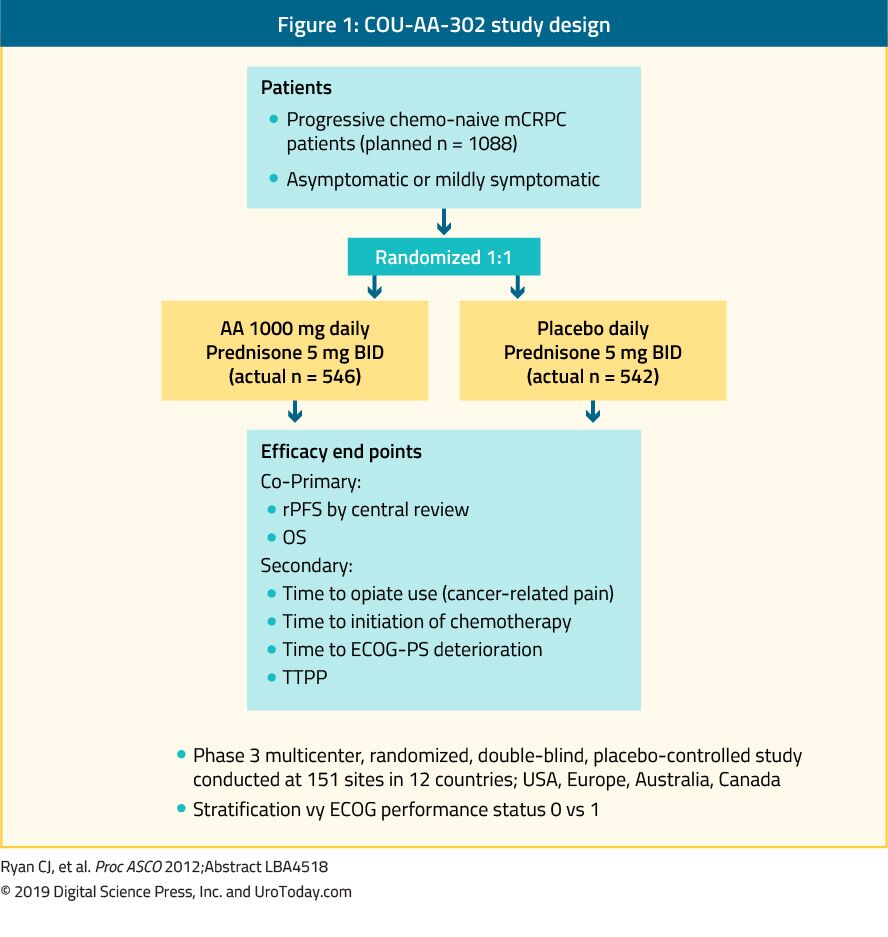
Abbildung 1. COU-AA-302 Studiendesign
Enzalutamid
Enzalutamid ist ein nichtsteroidales Antiandrogen. Die PREVAIL-Studie, eine randomisierte Phase-III-Studie, umfasste 1.717 chemo-naïve mCRPC-Patienten, und Patienten mit viszeralen Metastasen waren ebenfalls teilnahmeberechtigt.39 In dieser Studie wurde Enzalutamid mit Placebo verglichen (Abbildung 2). Die PREVAIL-Studie zeigte eine signifikante Verbesserung der mit Enzalutamid behandelten Patienten in beiden co-primären Endpunkten, einschließlich rPFS (HR: 0,186; CI: 0,15-0,23, p < 0,0001) und OS (HR: 0,706; CI: 0,6-0,84, p < 0,001). Ein erweitertes Follow-up und eine abschließende Analyse bestätigten einen Nutzen bei OS und rPFS für Enzalutamid.40 Bei 78% der mit Enzalutamid behandelten Patienten wurde eine PSA-Abnahme von mehr als 50% berichtet. Die häufigsten klinisch relevanten unerwünschten Ereignisse waren Müdigkeit und Bluthochdruck. Enzalutamid war auch bei älteren Männern (> 75 Jahre)41 und bei Männern mit oder ohne viszerale Metastasen gleichermaßen wirksam und gut verträglich.42 Für Männer mit Lebermetastasen schien es jedoch keinen erkennbaren Nutzen zu geben.43 Die TERRAIN-Studie verglich Enzalutamid in einer randomisierten doppelblinden Phase-II-Studie mit Bicalutamid, einem älteren Antiandrogen, und zeigte eine signifikante Verbesserung des PFS (15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
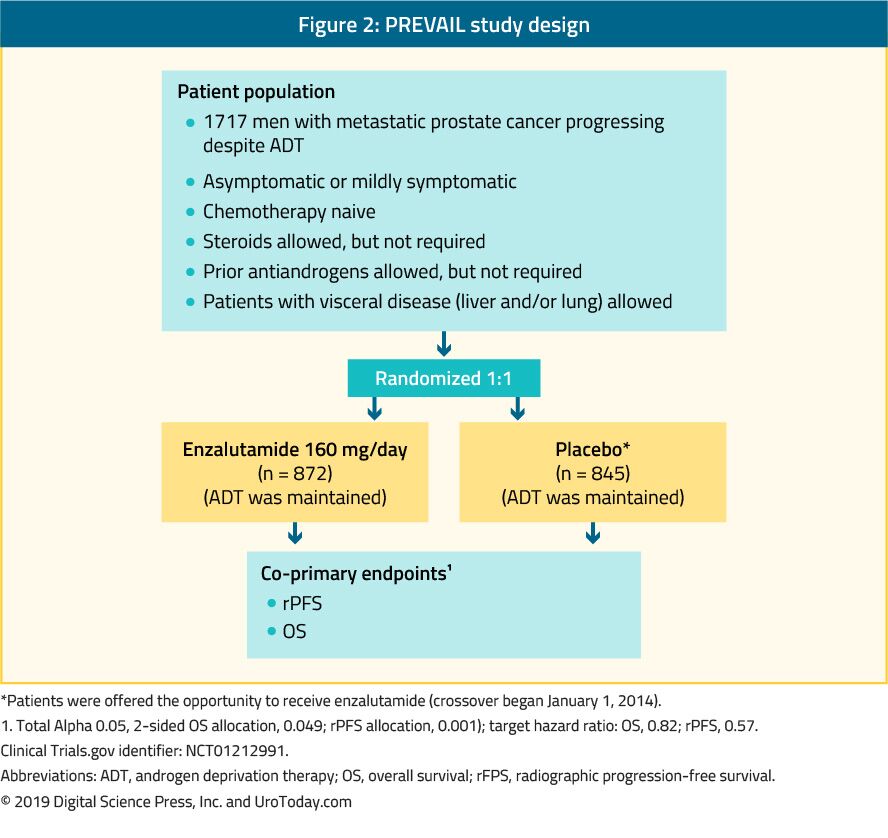
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). Die Standard-First-Line-Chemotherapie ist Docetaxel 75 mg/m2 in dreiwöchentlichen Dosen kombiniert mit Prednison 5 mg zweimal täglich, bis zu zehn Zyklen. Es gibt mehrere wichtige prognostische Faktoren, die bei der Verabreichung von Docetaxel zu berücksichtigen sind: viszerale Metastasen, Schmerzen, Anämie (Hb < 13 g/ dl), Knochenmarksprogression und vorherige Estramustin-Therapie. Diese prognostischen Faktoren können helfen, das Ansprechen auf Docetaxel zu stratifizieren. Unter Verwendung dieser prognostischen Faktoren kann die Krankheit in niedriges, mittleres und hohes Risiko eingeteilt werden, mit signifikant unterschiedlichen entsprechenden medianen OS-Schätzungen von 25.7, 18,7 und 12,8 Monate.45 Obwohl das Alter an sich keine Kontraindikation für eine Docetaxel-Therapie darstellt, müssen die Patienten fit genug sein, um diese Art der Behandlung zu ertragen, und Komorbiditäten sollten vor Beginn der Behandlung beurteilt werden. Bei Männern, von denen angenommen wird, dass sie die Standarddosis und das Standardschema von Docetaxel nicht vertragen, kann diese Dosis alle zwei Wochen von 75 mg / m2 auf 50 mg / m2 gesenkt werden, was weniger unerwünschte Ereignisse vom Grad 3-4 und eine längere Zeit bis zum Versagen der Behandlung zeigt.46
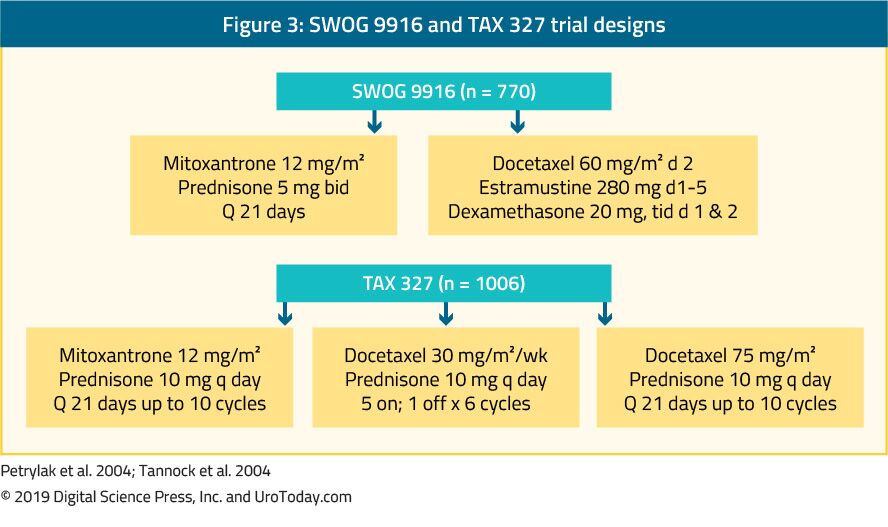
Abbildung 3. SWOG 9916- und TAX 327-Studiendesigns
Sipuleucel-T
Sipuleucel-T, eine autologe aktive zelluläre Immuntherapie, zeigte in einer Phase-III-Studie (IMPACT-Studie) einen Überlebensvorteil bei 512 asymptomatischen oder minimal symptomatischen mCRPC-Patienten im Vergleich zu placebo24 (Abbildung 4). Nach einer medianen Nachbeobachtungszeit von 34 Monaten war das mediane Überleben in der Sipuleucel-T-Gruppe signifikant höher (25, 8 vs. 21, 7 Monate mit einer HR von 0, 78, p = 0, 03).24 Wichtig ist, dass während oder nach der Behandlung kein PSA-Rückgang beobachtet wurde und das PFS in beiden Armen ähnlich war. Die Gesamttoleranz gegenüber Sipuleucel-T war sehr gut, wobei meist unerwünschte Ereignisse vom Grad 1-2 auftraten. Derzeit ist diese Behandlung nur in den USA und nicht mehr in Europa verfügbar.
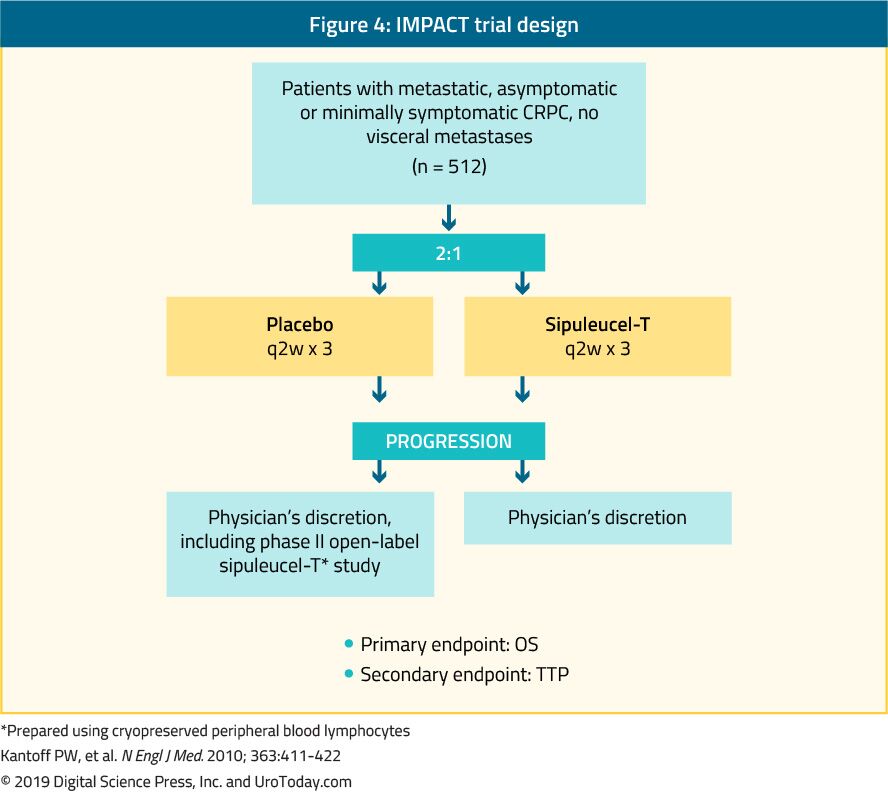
Abbildung 4. IMPACT Trial Design
Schlussfolgerungen
In den letzten 15 Jahren gab es erhebliche wissenschaftliche Fortschritte und Investitionen in die Arzneimittelentwicklung für Patienten mit mCRPC. Dies hat zur FDA-Zulassung mehrerer Linien systemischer Therapien aus Gründen der Schmerzlinderung, der Minimierung von Nebenwirkungen und der Verlängerung des OS geführt. Bis heute ist der gemeldete Einfluss auf das OS bei mCRPC-Patienten von jedem dieser einzelnen Agenten ist immer noch bescheiden, was zu einer Hinzufügung von nur wenigen Monaten führt. Es ist notwendig, unser Verständnis der Krankheitsbiologie von mCRPC zu verbessern, ein umfassendes molekulares Verständnis der Kastrationsresistenz zu integrieren und Mechanismen der Resistenz gegen aktuelle Therapien zu analysieren, um die zukünftige Behandlungsentwicklung zu verbessern. Es ist auch wichtig, prädiktive Biomarker zu investieren und zu entwickeln, um die Personalisierung der Therapie zu unterstützen. Zu guter Letzt werden weitere Daten zu den geeigneten Second- und Third-Line-Therapien sowie zur Sequenzierung und Kombination der verfügbaren Medikamente benötigt, die im nächsten Übersichtsartikel („Beyond first line treatment of metastatic castrate-resistant prostate cancer“) ausführlicher erörtert werden.
Veröffentlichungsdatum: 19.November 2019
Leave a Reply