Explainer: Was ist ein Isotop?
Wenn Sie jemals ein Periodensystem der Elemente studiert haben (siehe unten), wissen Sie wahrscheinlich bereits, dass diese Tabelle viel über die chemischen Eigenschaften der Atome verrät, aus denen unsere Welt besteht.
Aber Sie wissen vielleicht nicht, dass jedes Quadrat im Periodensystem tatsächlich eine Familie von Isotopen darstellt — Atome, die denselben Namen und dieselben chemischen Eigenschaften haben, aber unterschiedliche Massen haben.
Um zu verstehen, was Isotope sind und wie wir sie verwenden können, müssen wir uns das Innere eines Atoms genauer ansehen.
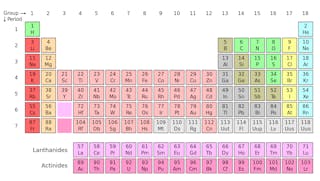
Bausteine der Materie
Ein Atom besteht aus einem unglaublich dichten Kern (Kern genannt) aus Protonen und Neutronen, umgeben von einer diffusen Elektronenwolke.Man kann sich Protonen und Neutronen als die gleiche Art von Teilchen vorstellen, mit einem entscheidenden Unterschied: Die Protonen sind positiv geladen, während Neutronen keine Ladung tragen. Dies bedeutet, dass Protonen elektrische oder magnetische Felder „fühlen“ können, während Neutronen dies nicht können.Die Elektronen, die viel leichter als Protonen oder Neutronen sind, tragen die gleiche Ladungsgröße wie ein Proton, jedoch mit dem entgegengesetzten Vorzeichen, was bedeutet, dass jedes Atom mit der gleichen Anzahl von Protonen und Elektronen elektrisch neutral ist.
Es sind die Elektronen, die das chemische Verhalten eines bestimmten Elements bestimmen.

Isotope eines Elements haben die gleiche Anzahl von Protonen, aber eine unterschiedliche Anzahl von Neutronen. Nehmen wir Kohlenstoff als Beispiel.Es gibt drei Isotope von Kohlenstoff in der Natur – Kohlenstoff-12, Kohlenstoff-13 und Kohlenstoff-14. Alle drei haben sechs Protonen, aber ihre Neutronenzahlen – 6, 7 und 8 – unterscheiden sich alle. Dies bedeutet, dass alle drei Isotope unterschiedliche Atommassen haben (Kohlenstoff-14 ist das schwerste), aber die gleiche Ordnungszahl haben (Z = 6).Chemisch sind alle drei nicht zu unterscheiden, da die Anzahl der Elektronen in jedem dieser drei Isotope gleich ist.
Verschiedene Isotope desselben Elements sind also chemisch identisch. Einige Isotope können diese Regel jedoch umgehen, indem sie sich vollständig in ein anderes Element umwandeln.
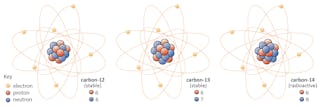
Marching towards stability
Diese transformative Fähigkeit, die einige Isotope haben, hat mit der Tatsache zu tun, dass nicht alle Isotope stabil sind, und ist es, was Frederick Soddy zu seiner Nobelpreisträgerentdeckung von Isotopen im Jahr 1913 führte.Einige Isotope – wie Kohlenstoff-12 – werden glücklich weiterhin als Kohlenstoff existieren, es sei denn, etwas Außergewöhnliches passiert. Andere – sagen wir Kohlenstoff-14 – zerfallen irgendwann in ein stabiles Isotop in der Nähe.
In diesem Fall verwandelt sich eines der Neutronen in Kohlenstoff-14 in ein Proton und bildet Stickstoff-14. Während dieses Prozesses, der als Beta-Zerfall bekannt ist, emittiert der Kern Strahlung in Form eines Elektrons und eines Antineutrinos.
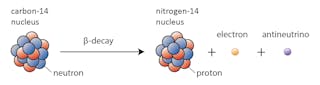
Es gibt viele Faktoren, die dazu führen können, dass ein Kern zerfällt. Eines der wichtigsten ist das Verhältnis von Protonen zu Neutronen, das ein bestimmter Kern hat. Wenn ein Kern zu viele Neutronen hat (die Definition von „zu viele“ hängt davon ab, wie schwer der Kern ist), besteht die Möglichkeit, dass er in Richtung Stabilität zerfällt.
Das gleiche gilt, wenn ein Kern zu viele Protonen hat. Dies ist einer der Gründe, warum einige Isotope eines bestimmten Elements radioaktiv sind, andere nicht.
Aus den Bäuchen der Sterne
Inzwischen fragen Sie sich vielleicht, wie all diese Isotope überhaupt entstanden sind. Wie sich herausstellt, ist diese Frage komplex, aber verleiht dem Sprichwort, dass wir alle aus Sternenstaub bestehen, etwas Wahrheit.
Einige der leichteren Isotope entstanden sehr früh in der Geschichte des Universums, während des Urknalls. Andere resultieren aus Prozessen, die innerhalb von Sternen oder als Folge zufälliger Kollisionen zwischen hochenergetischen Kernen – bekannt als kosmische Strahlung – in unserer Atmosphäre ablaufen.Die meisten natürlich vorkommenden Isotope sind das endgültige (stabile oder langlebige) Produkt, das aus einer langen Reihe von Kernreaktionen und Zerfällen resultiert.In den meisten dieser Fälle mussten leichte Kerne mit genügend Energie zusammenbrechen, damit die starke Kraft – eine klebstoffartige Bindung, die entsteht, wenn Protonen und Neutronen sich nahe genug berühren – die elektromagnetische Kraft überwinden konnte – die Protonen auseinander drückt. Wenn die starke Kraft siegt, binden sich die kollidierenden Kerne zusammen oder verschmelzen zu einem schwereren Kern.
Unsere Sonne ist ein gutes Beispiel dafür. Eine seiner Hauptstromquellen ist eine Reihe von Fusionsreaktionen und Beta-Zerfallsprozessen, die Wasserstoff in Helium umwandeln.

Transforming knowledge into tools
Seit den frühen 1900er Jahren, als die Existenz von Isotopen erstmals erkannt wurde, haben Kernphysiker und Chemiker nach Wegen gesucht, um zu untersuchen, wie Isotope gebildet werden können, wie sie zerfallen und wie wir sie verwenden könnten.Wie sich herausstellt, macht die Natur der Isotope – ihre chemische Einheitlichkeit, ihre nukleare Besonderheit – sie für eine breite Palette von Anwendungen in so unterschiedlichen Bereichen wie Medizin, Archäologie, Landwirtschaft, Energieerzeugung und Bergbau nützlich.
Wenn Sie jemals einen PET-Scan hatten, haben Sie von einem Nebenprodukt des radioaktiven Zerfalls bestimmter Isotope (oft als medizinische Isotope bezeichnet) profitiert. Wir produzieren diese medizinischen Isotope mit unserem Wissen darüber, wie Kernreaktionen ablaufen, mit Hilfe von Kernreaktoren oder Beschleunigern, die Zyklotrone genannt werden.
Wir haben aber auch Wege gefunden, natürlich vorkommende radioaktive Isotope zu nutzen. Kohlenstoff Dating, zum Beispiel, nutzt das langlebige Isotop Kohlenstoff-14, um zu bestimmen, wie alt Objekte sind. Unter normalen Umständen wird Kohlenstoff-14 in unserer Atmosphäre durch kosmische Strahlungsreaktionen mit Stickstoff-14 erzeugt. Es hat eine Halbwertszeit von ungefähr 5.700 Jahren, was bedeutet, dass die Hälfte einer Menge Kohlenstoff-14 in diesem Zeitraum abgeklungen ist.

Während ein biologischer Organismus lebt, nimmt er ungefähr ein Kohlenstoff-14-Isotop für jede Billion stabiler Kohlenstoff-12-Isotope auf und das Verhältnis von Kohlenstoff-12 zu Kohlenstoff-14 bleibt ungefähr gleich, während der Organismus lebt. Sobald es stirbt, stoppt die neue Aufnahme von Kohlenstoff. Dies bedeutet, dass sich das Verhältnis von Kohlenstoff-14 zu Kohlenstoff-12 in den Überresten dieses Organismus im Laufe der Zeit ändert.
Wenn wir Kohlenstoff mit chemischen Methoden aus einer Probe extrahieren, können wir dann eine Methode namens Beschleuniger-Massenspektrometrie (AMS) anwenden, um die einzelnen Kohlenstoffisotope nach Gewicht zu trennen.
AMS macht sich die Tatsache zunutze, dass beschleunigte Teilchen mit gleicher Ladung, aber unterschiedlichen Massen getrennten Wegen durch Magnetfelder folgen. Durch die Verwendung dieser getrennten Pfade, Wir können Isotopenverhältnisse mit unglaublicher Genauigkeit bestimmen.
Wie Sie an diesen Beispielen sehen können, wenden wir unser Wissen über Isotope auf verschiedene Arten an. Wir produzieren sie, entdecken sie, extrahieren sie und studieren sie mit dem doppelten Zweck zu verstehen, warum sich der Atomkern so verhält und wie wir seine Kraft zu unserem Vorteil nutzen können.
Leave a Reply