Epigenetik – Es sind nicht nur Gene, die uns machen
Was ist Epigenetik?Eine andere Art, die Epigenetik zu betrachten, ist wie folgt: Während die traditionelle Genetik die Art und Weise beschreibt, wie die DNA-Sequenzen in unseren Genen von einer Generation zur nächsten weitergegeben werden, beschreibt die Epigenetik die Weitergabe der Art und Weise, wie die Gene verwendet werden. Um eine Computeranalogie zu erstellen, stellen Sie sich Epigenetik als Metadaten vor, Informationen, die die zugrunde liegenden Daten beschreiben und ordnen. Wenn Sie beispielsweise einen MP3-Player besitzen, enthält dieser viele Daten, die MP3-Dateien. Betrachten Sie diese als analog zu Genen. Aber Sie werden wahrscheinlich auch Wiedergabelisten haben oder Titel nach Künstler oder Genre abspielen. Diese Informationen, Playlist, Künstler, Genre usw. sind Metadaten. Es bestimmt, welche Tracks in welcher Reihenfolge abgespielt werden, und das ist es, was Epigenetik für die Genetik ist. Es ist eine Reihe von Prozessen, die beeinflussen, welche Gene eingeschaltet oder „exprimiert“ werden, wie Molekularbiologen sagen würden.
Wie funktioniert Epigenetik? Bei der Epigenetik geht es also eher darum, wie Gene exprimiert und verwendet werden, als um die DNA-Sequenz der Gene selbst, aber wie funktioniert das? Viele Forscher haben Epigenetik in den letzten Jahrzehnten studiert, und sie ist z.Z. ein Bereich der intensiven Forschungstätigkeit. Wir wissen, dass ein Teil der Funktionsweise der Epigenetik darin besteht, kleine chemische Markierungen zur DNA hinzuzufügen und zu entfernen. Sie können sich diese Tags als Post-It-Notizen vorstellen, die bestimmte Gene mit Informationen darüber hervorheben, ob sie ein- oder ausgeschaltet werden sollten. Tatsächlich wird das fragliche chemische Tag als Methylgruppe bezeichnet (siehe Diagramm 1) und es wird verwendet, um eine der vier Basen oder „chemischen Buchstaben“ A, C, T und G zu modifizieren, aus denen der genetische Code unserer DNA besteht. Der Buchstabe, der markiert ist, ist C oder Cytosin und wenn er modifiziert oder methyliert wird, heißt er 5-Methylcytosin. Methylgruppen werden DNA durch Enzyme hinzugefügt, die DNA-Methyltransferasen (DNMTs) genannt werden.
-
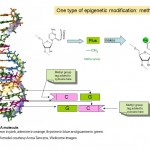
Diagramm 1. Zwei chemische Tags, Methyl- und Acetylgruppen, die für epigenetische Phänomene und die chemische Struktur von Cytosin und 5-Methylcytosin in der DNA von zentraler Bedeutung sind. Der fünfeckige Teil des Moleküls bildet das kontinuierliche „Rückgrat“ der DNA . Nur einer der beiden DNA-Stränge, aus denen die bekannte Doppelhelix besteht, wird gezeigt.
Der Status der Bienenkönigin wird teilweise durch weniger methylierte Tags bestimmt
In den meisten Fällen führt mehr methyliertes Cs in der DNA eines Gens dazu, dass das Gen ausgeschaltet wird. Honigbienen liefern uns ein gutes Beispiel dafür, wie das funktionieren kann. Arbeiterbienen und die Königin haben sehr unterschiedliche Körper; Die Königin ist viel größer, länger gelebt, hat einen vergrößerten Bauch und legt viele tausend Eier, während die kleineren Arbeiter steril sind, aber komplexe Nahrungssuche und Kommunikationsfähigkeiten haben. Trotzdem sind die Königin und die Arbeiter in einem Bienenstock weiblich und genetisch identisch. Der Hinweis darauf, wie dies zustande kommt, liegt in Gelee Royale, einem Sekret, das einigen sich entwickelnden Larven zugeführt wird und dazu führt, dass diese Larven eher Königinnen als Arbeiter werden. Wir werden später auf Gelee Royale und seine königinnenbildenden Eigenschaften zurückkommen, aber eine faszinierende Studie zeigte, dass, wenn die Menge der Methylgruppe, die das DNMT-Enzym hinzufügt, in Bienenlarven künstlich reduziert wurde, sich die Larven zu Königinnen entwickelten, auch wenn sie nicht gefüttert wurden Gelee Royale. So kann der Schalter zwischen Königin und Arbeiter durch die Fülle von Methyl-Tags auf der DNA der Bienenlarven umgedreht werden. Weniger Methyl-Tags führen zum Einschalten eines speziellen Gens oder von Genen in den sich entwickelnden Larven, was zur Entwicklung der Larven zu Königinnen und nicht zu Arbeitern führt.
Tags an Schwänzen bedienen auch Genschalter
DNA-Methyl-Tags sind jedoch nur ein Teil der Geschichte. In den Zellen aller Pflanzen und Tiere wird DNA in Nukleosomen verpackt oder eingewickelt, wobei die DNA-Doppelhelix um einen zentralen Proteinkern gewickelt ist (siehe Abbildung 2). Etwa 150 Buchstaben DNA (oder Basenpaare) sind um jedes Nukleosom gewickelt, und dies hilft, die 3 Milliarden Basenpaare des genetischen Codes in jede unserer Zellen zu verpacken. Nukleosomen sind zu klein, um sie mit herkömmlichen Mikroskopen zu sehen, aber Biologen verwenden eine Technik namens Röntgenbeugung, um die Form und Organisation von Objekten wie Nukleosomen zu bestimmen, und 1997 enthüllte diese Technik die schöne Struktur von Nukleosomen bei hoher Auflösung – siehe (http://www.rcsb.org/pdb/explore/explore.do?structureId=1aoi).
-
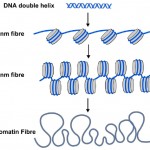
Diagramm 2. Die bekannte DNA-Doppelhelix (blau) ist in Zellen um Nukleosomen (graue Zylinder) gewickelt. Die Kette der Nukleosomen kann zu einem dickeren Filament aufgewickelt werden, das als 30-nm-Faser bezeichnet wird, und dies kann weiter zu einer noch dickeren Chromatinfaser aufgewickelt werden. Wenn Gene eingeschaltet werden, sind ihre Nukleosomen wie die 10-nm-Faser ungewickelt.
Nukleosomen sind kompakt, aber die Enden oder „Schwänze“ der Proteine, aus denen das Nukleosom besteht, die Histone genannt werden, ragen aus der ansonsten kompakten Nukleosomenstruktur heraus. Wie die Methyl-Tags auf DNA können auch kleine chemische Tags zu diesen Histonschwänzen hinzugefügt werden (siehe Diagramm 3). Zwei der chemischen Tags, die diesen Schwänzen hinzugefügt werden, sind Acetylgruppen und Methylgruppen. Methyl, Acetyl und einige andere Arten von Tags können den Schwänzen in einer großen Anzahl von Kombinationen hinzugefügt werden, und dies wirkt sich darauf aus, ob ein zugrunde liegendes Gen ein- oder ausgeschaltet wird. Tatsächlich können Gene durch DNA-Methyl-Tags und Histon-Tail-Tags direkt ausgeschaltet (dies wird als Stummschaltung bezeichnet), voll eingeschaltet oder irgendwo dazwischen geschaltet werden. Die Kombination von DNA- und Histon-Tags kann auch beeinflussen, wie leicht ein Gen ein- oder ausgeschaltet wird.
-
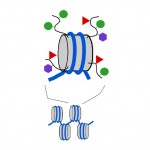
Diagramm 3. Chemische Markierungen können den „Schwänzen“ der Histonproteine, aus denen Nukleosomen bestehen, hinzugefügt werden. Grauer Zylinder, Nukleosom; gekrümmte schwarze Linien, Histonschwänze; grüne Kreise, Methyl-Tags; rote Dreiecke, Acetyl-Tags; lila Sechsecke, andere Arten von Tags.
Wenn sich Zellen teilen
Wenn sich Zellen teilen, wird die gesamte DNA-Sequenz aus der ursprünglichen Zelle (3 Milliarden Basenpaare, die in 23 Chromosomenpaaren in einer menschlichen Zelle enthalten sind) dupliziert, so dass beide Tochterzellen eine exakte Kopie erhalten. Was, könnten Sie fragen, passiert mit all diesen epigenetischen Tags? Wir wissen seit einiger Zeit, dass auch die DNA-Methyl-Tags kopiert werden, so dass beide Tochterzellen das gleiche Muster der DNA-Methylierung aufweisen. Wir wissen jetzt, dass das Muster der Histon-Tags auch meistens dupliziert wird, wenn sich Zellen teilen, obwohl dies derzeit weniger gut verstanden wird. Dennoch ist die Zellteilung auch eine Zeit, in der epigenetische Tags am einfachsten verändert werden können.
Rückkehr des langlebigen Wurms
Gleich zu Beginn stießen wir auf die Geschichte der langlebigen mikroskopischen Würmer, die ihre Langlebigkeit an ihre Nachkommen weitergaben, auch wenn die einzelnen Nachkommen nicht das Variantengen (Mutation) erbten, das ursprünglich die verlängerte Lebensdauer verursachte. Wir sind jetzt in der Lage, dieses scheinbar seltsame Ergebnis zu erklären. In den meisten Fällen enthalten Gene die Informationen, um ein Proteinmolekül zu bilden, und die Proteinmoleküle können Enzyme sein, die chemische Reaktionen in der Zelle oder Teile der Struktur der Zelle selbst durchführen. Es stellt sich heraus, dass die Gene, die in der Wurmstudie mutiert wurden, Proteine bilden, die zusammenarbeiten, um Nukleosomen ein Methyl-Tag hinzuzufügen. Dieses Tag ist ein Ein-Schalter. Wenn eines oder mehrere der Gene mutiert waren, fehlte dieses Tag und mehrere Gene, die eingeschaltet sein sollten, einschließlich einiger, die am Altern beteiligt waren, wurden ausgeschaltet und die Würmer hatten eine längere Lebensdauer. Das Unerwartete ist, dass die epigenetischen Tags während der Bildung von Spermien und Eizellen vollständig gelöscht oder zurückgesetzt wurden und daher im Gegensatz zu den Genen selbst nicht an die nächste Generation weitergegeben werden sollten. Aber dieses Ergebnis und andere Untersuchungen zeigen, dass dies nicht immer der Fall ist und dass manchmal das Muster epigenetischer Tags weitergegeben wird.
Wie man eine Königin macht
Ob eine larvale Honigbiene eine Arbeiterin oder eine Königin wird, hängt von einem epigenetischen Schalter ab, und dieser Schalter scheint von Royal Jelly „umgedreht“ zu werden. Aber was ist mit Gelee Royale, das eine Larve, die sonst zur Arbeiterin heranwachsen würde, zur Königin führt? Die Antwort liegt im Verständnis, dass die einzelnen chemischen Markierungen, die den Histonschwänzen von Nukleosomen hinzugefügt werden, ständig von der Zelle überarbeitet werden. Acetyl-Tags werden durch Enzyme hinzugefügt, die als Histonacetyltransferasen bezeichnet werden, und sie werden durch eine zweite Gruppe von Enzymen, die als Histondeacetylasen (HDACs) bezeichnet werden, entfernt oder gelöscht. Beide Enzyme sind in den meisten Zellen vorhanden und dies ermöglicht es, Gene im Laufe der Zeit ein- oder auszuschalten.
Mehr Acetyl-Tags helfen, den Status der Bienenkönigin zu liefern
Kürzlich machten sich Forscher daran, Verbindungen in Gelee Royale zu identifizieren, die diesen Prozess verändern könnten, und was sie fanden, war etwas, das als HDAC-Inhibitor bekannt ist. Dies war eine relativ einfache chemische Verbindung, die in Gelee Royale vorhanden ist und die die Wirkung von HDAC-Enzymen stoppt, die normalerweise Acetyl-Tags aus Histonen entfernen. Dies führt zu einem Aufbau von Acetyl-Tags in den Zellen der Bienenembryonen, und wie die zuvor beschriebene Reduktion der DNA-Methylgruppen wird angenommen, dass dies Schlüsselgene einschaltet, die für die Entwicklung einer Königin erforderlich sind. Ohne den HDAC-Inhibitor im Gelee Royale folgen die Larven einem „Standard“ -Satz genetischer Anweisungen und entwickeln sich zu Arbeitern.HDAC-Inhibitoren sind nicht nur für Bienenköniginnen wichtig, sondern auch Teil einer kleinen, aber wachsenden Anzahl medizinisch nützlicher Medikamente, die auf epigenetische Tags abzielen und bei der Behandlung einiger Krebsarten nützlich sind. Darüber hinaus spielen HDACs auch eine Rolle bei der Art und Weise, wie unser Gehirn Erinnerungen bildet, und neuartige Medikamente, die die Histonacetylierung beeinflussen, könnten in Zukunft eine Rolle bei der Behandlung von Gedächtnisstörungen bei älteren Patienten spielen.
Die Umwelt und Epigenetik
Wir haben gesehen, wie der Unterschied zwischen einer Königin und einer Arbeiterbiene durch die Exposition gegenüber einer Chemikalie bestimmt wird, die epigenetische Tags wie Acetylgruppen direkt verändert; Aber gibt es Beispiele, bei denen Ernährung oder andere Aspekte der Umwelt die menschliche Bevölkerung auf eine Weise beeinflussen, die durch Epigenetik erklärt werden kann? Natürlich können wir keine Experimente an menschlichen Populationen wie an mikroskopisch kleinen Würmern oder Bienen durchführen, aber manchmal tun es die menschliche Geschichte oder Naturphänomene für uns. Ein solches Beispiel ist der sogenannte niederländische Hungerwinter. Im letzten Jahr des Zweiten Weltkriegs in Europa führte ein Lebensmittelembargo der deutschen Besatzungstruppen gegen die Zivilbevölkerung der Niederlande zu einer schweren Hungersnot, die mit einem besonders harten Winter zusammenfiel. Etwa 20.000 Menschen starben an Hunger, als die Rationen auf unter 1000 Kilokalorien pro Tag fielen. Trotz des Kriegschaos blieben die medizinische Versorgung und die Aufzeichnungen intakt, so dass Wissenschaftler die Auswirkungen der Hungersnot auf die menschliche Gesundheit untersuchen konnten. Was sie fanden, war, dass Kinder, die während der Hungersnot im Mutterleib waren, eine lebenslange Zunahme ihrer Chancen hatten, verschiedene Gesundheitsprobleme zu entwickeln, verglichen mit Kindern, die nach der Hungersnot gezeugt wurden. Die empfindlichste Zeit für diesen Effekt waren die ersten Monate der Schwangerschaft. So scheint etwas früh in der Entwicklung im Mutterleib zu passieren, das den Einzelnen für den Rest seines Lebens beeinflussen kann.
Epigenetische Effekte können manchmal auf Enkelkinder übergehen
Noch überraschender ist, dass einige Daten darauf hindeuten, dass Enkelkinder von Frauen, die während des Hungerwinters schwanger waren, einige dieser Effekte erfahren. Nach dem, was wir bereits besprochen haben, deutet dies stark auf einen epigenetischen Mechanismus hin. Tatsächlich geht die Forschung mit den niederländischen Hungerwinterfamilien weiter, und eine kürzlich durchgeführte Studie, die sich mit einem Gen befasste, das IGF2 gallte, fand bei Personen, die der Hungersnot vor der Geburt ausgesetzt waren, niedrigere Spiegel des Methyl-Tags in der DNA dieses Gens. Obwohl IGF2 selbst möglicherweise nicht an dem erhöhten Risiko für eine schlechte Gesundheit bei diesen Menschen beteiligt ist, zeigt es, dass epigenetische Effekte (d. H. Verringerung der Anzahl von Methyl-Tags auf bestimmte Gene), die vor der Geburt produziert werden, viele Jahrzehnte anhalten können. Studien an Tieren haben auch gezeigt, dass die Ernährung der Mutter Auswirkungen auf ihre Nachkommen haben kann. Zum Beispiel führt die Fütterung von Schafen mit einer Diät, bei der die Arten von Nahrungsmitteln fehlen, die zur Herstellung von Methylgruppen erforderlich sind, zu Nachkommen mit veränderten Mustern der DNA-Methylierung, die höhere als erwartete Raten bestimmter Gesundheitsprobleme aufweisen.
Epigenetik und Prägung, warum Gene von Mama und Papa nicht immer gleichwertig sind
Wir alle haben 23 Chromosomenpaare in unseren Zellen. Für jedes Paar kam eines von der Mutter und eines vom Vater. Daher erben wir von jedem Elternteil eine Kopie jedes Gens und gehen im Allgemeinen davon aus, dass die Funktion des Gens nicht davon abhängt, von welchem Elternteil es stammt. Bei eingeprägten Genen sieht es jedoch anders aus. Für diese Gene ist entweder die mütterliche oder die väterliche Kopie des Gens aktiv, während die andere schweigt. Es gibt mindestens 80 eingeprägte Gene in Menschen und Mäusen, von denen viele am Wachstum des Embryos oder der Plazenta beteiligt sind. Wie kann eine Kopie eines Gens ausgeschaltet werden, während die andere Kopie in derselben Zelle eingeschaltet wird? Die Antwort ist Epigenetik. Das wahrscheinlich am meisten untersuchte imprintierte Gen ist IGF2 (siehe oben). Ein Teil von IGF2 arbeitet als Schalter. Wenn die DNA hier methyliert wird, kann das IGF2-Gen exprimiert werden. Der Schalter ist nur in Papas Kopie des Gens methyliert und so wird nur diese Kopie exprimiert, während die mütterliche Kopie still ist. Es wird angenommen, dass dieser Schalter in den Gameten (Eizellen und Spermien) eingerichtet ist, so dass von Anfang an Gene, die von Mama und Papa erhalten wurden, unterschiedlich mit epigenetischen Tags markiert sind und daher nicht gleichwertig sind.
Prägung und psychische Störungen
Das Angelmann- und das Prader-Willi-Syndrom sind zwei verschiedene genetische Erkrankungen mit unterschiedlichen Symptomen, die beide durch den Verlust eines Teils von Chromosom 15 verursacht werden. Kinder, die eine Kopie dieses fehlerhaften Chromosoms erben, entwickeln entweder das Angelmann- oder das Prader-Willi-Syndrom, obwohl sie eine normale Kopie des Chromosoms von ihrem anderen Elternteil haben. Wie führt also dieselbe Mutation (Verlust eines Teils von Chromosom 15) zu diesen beiden unterschiedlichen Zuständen? Die Antwort liegt in der Entdeckung, dass dieses bestimmte Stück Chromosom 15 eine Reihe von Genen enthält, die eingeprägt sind, so dass nur die väterliche oder mütterliche Kopie dieses Gens exprimiert wird; Welches der beiden Syndrome auftritt, hängt davon ab, ob die Deletion im mütterlichen oder väterlich vererbten Chromosom erfolgte. Wenn das fehlerhafte Chromosom vom Vater geerbt wird, gibt es keine funktionelle Kopie der eingeprägten Gene, die auf dem mütterlichen Chromosom 15 ausgeschaltet sind, und das Ergebnis ist das Angelmann-Syndrom und umgekehrt für das Prader-Willi-Syndrom. Dies ist ganz anders als bei den meisten genetischen Erkrankungen wie Mukoviszidose, bei denen ein Effekt auf die Entwicklung oder Gesundheit nur dann zu sehen ist, wenn ein mutiertes Gen oder Gene von beiden Elternteilen geerbt werden.
Jungen gegen Mädchen, wie ein ganzes Chromosom auszuschalten
Ein bisschen Genetik, die die meisten von uns kennen, ist das, was ein Junge ein Junge macht, und ein Mädchen ein Mädchen. Es sind die X- und Y-Chromosomen. Zu Beginn unserer Existenz erhielt jeder von uns ein X-Chromosom von unseren Müttern über das Ei, und während die Mädchen ein weiteres X-Chromosom von ihren Vätern über das Sperma erhielten, erhielten die Jungen ein Y-Chromosom. Das Y-Chromosom in den Zellen eines männlichen Embryos veranlasst ihn, sich zu einem Jungen zu entwickeln, während sich der weibliche Embryo mit zwei X- und keinem Y-Chromosom zu einem Mädchen entwickelt. Nun könnten Sie feststellen, dass hier ein Ungleichgewicht besteht. Wir alle haben zwei von allen anderen Chromosomen, aber für die Geschlechtschromosomen (X und Y) haben die Mädchen zwei Xs, während die Jungen nur ein X (und ein Y) haben. Während das Y-Chromosom nur wenige Gene enthält, die hauptsächlich an der „Männlichkeit“ beteiligt sind, enthält das X-Chromosom einige Gene, die an wichtigen Prozessen wie Farbsehen, Blutgerinnung und Muskelfunktion beteiligt sind. Um die „Dosierung“ von X-Chromosom-Genen zwischen männlichen und weiblichen Zellen auszugleichen, wird in weiblichen Zellen ein ganzes X-Chromosom ausgeschaltet. Dies wird als X-Chromosomeninaktivierung bezeichnet und geschieht sehr früh im Mutterleib. In diesem Prozess schalten Zellen zufällig entweder das väterliche oder mütterliche X-Chromosom aus, so dass, wenn ein Mädchenbaby geboren wird, ihr Körper eine Mischung oder Chimäre von Zellen ist, in denen entweder das mütterliche oder väterliche X-Chromosom ausgeschaltet ist. Die Art und Weise, wie dies geschieht, beinhaltet die Art der epigenetischen Tags, die wir besprochen haben, und es ist seit Jahrzehnten bekannt, dass weibliche Zellen ein sehr kompaktes X-Chromosom enthalten, das als Barr-Körper bezeichnet wird und unter dem Mikroskop zu sehen ist inaktives X-Chromosom.
Der Fall der Schildpattkatze
Wir kennen wahrscheinlich alle Schildpattkatzen und ihre fleckigen Mäntel mit orangefarbenen und schwarzen Fellflecken. Was Sie vielleicht nicht wissen, ist, dass fast alle Katzen mit dieser Art von Fell weiblich sind! Der Grund dafür ist, dass sich auf dem X-Chromosom der Katze ein Gen für die Fellfarbe befindet. Es gibt zwei Versionen dieses Gens, genannt „O“ und „o“; man gibt Ingwer Fell und das andere schwarz. Zwei Kopien derselben Version bei einer weiblichen Katze führen zu Ingwer bzw. schwarzem Fell, aber eine Kopie von jedem ergibt einen Schildpatt-Effekt. Dies liegt an der Inaktivierung des X-Chromosoms. Die Haut dieser Katzen besteht aus Zellflecken, in denen entweder das mütterliche oder das väterliche X-Chromosom inaktiviert ist. Dies führt zu einer Haut mit eingeschaltetem O-Gen und o-Stummschaltung in einigen Flecken (orangefarbenes Fell) und O-Gen und O-Stummschaltung in anderen Flecken (schwarzes Fell), daher das Schildpattmuster. Da die männlichen Katzen nur ein X-Chromosom und keine X-Chromosom-Inaktivierung haben, sind sie entweder orange oder schwarz.
Epigenetische Vererbung, können epigenetische Zustände von einer Generation zur nächsten weitergegeben werden?Wie wir am Beispiel des Spulwurms gesehen haben, können epigenetische Effekte (in diesem Fall eine verlängerte Lebensdauer) manchmal von einer Generation zur nächsten weitergegeben werden, obwohl die Effekte nur einige Generationen andauern. Gibt es Beispiele, bei denen epigenetische Effekte auf nachfolgende Generationen beim Menschen oder anderen Säugetieren übertragen werden? Es gibt Hinweise darauf, dass die Auswirkungen des niederländischen Hungerwinters Millionen von Frauen betrafen, die während der Hungersnot schwanger waren. In ähnlicher Weise scheint in einer Studie über eine nordschwedische Bevölkerung des 19.Jahrhunderts, die Zyklen von Hunger und Überfluss durchlief, die Menge der verfügbaren Nahrung die Gesundheit und Langlebigkeit der nächsten Generation beeinflusst zu haben.
Die Haarfarbe in der Maus kann durch einen epigenetischen Effekt bestimmt werden
Das vielleicht bekannteste Beispiel für transgenerationale epigenetische Effekte liefert das Maus-Agouti-Gen. Dieses Gen steuert die Haarfarbe und wird genau zur richtigen Zeit in den Haarfollikelzellen eingeschaltet, um einen gelben Streifen in den ansonsten dunklen Haaren zu erzeugen, was zu einem sogenannten Agouti-Fell führt. Aber Mäuse mit einer bestimmten Variante des Agouti-Gens namens Avy haben Mäntel, die irgendwo zwischen gelb und dem normalen dunklen (Agouti) Muster von Wildtyp-Mäusen liegen. Die gelben Mäuse werden auch fettleibig und leiden unter anderen gesundheitlichen Problemen. Das Avy-Gen scheint also eine variable Wirkung zu haben (tatsächlich steht das Avy für Avariable Yellow). Wie das funktioniert, hat Genetiker seit Jahren verwirrt, aber wir können dies jetzt als epigenetischen Effekt erkennen. Das gelbe Fell tritt auf, weil die Avy-Version des Agouti-Gens fehlerhafte Kontrollen aufweist und ständig eingeschaltet ist. Methyl-Tags werden jedoch häufig der fehlerhaften Kontroll-DNA-Sequenz hinzugefügt, und dies neigt dazu, das Gen auszuschalten, was bei einzelnen Mäusen zu fleckigem oder dunklem Agouti-Fell führt. Welpen, die von Muttertieren mit dem Avy-Gen geboren wurden, haben eine Farbe von gelb bis dunkel, aber der Anteil hängt von der Fellfarbe der Mutter ab; Würfe dunkler (Agouti) Weibchen enthalten eher dunkle Welpen. Darüber hinaus wird ein höherer Anteil dunkler Nachkommen beobachtet, wenn sowohl die Mutter als auch die Großmutter die dunkle Färbung aufweisen. So kann die Agouti-Färbung, die epigenetisch (durch die Anzahl der Methyl-Tags auf dem Avy-Gen) bestimmt wird, gewissermaßen von einer Generation zur nächsten übertragen werden.Obwohl wir Fälle finden können, in denen epigenetische Effekte anscheinend von den Eltern auf die Nachkommen anhalten, ist dies normalerweise nicht der Fall und fast alle epigenetischen Schalter oder Markierungen werden in Keimzellen (Eiern und Spermien) und in den frühesten Entwicklungsstadien eines Embryos zurückgesetzt. Wenn dies nicht der Fall wäre, wäre die erstaunliche Entwicklung eines befruchteten Eies zu einer voll ausgebildeten Kreatur unmöglich.
Von einer befruchteten Eizelle zu einem voll ausgebildeten Menschen zu gelangen, ist alles im (Epi-) Genom
Bisher haben wir einige spezifische Fälle epigenetischer Regulation beschrieben, aber wir wissen jetzt, dass die Epigenetik im weitesten Sinne (wie Gene exprimiert und verwendet werden und nicht die DNA-Sequenz der Gene selbst) von zentraler Bedeutung ist, wie eine befruchtete Eizelle schließlich einen ganzen Organismus hervorbringen kann und wie Zellen, sagen wir Ihre Haut, Hautzellen bleiben und sich von Ihren Gehirnzellen unterscheiden, obwohl sie genau die gleichen Gene enthalten. Kurz nach der Befruchtung besteht ein sich entwickelnder menschlicher Embryo aus einer Zellkugel, den embryonalen Stammzellen. Jede dieser Zellen hat die Fähigkeit, während des Wachstums des Embryos eine der Arten von Zellen im Körper entstehen zu lassen (z. B. Gehirnzellen, Hautzellen oder Blutzellen). Im Gegensatz dazu sind 9 Monate später, wenn ein Baby geboren wird, die meisten Zellen, aus denen sein Körper besteht, verpflichtet, ein bestimmter Zelltyp mit bestimmten Funktionen zu sein. Während sich die Zellen teilen, entwickelt sich der Ball der embryonalen Stammzellen allmählich zu allen Zelltypen und Strukturen des Babys. Dazu müssen Tausende von Genen genau zur richtigen Zeit und in den richtigen Zellen ein- oder ausgeschaltet werden, wenn ein Embryo wächst. Zum Beispiel werden Gene, die das faserige Keratinprotein bilden, das unserer Haut ihre Stärke verleiht, nur in Hautzellen und nicht im sich entwickelnden Gehirn eingeschaltet, und Gene, die für die Entwicklung und Herstellung ihrer Verbindungen von Gehirnzellen erforderlich sind, sind im Gehirn eingeschaltet, aber nicht in der Haut.
Während der Entwicklung müssen Gene ein- und ausgeschaltet werden. Epigenetische Tags helfen dabei
Ein sehr großes Forschungsgebiet betrifft heute, wie all dieses Gen Ein- und Ausschalten funktioniert, und ein großer Teil dieses Prozesses verwendet die epigenetischen chemischen Tags, insbesondere Acetyl- und Methylhiston-Tags. Damit diese embryonalen Stammzellen alle anderen Zelltypen hervorbringen können, werden ihre epigenetischen Schalter im Vergleich zu adulten Zellen (fast) vollständig zurückgesetzt. Ich habe „fast“ in Klammern gesetzt, wie wir aus eingeprägten Genen und transgenerationeller epigenetischer Vererbung wissen, dass es Ausnahmen gibt.
Epigenetik, Dolly das Schaf und Freunde
Im Februar 1997 wurde ein Schaf namens Dolly das berühmteste Beispiel ihrer Spezies und wurde kurzzeitig sogar zu einer TV-Berühmtheit. Der Grund für ihren Ruhm ist, dass sie das erste Säugetier war, das durch einen Prozess namens somatischer Zellkerntransfer „erschaffen“ wurde, oder mit anderen Worten der erste von Menschen gemachte Klon (von Menschen gemacht, um sich von eineiigen Zwillingen zu unterscheiden, die natürliche Klone sind). Der Prozess, der zu ihrer Geburt führte, erforderte eine reife Eizelle (ein unbefruchtetes Ei) von einem weiblichen Schaf und eine gewöhnliche Zelle aus dem Euter eines zweiten Schafes. Zuerst wurde der Kern (der Teil, der die DNA enthält) aus der Eizelle entfernt. Dies geschah mit einem speziellen Mikroskop, da die Eizellen zwar im Vergleich zu anderen Zellen ziemlich groß sind, aber immer noch zu klein, um sie mit bloßem Auge zu sehen. Dann wurde der Kern aus der Euterzelle in die entkernte Eizelle eingeführt. So hatte Dolly drei „Mütter“: die Spenderin der Eizelle, die Spenderin der Euterzelle und das Schaf, das den sich entwickelnden Embryo zur Welt brachte. Kein Vater war beteiligt. Obwohl dieser Prozess sehr ineffizient war und bleibt, war es der erste Beweis dafür, dass die Gene aus einer erwachsenen Säugetierzelle „epigenetisch umprogrammiert“ werden können, zurück in den Zustand der embryonalen Stammzellen, die sich zu jedem anderen Zelltyp entwickeln können. Anschließend wurde das gleiche Verfahren auf andere Arten angewendet und kann medizinische Zwecke bei der Erzeugung von Zellen haben, die durch Verletzungen oder Krankheiten geschädigtes Gewebe reparieren könnten.
Zusammenfassung: das Epigenom und das ENCODE-Projekt – der „Large Hadron Collider“ der Biologie
Während sich der Begriff „Genom“ auf die gesamte DNA-Sequenz eines Organismus bezieht (drei Milliarden Buchstaben davon für den Menschen), bezieht sich das Epigenom auf das gesamte Muster epigenetischer Modifikationen über alle Gene hinweg, einschließlich Methyl-DNA-Tags, Methyl-Histon-Tags, Acetyl-Histon-Tags und anderer chemischer Tags, die wir nicht erwähnt haben, in jedem Zelltyp eines Organismus. Dies stellt eine fast unvorstellbare Menge an Informationen dar, die sogar das Humangenomprojekt in den Schatten stellt. Dennoch ist die Kenntnis des Epigenoms unerlässlich, um einige der größten Fragen der Biologie vollständig zu beantworten, wie zum Beispiel: Wie entwickeln wir uns von einem Ball identischer Zellen zu einem ganzen Organismus? warum altern wir? und wie können wir Krankheiten wie Krebs besser verstehen? Es überrascht daher nicht, dass die Epigenetik und das Epigenom ein großes Forschungsgebiet sind. Ein Teil der Forschung auf diesem Gebiet wird vom ENCODE-Projekt (Encyclopedia of DNA Elements) umfasst, einem laufenden Projekt zur Identifizierung von Mustern epigenetischer Tags in vielen verschiedenen Zelltypen für das gesamte menschliche Genom (http://genome.ucsc.edu/ENCODE/). Das ENCODE-Projekt wird manchmal mit dem Large Hadron Collider oder LHC in der Schweiz verglichen. Der LHC ist das größte jemals gebaute wissenschaftliche Gerät, und die Experimente, die Physiker damit durchführen, zielen darauf ab, die grundlegenden Details der Materie zu untersuchen, aus der unser Universum besteht. Obwohl Biologen für ihre Forschung kein so spektakuläres Kit haben (oder brauchen), wurde die Anstrengung, die Komplexität des menschlichen Epigenoms zu untersuchen, aufgrund seines Umfangs, seiner Komplexität und der Menge an Informationen mit dem LHC-Projekt verglichen.
Epigenetische Fehler
Die Epigenetik ist ein Bereich, in dem unsere wissenschaftlichen Erkenntnisse rapide zunehmen. Eine Sache, die Wissenschaftler entdeckt haben, ist, dass epigenetische Fehler bei Krankheiten wie Krebs und in alternden Zellen häufig sind. Infolgedessen entwickeln Wissenschaftler Medikamente, die auf fehlerhafte Epigenome abzielen, und eines der ersten Beispiele ist die Verwendung von HDAC-Inhibitoren, ähnlich der Verbindung in Gelee Royale. Aus der Untersuchung seltsamer Vererbungsmuster wie genetischer Prägung, der gelben / Agouti-Avy-Maus, der rein weiblichen Schildpattkatzenpopulation und anderer verwandter Phänomene haben Biologen eine ganz neue Informationsschicht entdeckt, die „oben“ auf der DNA-Sequenz unserer Gene liegt. Diese neuen Entdeckungen erklären diese früheren rätselhaften Beobachtungen, haben aber auch ein großes Potenzial für neues Verständnis und Behandlungen für menschliche Krankheiten.
Weiterführende Literatur:
- Bird, Adrian. Epigenetik. Instant Expert No. 29′, New Scientist, 5. Januar 2013, Nr. 2898.
- Carey, Nessa. Die Epigenetik-Revolution: Wie die moderne Biologie unser Verständnis von Genetik, Krankheit und Vererbung neu schreibt. Herausgeber: Icon Books. Taschenbuch 1. März 2012. ISBN-10: 1848313470. UVP Preis £ 9-99.
Epigenetische Einflüsse und Krankheiten auf der Website:
- http://www.nature.com/scitable/tpicpage/epigenetic-influences-and-disease-895
Leave a Reply