Enantiomere und Diastereomere
Enantiomere und Diastereomere sind die einzigen zwei stereochemischen Beziehungen, die Sie zwischen zwei beliebigen Molekülen haben können. Die Stereoisomere sind zwei beliebige Moleküle, die die folgenden zwei Anforderungen erfüllen:
- Beide Moleküle müssen die gleiche Molekülformel haben und
- Beide Moleküle müssen die gleiche Atomkonnektivität haben.
Also, was ist dann der Unterschied? Die Moleküle sind Stereoisomere, wenn sie eine andere 3D-Form haben und im Raum nicht überlagert werden können.
Was bedeutet nicht überlagerbar?
Nicht überlagernde Moleküle können nicht exakt gleich aussehen, egal wie viele Rotationsoperationen Sie mit ihnen durchführen. Zu den „Rotationen“ gehört auch die freie Rotation um die Einfachbindungen.
Denken Sie an Ihre Hände. Wenn Sie sie so ausrichten, dass alle Finger ausgerichtet sind, schauen die Handflächen in die entgegengesetzte Richtung. Wenn Sie Ihre Handflächen in die gleiche Richtung schauen lassen, schauen Ihre Daumen in eine andere Richtung usw. Egal wie sehr Sie Ihre Hände drehen, Sie werden nie in der Lage sein, sie genau gleich aussehen zu lassen — Ihre Hände sind nicht überlagernde Spiegelbilder. Das gleiche Prinzip gilt für Moleküle.
Warum brauchen wir dann zwei Beziehungen? Warum brauchen wir Enantiomere und Diastereomere und können nicht einfach mit Einstereoisomeren umgehen? Es gibt tatsächlich eine andere Art von Beziehungen, die zwei Moleküle haben können. Lass uns ein bisschen tiefer graben.
Was sind die Enantiomere?
Enantiomere sind zwei Moleküle, die nicht überlagerbare Spiegelbilder sind. Genau wie Ihre Hände können Moleküle ein Spiegelbild haben, das nicht mit dem ursprünglichen Molekül überlagert werden kann. Schauen Sie sich diese beiden Moleküle an:
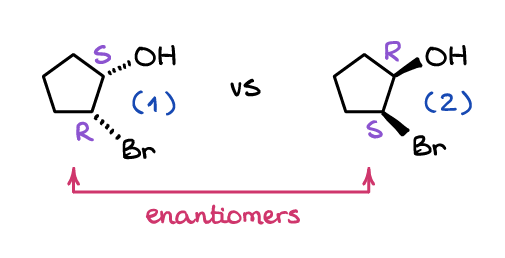
Egal wie sehr Sie eines im Raum drehen, Sie werden es niemals so aussehen lassen wie das andere. Während Molekül (1) und Molekül (2) beide Gruppen (OH und Br) nebeneinander haben, schauen sie von der Ebene des Zyklus in verschiedene Richtungen.
Beachten Sie, dass es viele Möglichkeiten gibt, wie Sie ein Spiegelbild für ein Molekül erstellen können. Hier sind die drei möglichen Beispiele:
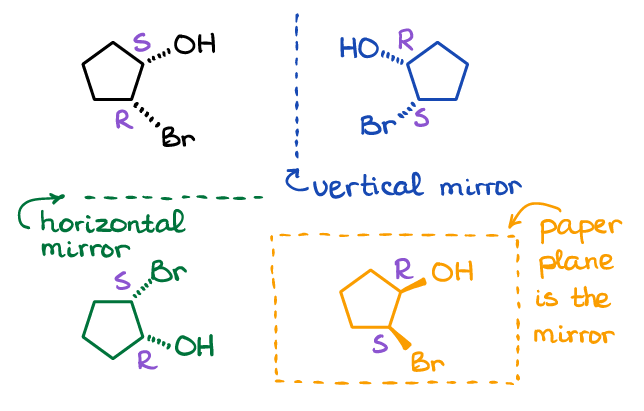
Die Spiegelebene kann vertikal oder horizontal sein, oder sogar das Papier, auf dem Sie das Molekül zeichnen, kann die Spiegelebene selbst sein. Ich schlage vor, Sie machen ein paar der Moleküle aus dem obigen Bild mit Ihrem molekularen Modell-Kit (wählen Sie eine Reflexion), und stellen Sie sicher, dass sie nicht überlagerbar sind, indem Sie sie physisch im Raum drehen.
Ein weiterer wichtiger Unterschied der Enantiomere besteht darin, dass alle Stereozentren auch zwischen den Molekülen gespiegelt sind. Das heißt, alle S-Stereozentren sind R im anderen Molekül und alle R in einem Molekül sind S im anderen. Beispielsweise ist das Molekül (1) von oben (1S, 2R) -2-Bromcyclopentanol, während sein Enantiomer, Molekül (2), (1R, 2S) -2-Bromcyclopentanol ist.
Was sind die Diastereomere?
Wenn es um Diastereomere geht, sind das, nun ja, keine Enantiomere. 😹 Ich meine, ernsthaft, die „gemeinsame“ Definition von Diastereomeren sind die Stereoisomere, die keine Enantiomere sind. Die offizielle Definition ist jedoch, dass die Diastereomere nicht überlagerbare Moleküle sind, die keine Spiegelbilder voneinander sind. Betrachten wir zum Beispiel die folgenden zwei Moleküle:
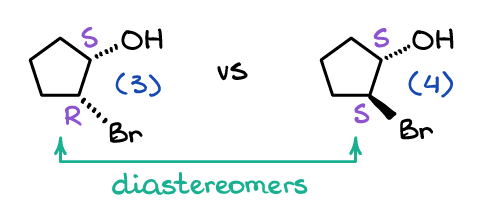
Die Moleküle (3) und (4) sind offensichtlich keine Spiegelbilder, daher können sie keine Enantiomere sein. Sie sind auch nicht im Raum überlagerbar, egal wie sehr Sie diese im Raum drehen, also sind sie auch nicht das gleiche Molekül. Somit, per Definition, Sie sind Diastereomere, da sie sich nicht überlagern und keine Spiegelbilder voneinander sind.
Beachten Sie, dass Diastereomere im Gegensatz zu Enantiomeren nur einen Teil der Stereozentren von einem Molekül zum anderen verändern. Zum Beispiel ist Molekül (3) (1S, 2R) -2-Bromcyclopentanol, während sein Diastereomer (1S, 2S) -2-Bromcyclopentanol ist.
Muss man chirale Kohlenstoffe haben, um Enantiomere und Diastereomere zu haben?
Nein, das tust du nicht! Beachten Sie, wie die Definition von Enantiomeren besagt, dass die Moleküle nicht überlagerbare Spiegelbilder sind, während Diastereomere nicht überlagerbare Nichtspiegelbilder sind? Die Definitionen sagen nichts über die chiralen Zentren oder Atome aus. Somit funktioniert jedes Molekülpaar, das der Definition entspricht! Zum Beispiel sind Allene kumulierte Alkene, die nicht planar sind:
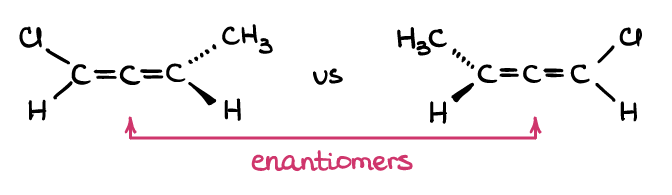
Wenn Sie mit Ihrem molekularen Modellbaukasten ein Paar Allene bauen (ja, holen Sie sich Ihren molekularen Modellbaukasten und bauen Sie diese tatsächlich!), werden Sie sehen, dass diese im Raum nicht überlagerbar sind. Aber diese beiden Moleküle haben keine chiralen Kohlenstoffe … und doch passen sie zur Definition von Enantiomeren, daher sind sie ein Enantiomerenpaar! Wie Sie sehen können, sind die chiralen Atome selbst hier nicht wichtig, sondern die 3D-Struktur des Moleküls selbst.
Sie können auch Diastereomere in Molekülen haben, die keine chiralen Atome haben. Sehen Sie sich die folgenden Beispiele an:
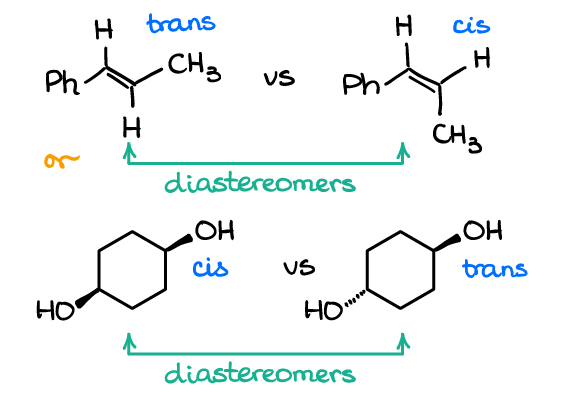
Das obere Paar ist ein Beispiel für die cis / trans (oder E/ Z, wenn Sie die strengen UIPAC-Namen verwenden möchten) Isomere in Alkenen. Das zweite Paar stellt auch als cis/Trans-Isomerenpaar dar. Keines der Moleküle hat jedoch chirale Atome. Und da jedes Paar ein Paar nicht überlagerbarer Moleküle darstellt, die keine Spiegelbilder sind, sind sie Diastereomere.
Dies sind typische Beispiele für Tests und viele Instruktoren lieben es, diese Fragen auf Sie zu werfen. Viele Studenten neigen dazu, eine Art Tunnelblick zu haben, wenn es um stereochemische Beziehungen geht, die sich nur auf Moleküle mit chiralen Atomen konzentrieren. Dies ist eine fehlerhafte Heuristik! Stellen Sie also sicher, dass Sie immer das gesamte Molekül analysieren und die Definition der Beziehung verwenden, anstatt sich nur auf die chiralen Atome zu konzentrieren.
Leave a Reply