CIMAvax-EGF: Ein neuartiger therapeutischer Impfstoff gegen fortgeschrittenen Lungenkrebs
BERICHT
CIMAvax-EGF: Ein neuartiger therapeutischer Impfstoff gegen fortgeschrittenen Lungenkrebs
Gisela González1, Agustin Lage1, Tania Crombet1, Gryssel Rodríguez1, Beatriz García1, Ariadna Cuevas1, Lisel Viña1, Norkis Arteaga1, Elia Neninger2
1zentrum für Molekulare Immunologie, CIMAve. 216 corner 15, Atabey, Playa, POBox 16 040, Havanna, Kuba
2Hermanos Ameijeiras HospitalSan Lázaro # 701 e / Belascoín y Marqués González, Centro Habana, Havanna, Kuba.
ZUSAMMENFASSUNG
Die Ergebnisse, die es der kubanischen Regulierungsbehörde (CECMED) ermöglichen, die hygienische Registrierung des CIMAvax-EGF-Krebsimpfstoffs für fortgeschrittenen nicht-kleinzelligen Lungenkrebs (NSCLC) zu erteilen, werden gezeigt. Dies war die erste Registrierung eines therapeutischen Impfstoffs in Kuba und auch die erste Registrierung eines Lungenkrebsimpfstoffs in der Welt. Daher wird Lungenkrebspatienten ein einzigartiger therapeutischer Impfstoff angeboten, der das Überleben und ihre Lebensqualität erhöht. Zu diesem Zweck waren erhebliche präklinische, klinische, regulatorische, produktive und verhandlungstechnische Herausforderungen zu bewältigen. Die in diesen Bereichen erzielten Ergebnisse führten zu 18 wissenschaftlichen Arbeiten, die in renommierten Fachzeitschriften veröffentlicht wurden, und zu 4 Erfindungsobjekten, die mehrere Patente in Kuba und anderen Ländern hervorbrachten. Im präklinischen Umfeld wurden Immunogenität, Sicherheit und antitumorale Wirkungen bei verschiedenen Tierarten nachgewiesen. Die klinische Erfahrung begann 1995. Bisher wurden fünf klinische Phase-I-II-Studien in Kuba abgeschlossen, zwei Phase-II-Studien wurden ebenfalls abgeschlossen, eine in Kuba und eine weitere in Kanada und Großbritannien, und eine Phase-II-III-Studie mit einem optimierten Zeitplan sowie eine Phase-III-Studie sind derzeit in Kuba im Gange. Im regulatorischen Bereich wurde eine Fast-Track-Registrierungsstrategie entwickelt und durchgeführt. Um dieses einzigartige Produkt zu entwickeln, waren neuartige regulatorische Konzepte erforderlich. Es wurde ein skalierbarer, reproduzierbarer und kontrollierter Produktionsprozess durchgeführt, zusammen mit einem Qualitätssystem, das die vollständige GMP-Konformität sicherstellte. Die Mittel für die Produktentwicklung stammten aus der Umsetzung einer neuartigen Verhandlungsstrategie: der Verhandlung von immateriellen Vermögenswerten.
Schlüsselwörter: Krebsimpfstoff, NSCLC, beschleunigte Registrierung, CIMAvax-EGF, klinische Phase II-III-Studie
EINFÜHRUNG
Die Beziehung zwischen dem vom epidermalen Wachstumsfaktorrezeptor (EGFR) gebildeten System und seinen Liganden zur Krebsentstehung ist bekannt. Bei Tumoren epidermoiden Ursprungs kommt es zu einer Überexpression des EGFR, die sich auf schlechte Prognosen und frühe Rückfälle nach der Operation bezieht. Deshalb ist dieses System zu einem wichtigen Ziel für Antitumortherapien geworden.
Zellproliferationsmechanismen werden mit der Bindung von EGF an EGFR initiiert. Unser therapeutischer Ansatz besteht aus einem Impfstoff mit einer EGF-Formulierung, die ihn immunogen macht und eine humorale Immunantwort induziert. Die Produktion spezifischer Anti-EGF-Antikörper, die an den autologen EGF binden, verhindert, dass er an den EGFR bindet, wodurch die aus dieser Wechselwirkung abgeleiteten Zellproliferationsmechanismen ausgelöst werden (1-4).
Hier berichten wir über die Ergebnisse der Registrierung dieses Impfstoffs (CIMAvax-EGF) in Kuba. Dies war Teil einer globalen Strategie, die neuartige klinische, regulatorische, technologische und geschäftliche Beiträge umfasst und von 18 internationalen wissenschaftlichen Arbeiten und geistigem Eigentum weltweit unterstützt wird. Wir beschreiben auch Innovationen in verschiedenen Bereichen, die die Registrierung von CIMAvax-EGF in Kuba und Peru ermöglichten.
ERGEBNISSE UND DISKUSSION
Die Impfung mit EGF ist sicher, immunogen und erhöht das Überleben bei einer guten Lebensqualität bei Patienten im fortgeschrittenen Stadium Lungenkrebs
Die klinischen Erfahrungen mit CIMAvax-EGF in der Therapie von nicht-kleinzelligem Lungenkrebs (NSCLC) im fortgeschrittenen Stadium begannen 1995. Bisher wurden in Kuba fünf klinische Phase-I-II-Studien abgeschlossen; 2 randomisierte klinische Phase-II-Studien wurden abgeschlossen, eine in Kuba und eine weitere in Kanada und Großbritannien, und in Kuba läuft eine Phase-III-Studie. Mehr als 800 Krebspatienten im fortgeschrittenen Stadium wurden mit CIMAvax–EGF behandelt, wodurch nachgewiesen wurde, dass es sicher, immunogen und in der Lage ist, das Überleben bei guter Lebensqualität zu steigern.
Das Hauptziel der Phase-I-II-Studien bestand darin, die beste Impfstoffformulierung (Trägerprotein und Adjuvans), die Dosis und den Therapieplan zu bestimmen. Diese Ergebnisse zeigten die Vorteile des P64k-Proteins als Trägerprotein und Montanid ISA51 als Adjuvans. Die erhöhte Immunogenität der Dosisskalierung wurde ebenfalls nachgewiesen (5-7).
Die Analyse der gepoolten Daten aus allen Phase-I-II-Studien zeigte eine signifikante Erhöhung des Überlebens bei Patienten mit besseren Antikörperantworten oder guten Antikörperansprechern (GAR) und bei Patienten mit einer stärkeren Abnahme der Sera-EGF-Konzentrationen () infolge der Impfung. Ein signifikanter Anstieg des Überlebens aller geimpften Patienten wurde auch im Vergleich zu einer gleichzeitigen historischen Kontrolle nachgewiesen (7).
Eine klinische Phase-II-Studie wurde an 80 Patienten durchgeführt, die nach Abschluss der Erstlinientherapie randomisiert den CIMAvax-EGF und die beste unterstützende Behandlung (BSC) (40 Patienten) oder BSC allein (40 Patienten) erhielten. Die bisherigen Ergebnisse wurden in dieser Studie bestätigt. Ungefähr 50% der geimpften Patienten waren GAR und überlebten signifikant mehr als Patienten, die die GAR-Klassifikation nicht erreichten (die als schlechte Antikörperantworter, PAR, eingestuft wurden). In ähnlicher Weise überlebten Patienten mit der größten Abnahme signifikant mehr als Patienten, die diese Abnahme nicht zeigten (Tabelle 1). Es wurde eine signifikante inverse Korrelation zwischen Anti-EGF-Antikörpertitern und beobachtet , die bei geimpften Patienten, jedoch nicht bei den Kontrollen auftrat, was zeigt, dass sie durch Impfung verursacht wurde (Abbildung 1).
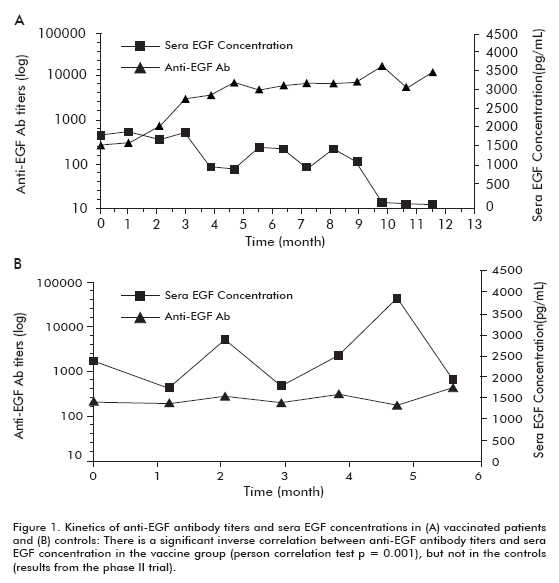
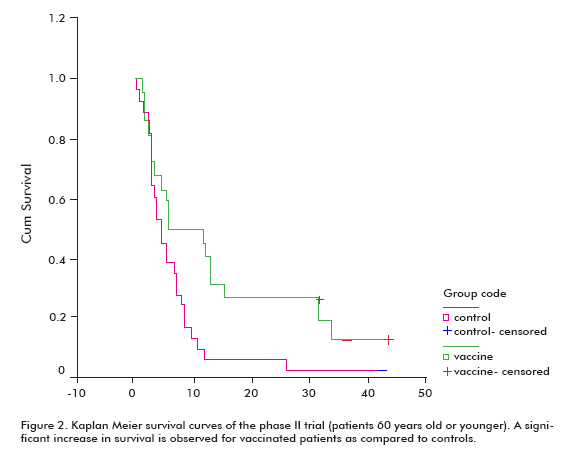
Bei allen geimpften Patienten zeigte sich ein erhöhter Überlebenstrend (18,53 ± 11,47; Mittelwert ± Median) im Vergleich zu den nicht geimpften Kontrollen (7,55 ± 5.33), was in der Gruppe der Patienten, die 60 Jahre oder jünger waren, signifikant war (Log rank test; p < 0,05) (Abbildung 2) (8).
Wie in einem In-vitro-Kompetitionstest nachgewiesen, hemmten Seren von geimpften Patienten die Bindung von EGF an EGFR. Diese Bindungshemmung war proportional zu Antikörpertitern und Überleben. Zusätzlich hemmten Seren von geimpften Patienten die EGFR-Phosphorylierung im Verhältnis zu ihren Anti-EGF-Antikörpertitern.
Die bevorzugte Erkennung der EGF/EGFR-Bindungsstelle (Schleife B des EGF-Moleküls) wurde untersucht. Patienten, deren Seren Loop B bevorzugt erkennen, überlebten signifikant mehr als Patienten, die dieses Epitop nicht erkannten (9).
Vor kurzem wurde in Kuba eine Dosis-/Zeitplan-Optimierungsstudie abgeschlossen (Phase I-II). In seinem Design wurden alle Elemente, die die Immunogenität in früheren Studien erhöhen, berücksichtigt, darunter: Montanid ISA51 als Adjuvans, erhöhte Dosen, vier Injektionsstellen und Verabreichung von zwei Impfstoffdosen vor der Erstlinientherapie, gefolgt von einer Impfung. Die Ergebnisse dieser Studie zeigten einen signifikanten Anstieg der Immunogenität, mit einem 95% von GAR Erreichen das Zehnfache der vorherigen maximalen Antikörpertiter. Alle geimpften Patienten überlebten signifikant mehr als die Kontrollen aus der Phase-II-Studie (10).
Eine erhöhte Kapazität der Seren von Patienten zur Hemmung der EGF / EGFR-Bindung und EGFR-Phosphorylierung wurde ebenfalls gefunden. Im siebten Monat nach Abschluss der Chemotherapie verlagerte sich die Antikörperantwort in Richtung Schleife B des EGF-Moleküls, was auf eine Verbesserung der Qualität der Immunantwort hinweisen könnte. Die Ergebnisse dieser Studie zeigten, dass es eine Marge der Verbesserung der Reaktion auf CIMAvax-EGF gibt, die durch Manipulation der Dosis und des Therapieplans erreicht werden kann (10).
Die Ergebnisse dieser Studien werden derzeit in einer Phase-III-Studie in Kuba validiert.
Entwurf und Umsetzung einer regulatorischen Strategie für die Impfstoffregistrierung, um sie allen fortgeschrittenen nicht-kleinzelligen Lungenkrebspatienten zur Verfügung zu stellen
CIMAvax-EGF ist ein therapeutischer Impfstoff gegen Lungenkrebs, der weltweit einzigartig ist. Eine globale Strategie wurde entworfen und umgesetzt; Es wurde von regulatorischen Anforderungen geleitet, für eine schnelle Registrierung in Kuba. Eine enge Beziehung zwischen dem Sponsor (CIM) und der kubanischen Regulierungsbehörde (CECMED) hatte den Zweck, die Anforderungen für die Erlangung eines Produkts und seine schnelle Anwendung zugunsten fortgeschrittener Krebspatienten ohne andere therapeutische Alternative festzulegen. Diese Strategie umfasste die Gestaltung eines Qualitätssystems, Qualitätskontrollen und Spezifikationen sowie GMP-Anforderungen, um die verschiedenen Schritte der Produktentwicklung abzudecken. Diese globale Strategie kann bei der Entwicklung anderer ähnlicher Produkte verwendet werden.
Die gesammelten regulatorischen Erfahrungen und Dokumentationen führten zur Genehmigung klinischer Studien in verschiedenen Ländern. Das Dossier mit allen Informationen ermöglichte die Registrierung von CIMAvax-EGF in Kuba und Peru. Wir können daher feststellen, dass wir eine definierte Strategie für die Arzneimittelregistrierung in verschiedenen Ländern haben.
Der GMP-Produktionsprozess, der ein Produkt erzeugt, das skalierbar, konsistent und den Spezifikationen entspricht
Die erste Herausforderung bei der Entwicklung eines Produktionsprozesses für CIMAvax-EGF bestand darin, ein immunogenes EGF-Präparat zu entwickeln. Es wurde durch die chemische Konjugation des humanen rekombinanten EGF an das rekombinante Membranprotein P64k (aus Neisseria meningitidis) erhalten. Das Konjugat wird zusammen mit einem geeigneten Adjuvans injiziert (derzeit Montanide ISA 51 von Seppic, Frankreich).
Ursprünglich wurde ein Prozess im Labormaßstab konzipiert. Ein Scale-up (und skalierbarer) hygienischer und reproduzierbarer Prozess wurde später unter Einhaltung der GMP-Richtlinien entworfen und implementiert. In-vitro- und In-vivo-Analysetests wurden ebenfalls entwickelt und implementiert, um die Qualität der Rohstoffe sowie der Zwischen- und Endprodukte zu bewerten.
Alle Änderungen wurden von der aktuellen Regulierungsstrategie bewertet und unterstützt. Die Ergebnisse der Äquivalenzstudie zum Vergleich beider Produkte erhielten die Zulassung der skalierten Prozessanwendung durch CECMED und die Zulassung des in diesem Verfahren erhaltenen Produkts für die klinische Anwendung. Die Skalierung und Optimierung des Produktionsprozesses führte zu einer Veröffentlichung (11) und einem neuen Erfindungsgegenstand, mit Patenten, die anschließend in verschiedenen Ländern eingereicht wurden.
Aushandlung von immateriellen Vermögenswerten gewährte uns Mittel für die Projektentwicklung und auch Lernerfahrung in unserer gemeinsamen Arbeit mit Regulierungsbehörden aus verschiedenen Ländern
Dieses Projekt wurde mit ausländischen Kollegen auf der Grundlage des neuartigen Konzepts der „Aushandlung von immateriellen Vermögenswerten“ ausgehandelt, das hauptsächlich durch das geistige Eigentum unseres in der Entwicklung befindlichen Produkts unterstützt wurde. Diese Verhandlungsstrategie bestand darin, das Projekt für die gemeinsame Entwicklung mit anderen Ländern zu lizenzieren, was bedeutet, dass die ausländischen Kollegen die Kosten für Regulierungsmaßnahmen und klinische Studien in ihrem Hoheitsgebiet deckten. Als Ergebnis dieser Verhandlungen erhielt Kuba Zahlungen für Meilensteine. Diese Verhandlungsmodalität ermöglichte uns auch einen ständigen Austausch mit Spezialisten im In- und Ausland, wodurch unsere Erfahrung erweitert wurde. Unsere positiven Ergebnisse mit dieser Verhandlungsmodalität könnten auf andere in unserem Land laufende Produkte angewendet werden.
RELEVANZ DER STUDIE
CIMAvax-EGF ist der erste therapeutische Impfstoff zur Krebsbehandlung, der in Kuba registriert ist, und der erste, der weltweit für die Lungenkrebstherapie registriert ist. Lungenkrebs ist ein ungelöstes Gesundheitsproblem mit mehr als 1,3 Millionen diagnostizierten Fällen pro Jahr und der gleichen Anzahl von Todesfällen auf der ganzen Welt. In Kuba ist es die Haupttodesursache aufgrund von Krebs bei beiden Geschlechtern mit einer Inzidenz von mehr als 4000 Verstorbenen pro Jahr. Die Therapie der Wahl für Patienten, die im fortgeschrittenen Stadium diagnostiziert werden, ist die der First-Line-Chemotherapie, die gleichzeitig mit der Strahlentherapie verabreicht werden kann. Dies ist eine palliative, nicht kurative Behandlung, bei der ein vollständiges Ansprechen auf die Chemotherapie sehr selten ist und objektive Reaktionen (vollständig oder teilweise) nur bei 25% der Patienten auftreten. CIMAvax-EGF bietet eine alternative Behandlung für diese Patienten, die bereits eine First-Line-Chemotherapie erhalten haben. Die schwerwiegenden Nebenwirkungen von Chemo- und / oder Strahlentherapiebehandlungen sind bekannt und verschlechtern die Lebensqualität erheblich. Stattdessen führt die Impfung mit CIMAvax-EGF eher zu leichten oder mittelschweren als zu schweren Nebenwirkungen, die mit konventioneller unterstützender Behandlung behoben werden können, während das Überleben fortgeschrittener Lungenkrebspatienten verbessert und eine gute Lebensqualität geboten wird.
Bisher wurden mehr als 800 Kubaner in mehr als 20 Krankenhäusern im ganzen Land mit CIMAvax-EGF behandelt. Die Registrierung von CIMAvax-EGF ermöglicht die Ausweitung auf alle Patienten im Land, bei denen fortgeschrittener Lungenkrebs diagnostiziert wurde; damit ist Kuba das erste Land der Welt mit einem nationalen Programm, das diese therapeutische Alternative einsetzt.
In Bezug auf den wirtschaftlichen Nutzen haben wir durch die Verhandlungen dieses Projekts 6,346 Millionen USD erhalten. Die Verhandlungsstrategie des Projekts ist die gemeinsame Entwicklung mit anderen Ländern, was bedeutet, dass das ausländische Gegenstück die Kosten der klinischen Studien im eigenen Land übernimmt und es erschwinglich macht. Diese Versuche erfordern Investitionen in Millionenhöhe, und dies ist nur möglich, wenn es von ausländischen Kollegen unterstützt wird. Gleichzeitig bietet diese Strategie Kuba mehr klinische Daten, ohne die Kosten für die Durchführung der Studien hier. Bisher wurden klinische Studien in Kanada, Großbritannien und Malaysia durchgeführt. In naher Zukunft werden klinische Studien in China und Europa beginnen.
Im Rahmen dieser Lizenzierungsstrategie sind die ausländischen Partner auch für die Produktregistrierung in den Regionen verantwortlich, in denen sie kommerzielle Rechte haben. Während des Registrierungs- und Marketingprozesses erhalten Sie Zahlungen für Meilensteine und später als Verkaufsgebühren.
Der Weltmarkt für Krebsimpfstoffe liegt in der Größenordnung von Milliarden USD. Die Tatsache, dass Kuba über ein einzigartiges Produkt zur Behandlung von fortgeschrittenem Lungenkrebs verfügt, kann uns ein Exportpotenzial bieten, das die Verwendung dieses Produkts in unserem nationalen Gesundheitssystem finanzieren kann.
SCHLUSSFOLGERUNGEN
Die Impfung mit CIMAvax-EGF ist sicher, immunogen und führt bei Patienten mit Lungentumoren im fortgeschrittenen Stadium zu einer Erhöhung des Überlebens bei guter Lebensqualität. Das Design und die Umsetzung einer regulatorischen Strategie zur Registrierung dieses Impfstoffs machten ihn für alle Fälle von fortgeschrittenen nicht-kleinzelligen Lungenkrebspatienten in Kuba verfügbar. Diese positive Erfahrung könnte auf andere ähnliche Produkte in Arbeit anwendbar sein. Es wurde ein Produktionsprozess entwickelt, der skalierbar, konsistent und reproduzierbar war und den GMP-Richtlinien entsprach, um ein spezifikationskonformes Produkt zu erzeugen. Die Erfahrung bei der Verhandlung von immateriellen Vermögenswerten war sehr positiv und hat uns Mittel für die Projektentwicklung bewilligt, während die Lernerfahrung aus der gemeinsamen Arbeit mit den Regulierungsbehörden verschiedener Länder unterstützt wurde.
DANKSAGUNG
Die Autoren danken folgenden Spezialisten des Zentrums für Molekulare Immunologie für ihren Beitrag zu dieser Arbeit: Rolando Pérez, Loany Calvo, Suhamy Aufmerksamkeit, Belinda Sánchez, Irene Beausoleil, Ernesto Chico, Airama Alvisa, Ileana Cartroman, Sergio Verkostung, Ana Veloso, Reinaldo Krähe, Yanelda Lopez, Yosniel Hernández, Antonio Vallin, Alejandro Portillo, Liuva Holz, Guido Ferrer, Diana Borges, Niuvis Pérez, Tamara García, Idaine Becken, Mayra Santaelena, Joaquin Solozabal, Aida Rodriguez, Maria Elena Garcia, Addis Torres, Eric Chong, Carmen Roll, Mauritius Catala, Soraida Acosta, Barbara Wilkinson, Olga Torres, Normando Iznaga alle vom Zentrum für molekulare Immunologie und auch von Daniel González, Lourdes B Costa, Galina M Moya, Rolando Páez, Gerardo Guillén, Vivian Pujol , Dinorah Torres vom Zentrum für Gentechnik und Biotechnologie.
1. González G, Montero E, León K, Cohen IR, Lage A. Autoimmunisierung gegen epidermalen Wachstumsfaktor, eine Komponente des immunologischen Homunkulus. Autoimmun Rev 2002;1:89-95.
2. Lage A, Crombet T, González G. Targeting epidermal growth factor receptor signalling: frühe Ergebnisse und zukünftige Trends in der Onkologie. Ann Med 2003;5(35):327-36.
3. González G und Lage A. Krebsimpfstoffe gegen Hormon-Immundeprivation: Der EGF-Impfstoff-Ansatz: Führende Themen in der Krebsforschung, Kapitel 11, Ed Nova Publishers, 2007.
4. González G und Lage A. Krebsimpfstoffe gegen Hormon- / Wachstumsfaktor-Immundeprivation: ein praktikabler Ansatz für die Krebsbehandlung. Curr Cancer Drug Targets 2007;7:229-41.
5. González G, Crombet T, Torres F, Catala M, Alfonso L, Osorio M, et al. Epidermaler Wachstumsfaktor-basierter Krebsimpfstoff für die nicht-kleinzellige Lungenkrebstherapie. Ann Oncol 2003;14:461-6.
6. Crombet T, Neninger E, Catalá M, García B, Leonard I, Martínez L, et al. Behandlung von NSCLC-Patienten mit einem EGF-basierten Krebsimpfstoff. Bericht einer Phase-I-Studie. Krebs Biol Ther 2006;5(2): 136-41.
7. González G, Crombet T, Neninger E, Viada C, Lage A. Therapeutische Impfung mit epidermalem Wachstumsfaktor (EGF) bei fortgeschrittenem Lungenkrebs: Analyse gepoolter Daten aus drei klinischen Studien. Hum, 2007;3(1):8-13.
8. Neninger E., De la Torre A., Osorio M., Catald M., Bravo I., Mendoza M., et al. Randomisierte kontrollierte Phase-II-Studie mit einem Impfstoff gegen epidermalen Wachstumsfaktor bei fortgeschrittenem nicht-kleinzelligem Lungenkrebs. J Clin Oncol 2008;26:1452-8.
9. García B., Neninger E., De la Torre A., Leonard I., Martínez R., Viada C., et al. Eine wirksame Hemmung der Bindung des epidermalen Wachstumsfaktors / epidermalen Wachstumsfaktorrezeptors durch antiepidermale Wachstumsfaktorantikörper hängt mit einem besseren Überleben bei fortgeschrittenen nichtkleinzelligen Lungenkrebspatienten zusammen, die mit dem Impfstoff gegen den epidermalen Wachstumsfaktor behandelt werden. Clin Cancer Res 2008; 14(3):840-6.
10. Neninger E, Verdecia BG, Crombet T, Viada C, Pereda S, Leonard I, et al. Kombination eines EGF-basierten Krebsimpfstoffs mit Chemotherapie bei fortgeschrittenem nicht kleinzelligem Lungenkrebs. J Immunother 2009;32:92-9.
11. A, A, A, A, A, A, A, A, A, A, A, et al. Entwicklung eines Herstellungsprozesses für einen auf epidermalen Wachstumsfaktoren basierenden Krebsimpfstoff. Bio-pharm Int, Impfstoffe Suppl, Oktober 2008.
Leave a Reply