Chemische Bindung
Chemische Bindungen sind die Anziehungskräfte zwischen Atomen, die sie zu Verbindungen zusammenhalten. Es gibt drei Haupttypen von Bindungen: kovalente Bindungen, die molekulare Verbindungen miteinander verbinden, ionische Bindungen, die Salze und ionische Kristalle binden, und metallische Bindungen, die die Atome von Metallen binden.
Moleküle und kovalente Bindungen
Die meisten Kraftstoffe, Kunststoffe und Naturstoffe sind molekulare Verbindungen, die aus Atomen bestehen, die zu Molekülen zusammengebunden sind. Die Art der Bindung, die die Atome eines Moleküls verbindet, ist die kovalente Bindung, die auftritt, wenn die äußeren Elektronen zweier Atome zwischen ihnen geteilt werden, wodurch eine Anziehung zwischen den beiden Atomen entsteht.
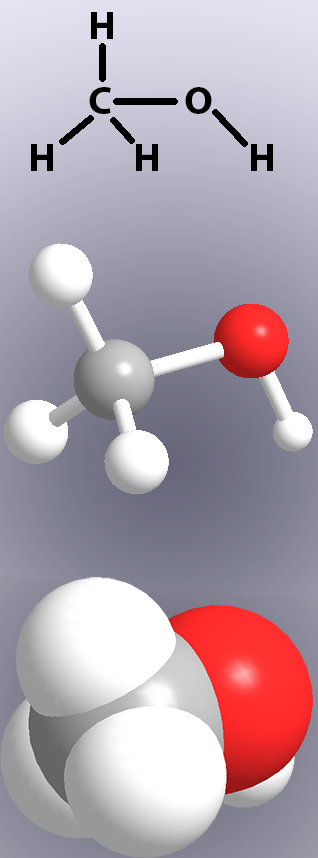
Kovalente Bindungen werden in chemischen Strukturen durch Linien (Abbildung 1, oben) und in Modellen entweder durch ‚Sticks‘ oder die Überlappung der Atome (Abbildung 1, Mitte und unten) dargestellt.
Die Elektronen in einer kovalenten Bindung werden nicht immer gleichmäßig zwischen den beiden Atomen geteilt. Wenn die Teilung ungleich ist, hat ein Atom eine sehr geringe positive Ladung und das andere Atom ist leicht negativ. Dadurch entsteht ein kleiner elektrischer Dipol – Moleküle, die einen Dipol enthalten, sind polare Verbindungen. Ob ein Molekül polar oder unpolar ist, beeinflusst seine Eigenschaften wie Schmelz- und Siedepunkte und Wasserstoffbindung.
Lesen Sie mehr über die kovalente Bindung im Chemie-LibreText.
Ionische und metallische Bindung
Während die kovalente Bindung das Teilen von Elektronen zwischen zwei Atomen beinhaltet, beinhaltet die ionische Bindung den vollständigen Transfer von Elektronen von einem Atom zum anderen, wodurch positive und negative Ionen erzeugt werden. Diese Ionen werden dann durch die Anziehung zwischen ihren entgegengesetzten Ladungen zusammengehalten. Ionische Verbindungen bilden Kristalle basierend auf diesen Attraktionen. Bei der metallischen Bindung werden die Valenzelektronen von Metallatomen vollständig geteilt, wodurch ein „Elektronenmeer“ entsteht, in dem sich Elektronen frei bewegen können. Dies ist einer der Gründe für die hohe Leitfähigkeit von Metallen. Lesen Sie mehr über metallische Bindungen im Chemie-LibreText
Energie und chemische Bindungen
Im Allgemeinen wird Energie freigesetzt, wenn sich eine Bindung zwischen zwei Atomen bildet, unabhängig von der Art der Bindung. Wenn bereits eine Bindung zwischen zwei Atomen besteht, wird Energie benötigt, um sie zu brechen. Die Menge an Energie, die benötigt wird, um eine Bindung zu brechen, ist die gleiche wie die Menge an Energie, die freigesetzt wird, wenn sie sich bildet.
Die meisten chemischen Reaktionen beinhalten sowohl das Brechen als auch das Herstellen chemischer Bindungen. Wenn die Energie, die durch die Bildung neuer Bindungen freigesetzt wird, größer ist als die Energie, die benötigt wird, um die „alten“ Bindungen zu brechen, wird insgesamt Energie durch die Reaktion freigesetzt. Diese Energie kann als Wärme verloren gehen oder für Strom verwendet werden.
Auf diese chemische Reaktion folgt beispielsweise die Verbrennung von Methan (CH4):
Diese Reaktion beinhaltet den Bruch der vier Kohlenstoff-Wasserstoff-Bindungen in Methan und der Sauerstoff-Sauerstoff-Bindung in O2. Neu gebildete Bindungen sind die beiden Kohlenstoff-Sauerstoff-Bindungen (in CO2) und Wasserstoff-Sauerstoff-Bindungen (in H2O). Diese neuen Bindungen haben insgesamt weniger Energie als die ursprünglichen Bindungen, so dass durch diese Reaktion Energie freigesetzt wird. Die Freisetzung von Energie ist ein Merkmal von Verbrennungsreaktionen – dies haben Sie möglicherweise bemerkt, wenn Sie eine heiße Flamme spüren. Die folgende Animation zeigt die Kohlenwasserstoffverbrennung von Methan. Da bei der Bildung von CO2 und H2O bei der Verbrennung von Kohlenwasserstoffen wie Methan eine große Menge Energie freigesetzt wird, sind diese eine gute Primärenergiequelle. Es bedeutet auch, dass eine große Menge an Energie benötigt würde, um die Bindungen in CO2 zu brechen und andere Moleküle zu bilden. Dies ist ein Grund, warum die Photosynthese so viel Energie (aus Sonnenlicht) benötigt, um CO2 in Kohlenhydrate umzuwandeln.
Zum Weiterlesen
- Chemische Energie
- Verbrennung
- Primärenergie
- Energieumwandlungstechnologie
- Oder erkunden Sie eine zufällige Seite
Leave a Reply