Chemie: Was sind Säuren und Basen?
Was sind Säuren und Basen?
Obwohl ich Ihnen gesagt habe, dass Säuren und Basen nicht schwer zu verstehen sind, habe ich schlechte Nachrichten: Es gibt nicht eine, sondern drei gängige Definitionen, um Säuren und Basen zu beschreiben: Arrhenius-Säuren und Basen, Brnsted-Lowry-Säuren und Basen und Lewis-Säuren und Basen. Obwohl dies den Anschein erweckt, als müssten Sie Säuren und Basen dreimal lernen, ist die gute Nachricht, dass diese drei Definitionen für viele praktische Zwecke ungefähr gleichwertig sind.
Arrhenius Säuren und Basen
In den späten 1800er Jahren entwickelte unser alter Freund Svante Arrhenius Definitionen von Säuren und Basen, während er an kinetischen Problemen arbeitete.
Laut Arrhenius sind Säuren Verbindungen, die in Wasser zerfallen, um Hydronium (H+) -Ionen abzugeben. Ein gängiges Beispiel für eine Arrhenius-Säure ist Salzsäure (HCl):
- HCl ? H+ + Cl-
Die Formeln für Säuren beginnen normalerweise mit Wasserstoff, obwohl organische Säuren eine bemerkenswerte Ausnahme darstellen. Die Namen und Formeln einiger gebräuchlicher Säuren sind in der folgenden Tabelle angegeben:
| Säurename | Formel |
|---|---|
| Salzsäure | HCl |
| Salpetersäure | HNO3 |
| Phosphorsäure | H3PO4 |
| Schwefelsäure | H2SO4 |
| Essigsäure | C2H4O2 |
Arrhenius-Basen sind definiert als Verbindungen, die die Bildung des Hydroxidions verursachen, wenn sie in Wasser gegeben werden. Ein Beispiel für eine Arrhenius-Base ist Natriumhydroxid (NaOH):
- NaOH ? Na+ + OH-
Basen haben typischerweise „OH“ in ihren Formeln, obwohl es Ausnahmen gibt. Zum Beispiel enthält Ammoniak (NH3) keine Hydroxidionen, sondern bildet sie, wenn es mit Wasser reagiert:
- NH3 + H2O ? NH4+ + OH-
Die Namen und Formeln einiger gängiger Basen sind in der folgenden Tabelle aufgeführt:
| Name der Base | Formel |
|---|---|
| Ammoniak | NH3 |
| Kaliumhydroxid | KOH |
| Natriumbicarbonat | NaHCO3 |
| Natriumcarbonat | Na2CO3 |
| Natriumhydroxid | NaOH |
Einige Oxide bilden Säuren oder Basen, wenn Wasser hinzugefügt wird. Weil diese Verbindungen kein H enthalten+ oder OH- Ionen, es sei denn, sie reagieren mit Wasser, Sie werden „Anhydride“ genannt.“ Typischerweise sind Oxide von Nichtmetallen Säureanhydride (sie bilden Säure, wenn sie in Wasser gegeben werden), und Oxide von Metallen sind Basenanhydride (bilden eine Base, wenn sie in Wasser gegeben werden).
Brnsted-Lowry-Säuren und -Basen
In den frühen 1900er Jahren wurde von Johannes Brnsted und Thomas Lowry eine alternative Definition für Säuren und Basen vorgeschlagen, um die Tatsache zu berücksichtigen, dass Ammoniak den Säuregehalt von HCl neutralisieren kann, auch wenn kein Wasser vorhanden ist. Dieses Phänomen zeigte ihnen, dass Ammoniak eine Base ist, auch wenn kein Wasser vorhanden ist, um Hydroxidionen zu bilden.
Es gibt viele verschiedene Namen und Formeln, um das Hydronium-Ion zu beschreiben. Obwohl die Formel zuvor als „H +“ gezeigt wurde, wird sie manchmal als „H3O“ geschrieben, da dies das Ion ist, das gebildet wird, wenn sich H + mit Wasser verbindet. Eine andere übliche Art, sich auf Hydroniumionen zu beziehen, besteht darin, sie einfach „Protonen“ zu nennen.“ Dieser Name kommt von der Tatsache, dass H + ein Wasserstoffatom (ein Proton und ein Elektron) darstellt, das sein Elektron verloren hat und nur das bloße Proton zurücklässt.
Eine Brnsted-Lowry-Säure ist definiert als eine Verbindung, die Hydroniumionen an eine andere Verbindung abgibt?zum Beispiel gibt Salzsäure Verbindungen, mit denen sie reagiert, H + -Ionen. Brnsted-Lowry-Basen sind Verbindungen, die Hydroniumionen aufnehmen können?wenn Ammoniak ein Hydroniumion von HCl erhält, bildet es das Ammoniumion.
Die folgende Gleichung stellt die Reaktion einer Brnsted-Lowry-Säure mit einer Brnsted-Lowry-Base dar:
- HNO3 + NH3 ? NO3- + NH4+
Bei dieser Reaktion verhält sich Salpetersäure wie eine Säure, da sie Ammoniak ein Proton verleiht. Ammoniak verhält sich als Base, weil es das Proton aus Salpetersäure aufnimmt.
Wenn Sie jedoch einen Blick auf die andere Seite der Gleichung werfen, finden wir die Nitrat- und Ammoniumionen. Da das Nitrationion Protonen aus dem Ammoniumion aufnehmen kann (um HNO3 zu bilden), ist das Nitrationon eine sehr schwache Brnsted-Lowry-Base. Da das Ammoniumion ein zusätzliches Proton zu spenden hat (in diesem Fall an das Nitrationion), ist es eine Brnsted-Lowry-Säure.
Das Nitrat-Ion basiert auf dem Salpetersäure-Molekül, also sagen wir, dass es die konjugierte Base von Salpetersäure ist. Ebenso ist das Ammoniumion die konjugierte Säure von Ammoniak. Zusammen wird eine Säure mit ihrer konjugierten Base (wie HNO3 und NO3-) oder eine Base mit ihrer konjugierten Säure (wie NH3 und NH4 +) als konjugiertes Säure-Base-Paar bezeichnet.
Lewis-Säuren und -Basen
In der Brnsted-Lowry-Definition von Säuren und Basen ist eine Base als eine Verbindung definiert, die ein Proton aufnehmen kann. Wie akzeptiert es jedoch das Proton?
Ein Merkmal, das Brnsted-Lowry-Basen miteinander gemeinsam haben, ist, dass sie ein nicht geteiltes Elektronenpaar haben. Wenn ein Hydronium-Ion durch das Molekül wandert, greifen manchmal die einsamen Paare nach ihm. Ein Beispiel dafür ist, wenn Ammoniak ein Proton in einer sauren Lösung akzeptiert:
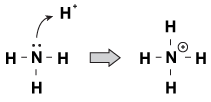
Abbildung 23.1Ammoniak kann mit seinem einsamen Elektronenpaar ein Proton aus Salpetersäure gewinnen.
Eine Möglichkeit, diesen Prozess zu betrachten, ist, dass das Ammoniakatom sein einsames Paar an das Proton spendet. Da die einsamen Paare diese chemische Reaktion antreiben, haben wir eine neue Definition von Acidität und Basizität, die als „Lewis-Acidität / Basizität“ bezeichnet wird.“ Eine Lewis-Base ist eine Verbindung, die ein Elektronenpaar an eine andere Verbindung (das Ammoniak in unserem Beispiel) abgibt. Eine Lewis-Säure ist eine Verbindung, die ein Elektronenpaar (in unserem Beispiel das H + -Ion) akzeptiert.
Lewis-Basen sind Chemikalien, die Elektronenpaare spenden können. Lewis-Säuren sind Chemikalien, die sie akzeptieren können.
Obwohl Ammoniak in unserem Beispiel ein einsames Paar an ein Proton spendet, kann das einsame Paar in Ammoniak auch mit vielen anderen Verbindungen reagieren. Zum Beispiel kann Ammoniak sein einsames Elektronenpaar durch den folgenden Prozess an BH3 spenden:

Abbildung 23.2Das einsame Elektronenpaar bindet sich an BH3.
In diesem Prozess ist Ammoniak die Lewis-Base und BH3 ist die Lewis-Säure.
Im Allgemeinen ist die Lewis-Definition von Säuren und Basen am nützlichsten, da sie die umfassendste der drei Definitionen ist. Zum Beispiel enthält die Brnsted-Lowry-Definition einer Säure HF, aber nicht BH3, das kein Proton verliert, wenn es durch die einsamen Paare an einer Lewis-Base gebunden wird.Auszug aus The Complete Idiot’s Guide to Chemistry 2003 von Ian Guch. Alle Rechte vorbehalten, einschließlich des Rechts der Vervielfältigung ganz oder teilweise in irgendeiner Form. Wird in Absprache mit Alpha Books, einem Mitglied der Penguin Group (USA) Inc., verwendet.
Um dieses Buch direkt beim Verlag zu bestellen, besuchen Sie die Penguin USA-Website oder rufen Sie 1-800-253-6476 an. Sie können dieses Buch auch kaufen unter Amazon.com und Barnes & Edel.
Leave a Reply