Biologie für die Hauptfächer I
Lernergebnisse
- Identifizieren Sie die Komponenten einfacher chemischer Reaktionen
Alle Elemente sind am stabilsten, wenn ihre äußerste Schale nach der Oktettregel mit Elektronen gefüllt ist. Dies liegt daran, dass es für Atome energetisch günstig ist, in dieser Konfiguration zu sein, und es macht sie stabil. Da jedoch nicht alle Elemente genügend Elektronen haben, um ihre äußersten Schalen zu füllen, bilden Atome chemische Bindungen mit anderen Atomen, wodurch die Elektronen erhalten werden, die sie benötigen, um eine stabile Elektronenkonfiguration zu erreichen. Wenn zwei oder mehr Atome chemisch miteinander verbunden sind, ist die resultierende chemische Struktur ein Molekül. Das bekannte Wassermolekül H2O besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom; Diese verbinden sich zu Wasser, wie in Abbildung 1 dargestellt. Atome können Moleküle bilden, indem sie Elektronen spenden, annehmen oder teilen, um ihre äußeren Schalen zu füllen.
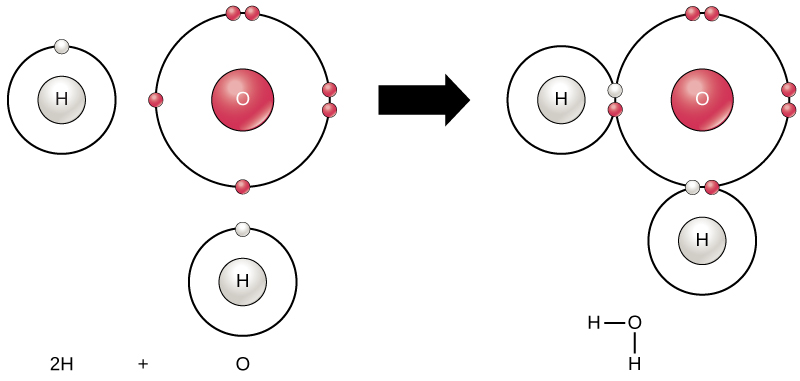
Abbildung 1. Zwei oder mehr Atome können sich miteinander verbinden, um ein Molekül zu bilden. Wenn zwei Wasserstoffatome und ein Sauerstoff Elektronen über kovalente Bindungen teilen, entsteht ein Wassermolekül.
Chemische Reaktionen treten auf, wenn sich zwei oder mehr Atome zu Molekülen verbinden oder wenn gebundene Atome auseinander gebrochen werden. Die Substanzen, die zu Beginn einer chemischen Reaktion verwendet werden, werden als Reaktanten bezeichnet (normalerweise auf der linken Seite einer chemischen Gleichung), und die Substanzen, die am Ende der Reaktion gefunden werden, werden als Produkte bezeichnet (normalerweise auf der rechten Seite einer chemischen Gleichung). Ein Pfeil wird typischerweise zwischen den Reaktanten und Produkten gezeichnet, um die Richtung der chemischen Reaktion anzuzeigen; Diese Richtung ist nicht immer eine „Einbahnstraße“.“ Für die Erzeugung des oben gezeigten Wassermoleküls wäre die chemische Gleichung:
2H + O → H2O
Ein Beispiel für eine einfache chemische Reaktion ist der Abbau von Wasserstoffperoxidmolekülen, die jeweils aus zwei Wasserstoffatomen bestehen, die an zwei Sauerstoffatome (H2O2) gebunden sind. Der Reaktant Wasserstoffperoxid wird in Wasser zerlegt, das ein Sauerstoffatom enthält, das an zwei Wasserstoffatome (H2O) gebunden ist, und Sauerstoff, der aus zwei gebundenen Sauerstoffatomen (O2) besteht. In der folgenden Gleichung umfasst die Reaktion zwei Wasserstoffperoxidmoleküle und zwei Wassermoleküle. Dies ist ein Beispiel für eine ausgewogene chemische Gleichung, wobei die Anzahl der Atome jedes Elements auf jeder Seite der Gleichung gleich ist. Nach dem Gesetz der Erhaltung der Materie sollte die Anzahl der Atome vor und nach einer chemischen Reaktion gleich sein, so dass unter normalen Umständen keine Atome erzeugt oder zerstört werden.
2H2O2 (Wasserstoffperoxid) → 2H2O(Wasser) + O2 (Sauerstoff)
Obwohl alle Reaktanten und Produkte dieser Reaktion Moleküle sind (jedes Atom bleibt an mindestens ein anderes Atom gebunden), sind in dieser Reaktion nur Wasserstoffperoxid und Wasser repräsentativ für eine Unterklasse von Molekülen, die als Verbindungen bekannt sind: Sie enthalten Atome von mehr als einer Art von Element. Molekularer Sauerstoff hingegen besteht, wie in Abbildung 2 gezeigt, aus zwei doppelt gebundenen Sauerstoffatomen und wird nicht als Verbindung, sondern als Element klassifiziert.
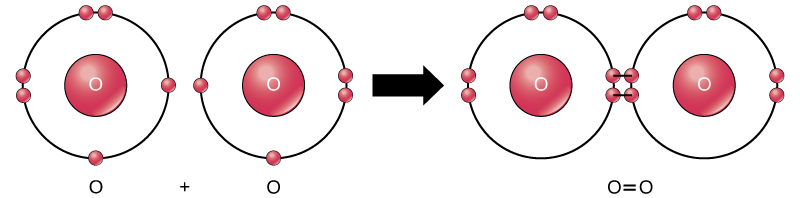
Abbildung 2. Die Sauerstoffatome in einem O2-Molekül sind durch eine Doppelbindung verbunden.
Einige chemische Reaktionen, wie die oben gezeigte, können in eine Richtung ablaufen, bis alle Reaktanten aufgebraucht sind. Die Gleichungen, die diese Reaktionen beschreiben, enthalten einen unidirektionalen Pfeil und sind irreversibel. Reversible Reaktionen sind solche, die in beide Richtungen gehen können. Bei reversiblen Reaktionen werden Reaktanten in Produkte umgewandelt, aber wenn die Konzentration des Produkts eine bestimmte Schwelle überschreitet (charakteristisch für die jeweilige Reaktion), werden einige dieser Produkte wieder in Reaktanten umgewandelt; An diesem Punkt sind die Bezeichnungen von Produkten und Reaktanten umgekehrt. Dieses Hin und Her setzt sich fort, bis ein gewisses relatives Gleichgewicht zwischen Reaktanten und Produkten eintritt — ein Zustand, der als Gleichgewicht bezeichnet wird. Diese Situationen reversibler Reaktionen werden oft durch eine chemische Gleichung mit einem Doppelpfeil bezeichnet, der sowohl auf die Reaktanten als auch auf die Produkte zeigt.
Zum Beispiel binden im menschlichen Blut überschüssige Wasserstoffionen (H+) an Bicarbonationen (HCO3–) und bilden einen Gleichgewichtszustand mit Kohlensäure (H2CO3). Wenn diesem System Kohlensäure zugesetzt würde, würde ein Teil davon in Bicarbonat und Wasserstoffionen umgewandelt.
HCO3– + H+ ↔ H2CO3
Bei biologischen Reaktionen wird jedoch selten ein Gleichgewicht erreicht, da sich die Konzentrationen der Reaktanten oder Produkte oder beider ständig ändern, wobei oft ein Produkt einer Reaktion ein Reaktant für einen anderen ist. Um zum Beispiel der überschüssigen Wasserstoffionen im Blut zurückzukehren, wird die Bildung von Kohlensäure die Hauptrichtung der Reaktion sein. Die Kohlensäure kann den Körper jedoch auch als Kohlendioxidgas (durch Ausatmen) verlassen, anstatt wieder in Bicarbonationen umgewandelt zu werden, wodurch die Reaktion durch das chemische Gesetz, das als Massenwirkungsgesetz bekannt ist, nach rechts getrieben wird. Diese Reaktionen sind wichtig für die Aufrechterhaltung der Homöostase unseres Blutes.
HCO3- + H+ ↔ H2CO3 ↔ CO2 + H2O
Zusammenfassend: Chemische Reaktionen und Moleküle
Die äußere Elektronenhülle bestimmt, wie schnell und welche Art von chemischen Bindungen ein bestimmtes Atom bilden wird. Die Bildung von Verbindungen wird oft visuell in chemischen Gleichungen skizziert, die die Reaktanten zeigen, die an chemischen Reaktionen teilnehmen, um Produkte zu bilden.
Probieren Sie es aus
Beitragen!
Diese Seite verbessernmehr erfahren
Leave a Reply