3.4: Rutherfords Experiment- Das nukleare Modell des Atoms
Atome und Gold
1911 initiierten Rutherford und seine Mitarbeiter Hans Geiger und Ernest Marsden eine Reihe bahnbrechender Experimente, die das akzeptierte Modell des Atoms vollständig verändern würden. Sie bombardierten sehr dünne Goldfolien mit sich schnell bewegenden Alphateilchen.



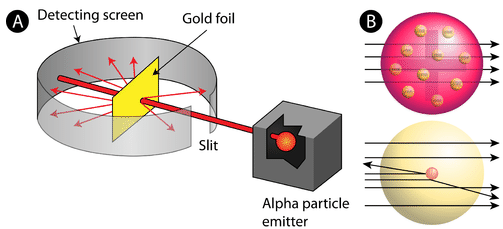
Abbildung \(\pageIndex{2}\) (A) Der Versuchsaufbau für Rutherfords Goldfolienexperiment: Ein radioaktives Element, das Alphateilchen emittierte, wurde auf ein dünnes Blatt Goldfolie gerichtet, das von einem Bildschirm umgeben war, der den Nachweis der abgelenkten Partikel ermöglichen würde. (B) Nach dem Plumpudding-Modell (oben) sollten alle Alphateilchen die Goldfolie mit geringer oder keiner Ablenkung passiert haben. Rutherford fand heraus, dass ein kleiner Prozentsatz der Alphateilchen in großen Winkeln abgelenkt wurde, was durch ein Atom mit einem sehr kleinen, dichten, positiv geladenen Kern in seiner Mitte (unten) erklärt werden konnte.
Nach dem akzeptierten Atommodell, bei dem Masse und Ladung eines Atoms gleichmäßig über das Atom verteilt sind, erwarteten die Wissenschaftler, dass alle Alphateilchen die Goldfolie mit nur geringer oder gar keiner Ablenkung passieren würden. Überraschenderweise prallte, wie in Abbildung \(\pageIndex {2}\) gezeigt (während die meisten Alphateilchen tatsächlich nicht reflektiert wurden, ein sehr kleiner Prozentsatz (etwa 1 von 8000 Teilchen) in sehr großen Winkeln von der Goldfolie ab. Einige wurden sogar zurück zur Quelle umgeleitet. Kein Vorwissen hatte sie auf diese Entdeckung vorbereitet. In einem berühmten Zitat rief Rutherford aus, es sei „als hätten Sie eine 15-Zoll-Granate auf ein Stück Gewebe abgefeuert und es kam zurück und traf Sie.“Rutherford musste ein völlig neues Modell des Atoms entwickeln, um seine Ergebnisse zu erklären. Da die überwiegende Mehrheit der Alphateilchen das Gold passiert hatte, argumentierte er, dass der größte Teil des Atoms leerer Raum war. Im Gegensatz dazu müssen die Teilchen, die stark abgelenkt wurden, eine enorm starke Kraft innerhalb des Atoms erfahren haben. Er kam zu dem Schluss, dass die gesamte positive Ladung und der Großteil der Masse des Atoms in einem sehr kleinen Raum im Inneren des Atoms konzentriert sein müssen, den er Kern nannte. Der Kern ist der winzige, dichte, zentrale Kern des Atoms und besteht aus Protonen und Neutronen.Rutherfords Atommodell wurde als nukleares Modell bekannt. Im Kernatom befinden sich die Protonen und Neutronen, die fast die gesamte Masse des Atoms ausmachen, im Kern im Zentrum des Atoms. Die Elektronen sind um den Kern verteilt und nehmen den größten Teil des Atomvolumens ein. Es lohnt sich zu betonen, wie klein der Kern im Vergleich zum Rest des Atoms ist. Wenn wir ein Atom von der Größe eines großen professionellen Fußballstadions in die Luft jagen könnten, wäre der Kern etwa so groß wie ein Marmor.Rutherfords Modell erwies sich als wichtiger Schritt zum vollständigen Verständnis des Atoms. Es ging jedoch nicht vollständig um die Art der Elektronen und die Art und Weise, wie sie den riesigen Raum um den Kern herum besetzten. Für diese und andere Erkenntnisse erhielt Rutherford 1908 den Nobelpreis für Chemie. Leider hätte Rutherford es vorgezogen, den Nobelpreis für Physik zu erhalten, weil er die Physik der Chemie überlegen sah. „Alle Wissenschaft ist entweder Physik oder Briefmarkensammeln.”
Leave a Reply