1.14: Unterscheidung zwischen pH und pKa
Relative Acidität und pKa-Werte
Eine Anwendung der Henderson-Hasselbach-Gleichung ist die Fähigkeit, die relative Acidität von Verbindungen durch Vergleich ihrer pKa-Werte zu bestimmen. Je stärker eine Säure ist, desto größer ist die Ionisation, desto niedriger ist die pKa und desto niedriger ist der pH-Wert, den die Verbindung in Lösung erzeugt. Einige ausgewählte pKa-Werte für Verbindungen in der Studie der organischen Chemie sind unten gezeigt. Da organische Reaktionen in nichtwässriger Umgebung durchgeführt werden können, kann der pH-Wert 14 überschreiten und organische Verbindungen können pKa-Werte über 16 aufweisen. Es ist eine Variation dieser Zeile aus dem Zauberer von Oz, „Wir leben nicht mehr im Wasser.“





Es ist eine sehr gute Idee, die ungefähren pKa-Bereiche der obigen Verbindungen in den Speicher zu übernehmen. Ein Wort der Vorsicht: achten Sie bei der Verwendung der pKa-Tabelle unbedingt darauf, dass Sie das richtige konjugierte Säure / Base-Paar in Betracht ziehen. Wenn Sie beispielsweise gebeten werden, etwas über die Basizität von Ammoniak (NH3) im Vergleich zu der von Ethoxidion (CH3CH2O-) zu sagen, sind die relevanten zu berücksichtigenden pKa-Werte 9, 2 (die pKa von Ammoniumion) und 16 (die pKa von Ethanol). Aus diesen Zahlen wissen Sie, dass Ethoxid die stärkere Base ist. Machen Sie nicht den Fehler, den pKa-Wert von 38 zu verwenden: Dies ist der pKa von Ammoniak, der als Säure wirkt, und sagt Ihnen, wie basisch das NH2-Ion ist (sehr basisch!)
* Ein Hinweis auf die pKa von Wasser: Der pKa von Wasser ist 14. In Texten der Biochemie und organischen Chemie wird der Wert häufig mit 15.7 angegeben. Diese Texte haben den molaren Wert für die Konzentration von Wasser fälschlicherweise in die Gleichgewichtskonstante einkalkuliert. Die korrekte Ableitung der Gleichgewichtskonstante beinhaltet die Aktivität von Wasser, das einen Wert von 1 hat.
Beispiel
Während dieser Kurs mit einzelnen funktionellen Gruppen beginnt, werden wir schließlich mit interessanten Verbindungen arbeiten, die mehrere funktionelle Gruppen enthalten. Zu erkennen, welche Wasserstoffatome als saure Protonen ionisiert werden können und welche NICHT, ist eine nützliche Fähigkeit. Beachten Sie in diesem Beispiel, dass wir den potenziellen Säuregehalt an vier verschiedenen Stellen des Moleküls bewerten müssen.
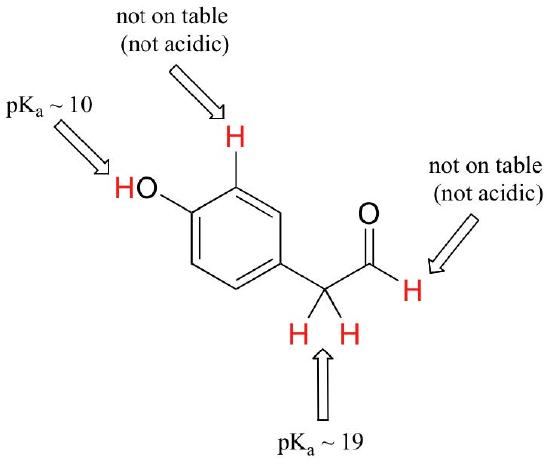
Aldehyd und aromatische Protonen sind überhaupt nicht sauer (PKAWERTE liegen über 40 – nicht auf unserem Tisch). Die beiden Protonen auf dem Kohlenstoff neben dem Carbonyl sind leicht sauer, mit pKa-Werten um 19-20 gemäß der Tabelle. Wenn also die Verbindung einem einzigen molaren Äquivalent einer starken Base ausgesetzt würde, wäre dies das Proton, das gespendet würde.
Sauer & Grundlegende Umgebungen – Alles ist relativ in der Reaktivität
Da unser Ziel darin besteht, die dynamische chemische Reaktivität zu verstehen, müssen wir die spezifische Menge der protonierten und unprotonierten Formen einer Verbindung NICHT kennen. Wir müssen nur wissen, welche Form vorherrscht. Wenn der pH-Wert der Umgebung kleiner als der pKa der Verbindung ist, wird die Umgebung als sauer angesehen und die Verbindung existiert überwiegend in ihrer protonierten Form. Wenn der pH-Wert der Umgebung größer als der pKa der Verbindung ist, wird die Umgebung als basisch betrachtet und die Verbindung wird überwiegend in ihrer deprotonierten Form vorliegen.
Zum Beispiel beträgt die pKa von Essigsäure etwa 5. Bei einem pH-Wert von 1 gilt die Umgebung als sauer und Essigsäure liegt überwiegend in ihrer protonierten Form vor. Bei pH 8 gilt die Umgebung als basisch und Essigsäure wird deprotoniert, um Acetat (CH3CO2-) zu bilden. Umgekehrt beträgt die pKa von Phenol 10. Bei pH 8 gilt die Umgebung für Phenol als sauer und bleibt hauptsächlich protoniert.
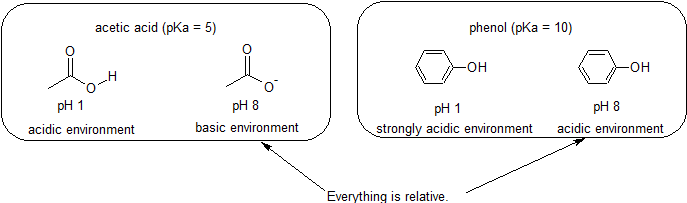
Es ist auch wichtig, sich daran zu erinnern, dass organische Chemie NICHT in Wasser vorkommen muss, so dass pKa-Werte bis zu 50 betragen können.
Übung
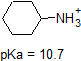
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
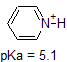 |
|||
 |
|||
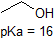 |
|||
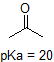 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
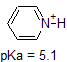 |
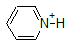 |
 |
 |
 |
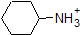 |
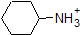 |
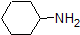 |
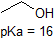 |
 |
 |
 |
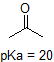 |
 |
 |
 |
Leave a Reply