Porovnání Silných Oxidantů a redukčních činidel
Vzdělávací Cíle
- Určit, jak chcete zobrazit Standardní Redukční Potenciál z hlediska životaschopné, redukční a oxidační činidla v REDOX reakce.
můžeme měřit standardní potenciály pro širokou řadu chemických látek, z nichž některé jsou uvedeny v Tabulce P2. Tyto údaje nám umožňují porovnat oxidační a redukční síly různých látek. Poloviční reakce pro standardní vodíkovou elektrodu (SHE) leží více než v polovině seznamu v tabulce \(\PageIndex{1}\). Všechny reaktanty, které leží pod SHE v tabulce, jsou silnější oxidanty než H+ a všechny, které leží nad SHE, jsou slabší. Nejsilnější antioxidant v tabulce je F2, standardní elektrodový potenciál 2,87 V. Tato vysoká hodnota je v souladu s elektronegativitu fluoru a říká nám, že fluor má silnější tendenci přijímat elektrony (to je silnější oxidant), než jakýkoli jiný prvek.
| Half-Reaction | E° (V) |
|---|---|
| Li+(aq) + e− \(\rightleftharpoons\) Li(s) | –3.040 |
| Be2+(aq) + 2e− \(\rightleftharpoons\) Be(s) | –1.99 |
| Al3+(aq) + 3e− \(\rightleftharpoons\) Al(s) | –1.676 |
| Zn2+(aq) + 2e− \(\rightleftharpoons\) Zn(s) | –0.7618 |
| Ag2S(s) + 2e− \(\rightleftharpoons\) 2Ag(s) + S2−(aq) | –0.71 |
| Fe2+(aq) + 2e− \(\rightleftharpoons\) Fe(s) | –0.44 |
| Cr3+(aq) + e− \(\rightleftharpoons\) Cr2+(aq) | –0.424 |
| Cd2+(aq) + 2e− \(\rightleftharpoons\) Cd(s) | –0.4030 |
| PbSO4(s) + 2e− \(\rightleftharpoons\) Pb(s) + SO42−(aq) | –0.356 |
| Ni2+(aq) + 2e− \(\rightleftharpoons\) Ni(s) | –0.257 |
| 2SO42−(aq) + 4H+(aq) + 2e− \(\rightleftharpoons\) S2O62−(aq) + 2H2O(l) | –0.25 |
| Sn2+(aq) + 2e− \(\rightleftharpoons\) Sn(s) | −0.14 |
| 2H+(aq) + 2e− \(\rightleftharpoons\) H2(g) | 0.00 |
| Sn4+(aq) + 2e− \(\rightleftharpoons\) Sn2+(aq) | 0.154 |
| Cu2+(aq) + e− \(\rightleftharpoons\) Cu+(aq) | 0.159 |
| AgCl(s) + e− \(\rightleftharpoons\) Ag(s) + Cl−(aq) | 0.2223 |
| Cu2+(aq) + 2e− \(\rightleftharpoons\) Cu(s) | 0.3419 |
| O2(g) + 2H2O(l) + 4e− \(\rightleftharpoons\) 4OH−(aq) | 0.401 |
| H2SO3(aq) + 4H+(aq) + 4e− \(\rightleftharpoons\) S(s) + 3H2O(l) | 0.45 |
| I2(s) + 2e− \(\rightleftharpoons\) 2I−(aq) | 0.5355 |
| MnO42−(aq) + 2H2O(l) + 2e− \(\rightleftharpoons\) MnO2(s) + 4OH−(aq) | 0.60 |
| O2(g) + 2H+(aq) + 2e− \(\rightleftharpoons\) H2O2(aq) | 0.695 |
| H2SeO3(aq) + 4H+ + 4e− \(\rightleftharpoons\) Se(s) + 3H2O(l) | 0.74 |
| Fe3+(aq) + e− \(\rightleftharpoons\) Fe2+(aq) | 0.771 |
| Ag+(aq) + e− \(\rightleftharpoons\) Ag(s) | 0.7996 |
| NO3−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) HNO2(aq) + H2O(l) | 0.94 |
| Br2(aq) + 2e− \(\rightleftharpoons\) 2Br−(aq) | 1.087 |
| MnO2(s) + 4H+(aq) + 2e− \(\rightleftharpoons\) Mn2+(aq) + 2H2O(l) | 1.23 |
| O2(g) + 4H+(aq) + 4e− \(\rightleftharpoons\) 2H2O(l) | 1.229 |
| Cr2O72−(aq) + 14H+(aq) + 6e− \(\rightleftharpoons\) 2Cr3+(aq) + 7H2O(l) | 1.36 |
| Cl2(g) + 2e− \(\rightleftharpoons\) 2Cl−(aq) | 1.396 |
| \(Ce^{4+}(aq) + e^− \rightleftharpoons Ce^{3+}(aq)\) | 1.44 |
| PbO2(s) + HSO4−(aq) + 3H+(aq) + 2e− \(\rightleftharpoons\) PbSO4(s) + 2H2O(l) | 1.690 |
| H2O2(aq) + 2H+(aq) + 2e− \(\rightleftharpoons\) 2H2O(l) | 1.763 |
| F2(g) + 2e−\(\rightleftharpoons\) 2F−(aq) | 2.87 |
Ne všechny oxidační činidla a redukční zařízení jsou stvořeni sobě rovni. Standardní redukční potenciály v tabulce \(\PageIndex{1}\) lze interpretovat jako pořadí látek podle jejich oxidační a redukční síly. Silná oxidační činidla jsou obvykle sloučeniny s prvky ve vysokých oxidačních stavech nebo s vysokou elektronegativitu, které získávají elektronů v redoxní reakci (Obrázek \(\PageIndex{1}\)). Příklady silných oxidačních činidel zahrnují peroxid vodíku, manganistan a tetroxid osmium. Redukční činidla jsou obvykle elektropozitivní prvky, jako je vodík, lithium, sodík, železo a hliník, které při redoxních reakcích ztrácejí elektrony. Hydridy (sloučeniny, které obsahují vodík v formální oxidační stav -1), jako např. hydrid sodný, sodium borohydride a lithia, hliníku, hydrid, se často používají jako redukční činidla v organické a organokovové reakce.
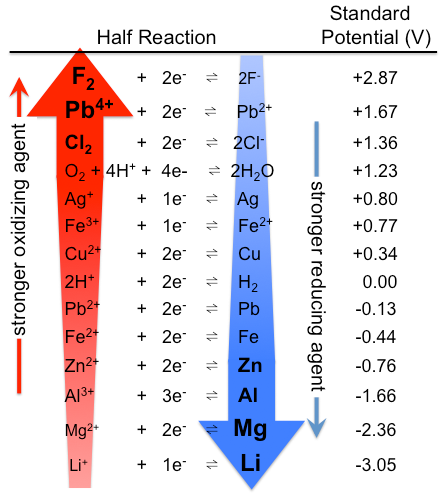
Obrázek \(\PageIndex{1}\): Tabulka standardní elektrodové potenciály. Všimněte si, že pořadí je zde opačné, se silnými oxidačními činidly nahoře a silnými redukčními činidly dole, než v tabulce \(\PageIndex{1}\). Skutečně standardní potenciály jsou samozřejmě stejné. (CC BY – SA 3.0; Tem5psu).
Podobně, všechny druhy, v Tabulce \(\PageIndex{1}\), které leží nad H2 jsou silnější redukčních činidel než H2, a ty, které leží níže H2 jsou slabší. Nejsilnější reduktant v tabulce je tedy kovové lithium, standardní elektrodový potenciál -3.04 V. Tato skutečnost může být překvapující, protože cesium, lithium není, je nejméně elektronegativní prvek. Zdánlivou anomálii lze vysvětlit tím, že elektrodové potenciály jsou měřeny ve vodném roztoku, kde mezimolekulární interakce jsou důležité, vzhledem k tomu, ionizační potenciály a elektronové afinity jsou měřeny v plynné fázi. Díky své malé velikosti je ion Li+ stabilizován ve vodném roztoku silnými elektrostatickými interakcemi s negativním dipólovým koncem molekul vody. Tyto interakce mají za následek významně větší Δhhydrataci pro Li + ve srovnání s Cs+. Lithný kov je proto nejsilnějším redukčním činidlem (nejsnadněji oxidovaným) alkalických kovů ve vodném roztoku.
standardní redukční potenciály lze interpretovat jako pořadí látek podle jejich oxidační a redukční sílu. Druhy v tabulce \(\PageIndex{1}\), které leží nad H2, jsou silnější redukční činidla (snadněji oxidovaná) než H2. Druhy, které leží pod H2, jsou silnější oxidační činidla.
Protože polovina-reakce je uvedeno v Tabulce \(\PageIndex{1}\), jsou uspořádány v pořadí jejich E° hodnoty, můžeme použít tabulku, jak rychle odhadnout relativní sílu různých oxidantů a redukčních činidel. Jakýkoli druh na levé straně poloviční reakce spontánně oxiduje jakýkoli druh na pravé straně další poloviční reakce, která leží pod ní v tabulce. Naopak, jakýkoli druh na pravé straně poloviční reakce spontánně sníží jakýkoli druh na levé straně další poloviční reakce, která leží nad ní v tabulce. Můžeme používat tyto zobecnění předvídat spontánnost širokou řadu redoxních reakcí (E°buňka > 0), jak je znázorněno v Příkladu \(\PageIndex{1}\).
Například \(\PageIndex{1}\): Síran Stříbrný
černá zakalit, který se tvoří na stříbrných předmětů je především Ag2S. Půl reakce pro couvání poškozuje proces je následující:
- s Odkazem na Tabulku \(\PageIndex{1}\), předvídat, které druhy—H2O2(aq), Zn(s), I−(aq), Sn2+(aq)—může snížit Ag2S na Ag za standardních podmínek.
- těchto druhů—H2O2(aq), Zn(s), I−(aq), Sn2+(AQ), určete, které je nejsilnějším redukčním činidlem ve vodném roztoku, a tedy nejlepším kandidátem na komerční produkt.
- Z údajů v Tabulce \(\PageIndex{1}\), navrhnout alternativní redukční činidlo, které je snadno dostupné, levné, a možná účinnější v odstraňování skvrn.

Vzhledem k tomu,: snížení půl-reakce, standardní elektrodový potenciál, a seznam možných redukčních činidel
Žádal: redukčních činidel pro Ag2S, nejsilnější reductant, a potenciál redukční činidlo pro odstraňování skvrn,
Strategie:
Z jejich pozice v Tabulce \(\PageIndex{1}\), rozhodnout, které druhy mohou snížit Ag2S. Určit, který druh je nejsilnější reduktant.
B Použijte Tabulku \(\PageIndex{1}\) k identifikaci reduktant pro Ag2S, který je společnou domácnost produktu.
řešení
problém můžeme vyřešit jedním ze dvou způsobů: (1) porovnejte relativní pozice ze čtyř možných redukčních činidel s Ag2S/Ag pár v Tabulce \(\PageIndex{1}\), nebo (2) porovnat E° pro každý druh s E° pro Ag2S/Ag pár (-0.69 V).
- druhy v Tabulce \(\PageIndex{1}\) jsou uspořádány od shora dolů v pořadí rostoucí snížení pevnosti. Ze čtyř druhů uvedených v problému leží I−(aq), Sn2+(aq) a H2O2(AQ) nad Ag2S a jeden leží pod ním. Můžeme tedy dojít k závěru, že Zn(s) může snížit Ag2S(s) za standardních podmínek, zatímco I−(aq), Sn2+(aq) a H2O2(aq) nemohou. Sn2+(aq) a H2O2(aq), se objeví dvakrát v tabulce: na levé straně (oxidant) v jedné polovině-reakce a na pravé straně (reduktant) v jiném.
- nejsilnější reduktant je Zn(s), druhy na pravé straně poločas reakce, které leží blíže ke dnu Tabulky \(\PageIndex{1}\), než poločas reakce, zahrnující I−(aq), Sn2+(aq) a H2O2(aq). (Komerční produkty, které používají kus zinku, jsou často uváděny na trh jako „zázračný produkt“ pro odstranění skvrn ze stříbra. Vše, co je potřeba, je přidat teplou vodu a sůl pro elektrickou vodivost.)
- B redukčních činidel, které leží pod Zn(s) v Tabulce \(\PageIndex{1}\), a proto jsou silnější redukčních činidel, pouze jedna je běžně dostupné v domácnosti výrobky: Al(s), který je prodáván jako hliníkové fólie pro balení potravin.
příklad \(\PageIndex{2}\):
Použít data v Tabulce \(\PageIndex{1}\) k určení, zda každá reakce je pravděpodobné, že se vyskytují spontánně za standardních podmínek:
- Sn(s) + Be2+(aq) → Sn2+(aq) + Být(s)
- MnO2(s) + H2O2(aq) + 2H+(aq) → O2(g) + Mn2+(aq) + 2H2O(l)
Vzhledem k tomu,: redoxní reakce a seznam standardní elektrodové potenciály (Tabulka P2 )
Žádal: reakce spontánnosti,
Strategie:
- Identifikovat half-reakce v každé rovnici. Pomocí tabulky \(\PageIndex{1}\) Určete standardní potenciály pro poloviční reakce v příslušném směru.
- použijte rovnici \(E_{cell}=e^O_{srp}(katoda) – E^O_{srp}(anoda)\) pro výpočet standardního buněčného potenciálu pro celkovou reakci. Z této hodnoty určete, zda je celková reakce spontánní.
Řešení
- Kovový cín se oxiduje na Sn2+(aq), a Be2+(aq) je redukován na elementární beryllium. Můžeme najít standardní elektrodové potenciály pro druhou (redukční) poloviční reakci (-1.85 V) a pro bývalý (oxidace) poločas reakce, (-0.14 V) přímo z Tabulky \(\PageIndex{1}\) .
B Přidá dvě poloviny-reakce dává celková reakce:
|
\(\textrm{katoda:} \; \mathrm{Být^{2+}(aq)} +\mathrm{2e^-} \rightarrow \mathrm {(y)}\) \(\textrm{anoda:} \; \mathrm{Sn(s) \rightarrow \mathrm{Sn^{2+}}(s)} +\mathrm{2e^-} \) \(\textrm{celkem:} \; \mathrm{Sn(s)+ \mathrm{Být^{2+}(aq)} \rightarrow \mathrm{Sn^{2+}}(aq)} + \mathrm {(y)}\) |
\(E^\circ_{\textrm{katody}}=\textrm{-1.99 V} \\ E^\circ_{\textrm{anoda}}=\textrm{-0.14 V} \\ E^\circ_{\textrm{buňka}}=E^\circ_{\textrm{katody}}-E^\circ_{\textrm{anoda}} \\ \hspace{5mm} =-\textrm{1.85 V}\) |
standardní potenciál buňky je velmi negativní, takže reakce nebude probíhat spontánně, jak je psáno. To znamená, že kovový cín nemůže za standardních podmínek redukovat Be2+ na beryliový kov. Místo toho bude spontánně probíhat reverzní proces, redukce stannousových iontů (Sn2+) kovovým beryliem, které má kladnou hodnotu buňky E°.
- MnO2 je oxidant (Mn4+ je redukován na Mn2+), zatímco H2O2 je reduktant (O2− se oxiduje na O2). Standardní elektrodové potenciály pro redukční a oxidační poloreakce můžeme získat přímo z tabulky \(\PageIndex{1}\) .
B dvě poloviční reakce a jejich odpovídající potenciály jsou následující:
| \(\begin{align}\textrm{cathode:} & \mathrm{MnO_2(s)}+\mathrm{4H^+(aq)}+\mathrm{2e^-}\rightarrow\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)} \\ \textrm{anode:} & \mathrm{H_2O_2(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{2H^+(aq)}+\mathrm{2e^-} \\ \textrm{overall:} & \mathrm{MnO_2(s)}+\mathrm{H_2O_2(aq)}+\mathrm{2H^+(aq)}\rightarrow\mathrm{O_2(g)}+\mathrm{Mn^{2+}(aq)}+\mathrm{2H_2O(l)}\end{align}\) |
\(E^\circ_{\textrm{cathode}}=\textrm{1.22 V} \\ E^\circ_{\textrm{anoda}}=\textrm{0.70 V} \\ E^\circ_{\textrm{buňka}}=E^\circ_{\textrm{katody}}-E^\circ_{\textrm{anoda}} \\ \hspace{5mm} =-\textrm{0.53 V}\) |
standardní potenciál reakce je pozitivní, což naznačuje, že za standardních podmínek, to nastane spontánně, jak je psáno. Peroxid vodíku sníží MnO2 a z roztoku se vyvine kyslíkový plyn.
Cvičení \(\PageIndex{2}\)
Použít data v Tabulce \(\PageIndex{1}\) k určení, zda každá reakce je pravděpodobné, že se vyskytují spontánně za standardních podmínek:
- 2Ce4+(aq) + 2Cl−(aq) → 2Ce3+(aq) + Cl2(g)
- 4MnO2(s) + 3O2(g) + 4OH−(aq) → 4MnO4−(aq) + 2H2O
Odpovědět
- spontánní (E°buňka = 0.36 V.)
- nonspontaneous (E°buňka = -0.20 V)
i když znamení E°buněk nám říká, zda konkrétní redoxní reakce bude probíhat samovolně za standardních podmínek, to nám neříká, v jakém rozsahu reakce probíhá, a to nám neříká, co se stane za nestandardních podmínek. Odpovědět na tyto otázky vyžaduje kvantitativní pochopení vztahu mezi elektrochemický potenciál buňky a chemické termodynamiky.
souhrn
relativní síly různých oxidantů a redukčních činidel lze předpovědět pomocí hodnot e°. Oxidační a redukční síly různých látek lze porovnat pomocí standardních elektrodových potenciálů. Zjevné anomálie lze vysvětlit skutečností, že elektrodové potenciály jsou měřeny ve vodném roztoku, což umožňuje silné intermolekulární elektrostatické interakce, a nikoli v plynné fázi.
Koncepční Problémy
- pořadí elektrodové potenciály nelze vždy předvídat tím, ionizační potenciály a elektronové afinity. Proč? Očekáváte, že sodíkový kov bude mít vyšší nebo nižší elektrodový potenciál, než se předpokládalo z jeho ionizačního potenciálu? Jaký je jeho přibližný elektrodový potenciál?
- bez odkazu na tabulková data, Br2 / Br -, Ca2+ / Ca, O2 / OH-a Al3+ / Al, které byste očekávali, že budou mít nejmenší záporný elektrodový potenciál a které nejvíce negativní? Proč?
- Protože síru obsahující aminokyseliny přítomné v vaječných bílků, jíst vejce s stříbrnou vidličku bude zakalit vidlice. Jako chemik máte ve skříni všechny druhy zajímavých čisticích prostředků, včetně 1 M roztoku kyseliny šťavelové (H2C2O4). Vybrali byste si toto řešení, abyste vyčistili vidličku, kterou jste poskvrnili z jídla míchaných vajec?
- elektrodový potenciál pro reakci Cu2+(aq) + 2e− → Cu(S) je za standardních podmínek 0,34 V. Je potenciál oxidace 0,5 mol Cu roven -0,34/2 V? Vysvětlete svou odpověď.
- Viz Tabulka \(\PageIndex{1}\) předvídat
- Které druhy—Sn4+(aq), Cl−(aq) Ag+(aq), Cr3+(aq), a/nebo H2O2(aq)—může oxidovat MnO2(s) MNO4− za standardních podmínek.
- které druhy—Sn4+(aq), Cl−(AQ), Ag+(AQ), Cr3+(aq) a/nebo H2O2(AQ)—jsou nejsilnějším oxidačním činidlem ve vodném roztoku.
koncepční odpověď
- ne; e° = -0.691 V for Ag2S(s) + 2e− → Ag(s) + S2−(aq), which is too negative for Ag2S to be spontaneously reduced by oxalic acid
- Ag+(aq); H2O2(aq)
- H2O2(aq)
Leave a Reply