vilket är det mest reaktiva elementet i det periodiska systemet?
Fluor identifieras som det mest reaktiva icke-metalliska och det mest elektronegativa elementet i det periodiska systemet, vilket gör det till det starkaste oxidationsmedlet. Cesium är den mest reaktiva metallen i det periodiska bordet, så mycket att arbetet med denna metall ofta slutar i explosioner!
Vad sa en kemist till en annan när han fann honom upprörd? ”Varför är du natrium bekymrad? Jag tror att du överreagerar!”Se vad jag gjorde där? Ibland undrar jag varför-trots min munterhet-jag tycker att det är riktigt svårt att få vänner…
hur som helst, förutom mina dåliga betyg, det första som kommer att tänka på när jag tänker på kemi är labbrockar, konstigt formade kärl, som om reflektioner från karnevalspeglar och flammande explosioner. Då och då mumlar någon ”reaktion” eller ”reaktivitet”, termer så allestädes närvarande att du hittar dem infiltrera kemiböcker till deras allra sista sida. Det är precis vad vi sysslar med just nu.

saknar teknisk jargong, en ”reaktion” är exakt vad det betyder, ett svar. Reaktivitet kan å andra sidan definieras som måttet på hur lätt en kemisk art kommer att delta i en reaktion och bilda kemiska bindningar. Så blir frågan – vilket element är det enklaste att uppmana? Men först…
vad bestämmer reaktiviteten hos ett element?
enkelt uttryckt är en kemisk reaktion det perfekta tillfället för köpare och säljare att köpa och sälja varor. Köpare och säljare är kemiska element. Varorna är elektroner och valutan som byts ut är energi.
syftet med denna handel är att uppnå stabilitet, en optimal konfiguration av elektroner, vilket uppnås när antingen ett Elements Valens (yttersta) skal är helt fyllt eller tömt. I grund och botten kan ett element köpa fler elektroner för att fylla sitt näst sista skal eller sälja dem för att tömma det.

ju färre elektroner som är involverade, desto mindre energikostnad. Den som är bekant med naturens parsimoniska sätt att fungera kommer att gissa att affärer som kräver minst energi är de som sannolikt kommer att inträffa. Detta är vettigt, eftersom ett element föredrar att förlora elektroner och göra sig tomt om dess yttersta skal är mindre än halvfylld, eller få lite att fylla sig själv, om det är mer än halvfylld. Att köpa sex när du helt enkelt kan förlora två skulle vara helt dumt, men ännu viktigare, dyrt!
således är reaktivitet en funktion av hur lätt ett element förlorar eller får elektroner.
hur uppskattar vi ett Elements incitament?
det periodiska systemet och dess”trender”
Hur får vi reda på om ett element är en köpare eller säljare? Vi hänvisar till det periodiska systemet.
det periodiska systemet är en påminnelse om att forskare är gränsöverskridande OCD och inte kan låta bli att organisera allt på ett extremt snyggt och ordnat sätt. Det periodiska systemet organiserar varje element vi känner till på ett samlokaliserat sätt.
tabellen ordnar element enligt deras atomnummer, vilket är samma som antalet protoner eller elektroner som de omfattar. (Är det inte konstigt att de tenderar att vara exakt samma?)
Trend 1
antalet elektroner i valensskalet ökar med en när vi analyserar genom varje element i rad, även om antalet skal förblir detsamma. Antalet skal kan härledas från radnumret. Till exempel innehåller varje element i den andra raden bara två skal och så vidare.
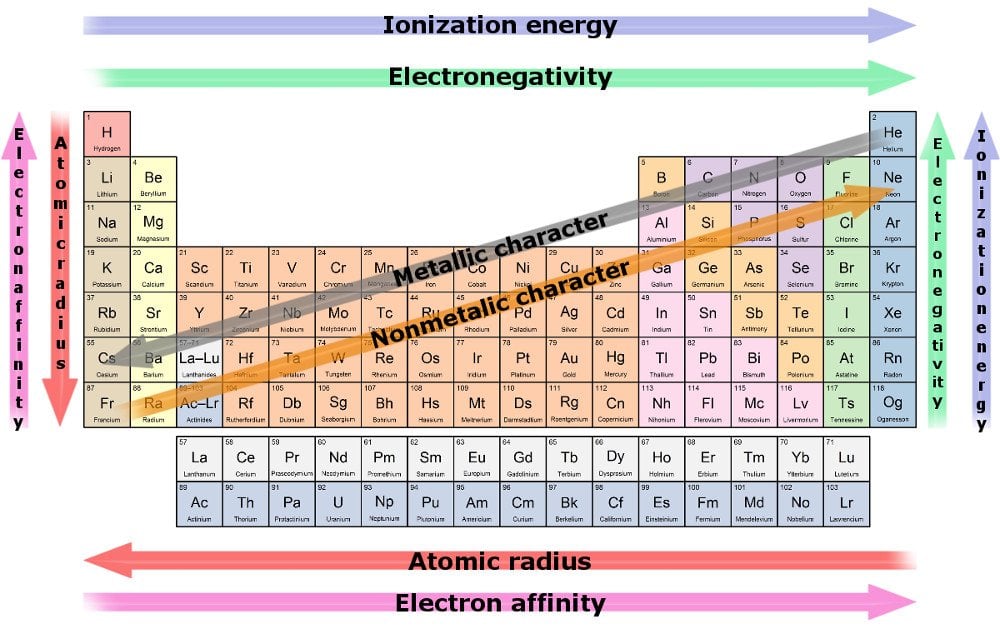
en följd av denna trend är att atomradie minskar när vi går mot en rads sista invånare. Anledningen är att ökningen av elektroner speglas av ökningen av protoner i mitten, medan den förra måste klämma in i samma skal. I tug-o ’ – kriget mellan dragprotonerna och de inkrementerande elektronerna vinner den förra, vilket resulterar i en större kärnkraftsattraktion och drar alla sina skal närmare den.
på grund av ett starkt drag av attraktion är det därför mer troligt att ett element köper eller får elektroner när vi rör oss längs en rad. Måttet på ett Elements förmåga att dra elektroner mot det kallas elektronegativitet. Det mest elektronegativa elementet är det mest troliga att stjäla elektroner och reagera snabbast.
Trend 2
en annan trend är ökningen av elementens radie när vi flyttar ner en kolumn, medan antalet valenselektroner förblir detsamma, även om atomnumret fortsätter att öka. Detta beror på att ökningen av elektroner är parallell med en ökning av skal. Tungmetaller har en ökad radie, särskilt de på yttersta botten. De illustrerar den fattigaste kärnkraftsattraktionen och har följaktligen ett dåligt grepp om sina yttersta elektroner.

måttet på ett Elements förmåga att förlora elektroner kallas elektropositivitet, och det ökar när vi flyttar ner en kolumn. Återigen är det mest elektropositiva elementet det som mest sannolikt ger upp sina elektroner och reagerar snabbast.
nu när vi känner till reglerna, låt oss avslöja vinnarna.
mest reaktiva icke – metall-Fluor
fluor är det första elementet i halogengruppen. Det är en ljusgul, diatomisk, mycket frätande, brandfarlig gas med en skarp lukt. Dess atomnummer är 9 och har en jam-packad 7 elektroner i sitt valensskal. Dessutom ligger den i den andra raden, vilket innebär att alla dess 9 elektroner på något sätt är proppade i endast 2 skal.
ett 7-elektronvalensskal kräver att det bara får en enda elektron för att slutföra sitt slutliga skal och uppnå stabilitet, vilket inte är en stor prestation när man överväger sin lilla storlek och kraftfulla kärnkraft. Fluor identifieras som det mest elektronegativa elementet i det periodiska systemet, vilket gör det till det starkaste oxidationsmedlet. Det är den mest reaktiva icke-metallen.

fluor är så reaktivt att det kan bränna ämnen som man i allmänhet skulle tänka på som icke brandfarliga! Det kan bränna glas, vatten och jämn sand! Dess promiskuitet gör det omöjligt att lagra eller isolera den i sin renaste form. På grund av sin vilda reaktivitet är dess tidiga historia av isolering och experiment fylld med dödsolyckor. Ja … dödlig.
mest reaktiva metall – cesium
cesium är en guldfärgad metall som reagerar explosivt med luft och vatten. Dess atomnummer är 55. Cesium finns i den första kolumnen och den andra till sista raden. Som vi har diskuterat är radien för ett element så lågt i kolumnen ganska stor jämfört med elementen ovan.

(Fotokredit : Dnn87 / Wikimedia Commons)
den stora radien gör sin kärnkraft ineffektiv och gör den väldigt klumpig. Dess stora storlek gör den mycket mottaglig för jonisering. Det är mycket acquiescent och ger lätt upp den enda elektronen i sitt valensskal för att uppnå stabilitet, vilket gör det mycket reaktivt. Cesium är den mest reaktiva metallen i det periodiska bordet, så mycket att arbetet med denna metall ofta slutar i explosioner!
Francium
Francium är det sista elementet i den första kolumnen, som sitter precis under cesium, vilket gör den till den största atomen i kolumnen. Logiskt sett skulle man dra slutsatsen att Francium måste ha en överlägsen reaktivitet jämfört med cesium, men det är inte fallet.
det uppskattas att det inte finns mer än en uns av det i jordskorpan åt gången. Eftersom det är så knappt naturligt måste forskare producera det för att studera det.

( Fotokredit : MarlonMarin1 / Wikimedia Commons)
men även när det på något sätt är isolerat håller det inte så länge. Francium är radioaktivt i naturen, med en halveringstid på bara 22 minuter, så det sönderfaller innan det får en chans att reagera! Dessutom orsakar närvaron av så många protoner att dess elektroner rör sig med otroligt höga hastigheter. Som Einstein insåg, på skalor så små och hastigheter så höga, börjar konstiga saker inträffa — elektronerna snugglar lite närmare kärnan än man logiskt skulle förvänta sig, vilket gör dem lite svårare att bli av med.
så det verkar som att Francium är det mest reaktiva elementet, tyvärr teoretiskt.
Spoiler varning!
du kanske har märkt att de två elementen som anses vara de mest reaktiva endast är vinnare i deras specifika kategorier — metaller och icke-metaller. Ledsen att vara en buzzkill, men det finns inget definitivt svar på vem-är-det-mest-reaktiva-elementet-bland-alla, eftersom det tar två till tango.
man kan fråga vilket element som är mest reaktivt med natrium? Svaret är då Fluor, inte cesium. Eller kanske du vill veta vilket element som är mest reaktivt med kväve. Dess Litium! Shocker!
termen reaktivitet tolkas ofta notoriskt felaktigt. Frågan är tvetydig och något ofullständig, som den här artikeln förhoppningsvis visar.
Leave a Reply