natriumhydroxid
natriumhydroxid kemiska egenskaper, användningsområden, produktion
kemiska egenskaper
natriumhydroxid är ett vitt, luktfritt, icke-flyktigt alkaliskt material som marknadsförs i fast form som pellets, flingor, klumpar eller pinnar. Dess löslighet i vatten är 111 viktprocent och ett ångtryck på 0mmHg (NIOSH, 1994).
det kan reagera med trikoloetylen (TCE) för att bilda brandfarlig dikloracetylen och med metaller för att bilda vätgas (OEHHA, 1993). Dess reaktivitet med metaller bör beaktas när det gäller lagringsenheter och behållare.
natriumhydroxid är allmänt tillgänglig som en vattenlösning som kallas kaustisk soda, läsklut eller enkel som lut. Det har olika användningsområden, inklusive neutralisering av syra; tillverkning av papper, textilier, plast, korrosiva, färgämnen, färg, färgborttagare och tvål; raffinering av petroleum; galvanisering; metallrengöring; tvätt; och disktvätt. En spirande användning har varit i olaglig tillverkning av metamfetamin.
använder
natriumhydroxid (NaOH) är en av de mest användbara industriella natriumföreningarna. Denär också känd som lut eller kaustisk soda och är en av de starkaste basalkalierna (högt pH-värde)på hushållsmarknaden. Det används som avlopps-och ugnsrengörare, och det förtvålar fetter itillverkning av tvål. Det måste användas med försiktighet eftersom det också kan producera allvarligahudbrännskador.
beskrivning
natriumhydroxid, även känd som lut och kaustisk soda, är en mycket kaustisk substans som används används i små mängder i kosmetika för att fastställa och hålla pH för en produkt.Natriumhydroxid är en extremt viktig förening i våra liv eftersom den har så många användningsområden. Det är en mycket vanlig bas som används inom kemisk industri och används för många saker, varav många förekommer i vårt dagliga liv. En av de mest kända användningarna av natriumhydroxid är dess användning i unclogging avlopp. Den finns i många olika märken av avloppsrengöringsmedel, men en av de vanligaste är Drano. Det kommer också i form av lutsåpe som kan användas för att tvätta praktiskt taget vad som helst, från disken till ansiktet.
natriumhydroxidstruktur
vid rumstemperatur är natriumhydroxid ett vitt kristallint luktfritt fast ämne som absorberar fukt från luften. Det är en tillverkad substans. Natriumhydroxid är en oorganisk förening som används för att kontrollera pH-nivåerna eller fungera som ett buffertmedel i kosmetika och personliga hygienprodukter. Det användes historiskt i formuleringen av tvålar, men ses för närvarande i en mängd olika formler, inklusive badprodukter, rengöringsprodukter, dofter, fotpulver, hårfärger och färger, smink, nagelprodukter, personliga renhetsprodukter, schampon, rakprodukter, hårborttagningsmedel, hudvårdsprodukter och solbrännprodukter, samt kemiska hårrätare och hårvågsatser. Det är också en populär ingrediens i industriella lösningsmedel som en kemisk bas för tvål, ugnsrengöringsmedel, tvättmedel och avloppsrengöringsmedel på grund av dess förmåga att lösa upp fett, oljor, fetter och proteinbaserade avlagringar, enligt Wikipedia. Mindre ofta ses natriumhydroxid som en ingrediens i tandkräm.
natriumhydroxid är FDA-godkänd och har fått Gras (allmänt erkänd som säker) betyg som en direkt livsmedelstillsats. Det används emellertid främst vid tvätt och kemisk peeling av produkter. Det är godkänt för användning i kosmetika och personliga hygienprodukter i varierande koncentrationer: 5 viktprocent i nagelkutikellösningsmedel, 2 viktprocent i hårrätare för allmänt bruk, 4,5 viktprocent i hårrätare för professionellt bruk, upp till ett pH 12,7 i hårborttagningsmedel och upp till pH 11 i andra användningsområden som pH-justerare.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
kemiska egenskaper
natriumhydroxid, NaOH,även kallad kaustisk soda eller natriumhydrat(och tidigare känd som lut), är ett vitt,massivt, deliquescent kristallint fast ämne som är lösligt i vatten,alkohol och glycerol. Den smälter vid 318 C (606 av) och är den mest använda och tillgängliga alkaliska kemikalien. De flesta natriumhydroxid produceras som en samprodukt av klor genom användning av elektrolytiska celler;cellerna är av membran, kvicksilver eller membrantyp. Vissa natriumhydroxid markeras som produceras i cellerna;de flesta avdunstas och säljs som 50% och 73% lösningar eller som vattenfria pärlor. De flesta kaustiska slutanvändningarna kräver lösningar med relativt låga koncentrationer. Kaustiksoda används som analytiskt reagens och kemisk mellanprodukt, i skurnings-och rengöringsbad,i gummiåtervinning och petroleumraffinering, i släckningsbad för värmebehandling av stål,i skärande och lösliga oljor,i tvål och tvättmedel och i en mängd olika andra applikationer.
kemiska egenskaper
NaOH är ett vitt, luktfritt, deliquescent material som säljs som pellets, flingor, klumpar eller pinnar. Vattenlösningar är kända som soda lut
kemiska egenskaper
natriumhydroxid förekommer som en vit eller nästan vit smält massa. Det finns i små pellets, flingor, pinnar och andra former eller former. Denär hård och spröd och visar en kristallin fraktur. Sodiumhydroxid är mycket deliquescent och vid exponering för luft absorberar det snabbtabsorberar koldioxid och vatten.
fysikaliska egenskaper
vita orthorhombic kristaller, framställda i form av pellets, klumpar, pinnar, pärlor, chips, flingor eller lösningar; hygroskopisk; mycket frätande; absorberar snabbt CO2 och vatten från luften; densitet 2,13 g/cm3; smälter vid 323 C; förångas vid 1388 C; ångtryck 1 torr vid 739 C och 5 torr vid 843 c; mycket lösligt i vatten (110 g/100 ml vid rumstemperatur), genererar värme vid upplösning; vattenlösningar mycket alkaliska, pH av 0,5% lösning ca 13 och 0,05% lösning ca 12; löslig i metanol, etanol och glycerol (23,8 g/100 ml metanol och 13.9 g/100 mL etanol vid omgivande temperaturer.).
använder
kaustisk soda är en av de mest användakemikalier. Det används för att neutralisera syror; att göra natriumsalter; att fälla ut metaller som deras hydroxider; i petroleumraffinering; iförlamning av estrar; vid behandling avcellulosa, plast och gummi; och i mångasyntetiska och analytiska tillämpningar.
använder
natriumhydroxid säljs kommersiellt som vattenfria flingor eller pellets eller som 50% eller 73% vattenlösningar. Den har otaliga industriella användningsområden och är en av de 10 bästa kemikalierna när det gäller produktion och användning på global skala. Cirka 15 miljoner ton natriumhydroxid används årligen. Dess största användning, som förbrukar ungefär hälften av sin produktion, är som bas för att producera andra kemikalier. Det används för att kontrollera pH och neutralisera syror i kemiska processer. Pappersindustrin använder omfattande natriumhydroxid i massaprocessen. Natriumhydroxid används för att separera fibrer genom upplösning av det anslutande lignin. Det används på liknande sätt vid framställning av rayon från cellulosa. Natriumhydroxid är en viktig kemikalie i tvålen industry.In förtvålningsprocessen, triglycerider erhållna från djur och växter upphettas i abasisk lösning för att ge glycerol och tvål:
natriumhydroxid används i textilindustrin för blekning och behandling av textilier för att göra dem färgämne lättare. Petroleumindustrin använder natriumhydroxid i borrslam och asa-baktericid. Natriumhypoklorit (NaOCl) används i stor utsträckning för rengöring och som desinfektionsmedel.Vanlig hushållsblekmedel består av ca 5% natriumhypokloritlösning. Sodiumhypochlorite framställs genom att reagera klor med natriumhydroxid: Cl2 (g) + 2NaOH(aq) acibic NaOCl(aq) + NaCl(aq) + H2O(l). Natriumhydroxid används i livsmedelsindustrin för rengöringoch peeling frukt och grönsaker. Natriumhydroxid är en mindre ingrediens i många vanligahushållsprodukter, men i några få kan det utgöra mer än hälften av produkten. Dranokristaller innehåller mellan 30% och 60% natriumhydroxid och vissa avloppsrengöringsmedel kan bestå av 100% natriumhydroxid.
använder
natriumhydroxid är ett alkali som är lösligt i vatten, med en löslighet av 1 g i 1 ml vatten. det används för att förstöra de bittra kemikalierna i oliver som ska bli svarta oliver. det fungerar också för att neutralisera syror i olika livsmedelsprodukter.
använder
natriumhydroxid används för att justera ett produkt pH för att göra det mer acceptabelt för huden. Det kallas vanligtvis kaustisk soda och fungerar ofta som ett kemiskt reagens när man gör tvål. Om det är för koncentrerat kan det orsaka allvarlig hudirritation.
använder
natriumhydroxid är en av de viktigaste industriella kemikalierna. I volym är det bland de tio bästa kemikalierna som produceras i USA. Det används vid tillverkning av ett stort antal föreningar inklusive flera natriumsalter, vid behandling av cellulosa för framställning av rayon och cellofan, och vid tillverkning av tvål, tvättmedel, massa och papper. Natriumhydroxid är ett vanligt neutraliserande medel för syror i syrabastitreringar och petroleumraffinering. En annan viktig applikation är att extrahera metaller från sina malmer där alkalifusion, såsom fusion med kaustisk soda, ofta appliceras för att öppna malmerna. Dessutom används natriumhydroxid för att fälla ut metaller som hydroxider. Andra användningsområden är återvinning av gummi, upplösning av kasein i plastproduktion, raffinering av vegetabiliska oljor, bearbetning av textilier, som eluant i jonkromatografi, etsning och galvanisering och som laboratoriereagens. Natriumhydroxid används också som en stark bas i många organiska syntes och baskatalyserade reaktioner.
använder
NaOH-lösningar används för att neutralisera syror och göra natriumsalter, t. ex. i petroleumraffinering för att avlägsna svavelsyra och organiska syror; för att behandla cellulosa vid framställning av viskos rayon och cellofan; vid återvinning av gummi för att lösa upp tyget; vid tillverkning av plast för att lösa upp kasein. NaOH-lösningar hydrolyserar fetter och bildar tvålar; de fäller alkaloider (baser) och de flesta metaller (som hydroxider) från vattenlösningar av deras salter. Farmakoterapeutiskt hjälpmedel (alkaliserare).
beredning
natriumhydroxid tillverkas tillsammans med klor genom elektrolys av natriumkloridlösning. Olika typer av elektrolytiska celler används kommersiellt. De inkluderar kvicksilvercellen, membrancellen och membrancellen.
en mättad lösning av saltlösning elektrolyseras. Klorgas frigörs vid anoden och natriumjonen vid katoden. Nedbrytning av vatten producerar väte-och hydroxidjoner. Hydroxidjonen kombineras med natriumjon som bildar NaOH. De totala elektrolytiska reaktionerna kan representeras som:
2na+ + 2CL-+ 2H2O CL2 (g) + H2 (g) + 2NaOH (aq)
kvicksilvercellen fortskrider i två steg som förekommer separat i två celler. Den första är känd som saltlösningscellen eller den primära elektrolyseraren i vilken natriumjon avsätts på kvicksilverkatoden som bildar amalgam, medan klorgas frigörs vid anoden:
Na + + Cl-Kubi Na-Hg ( katod) + jacobcl2(g) (anod)
i den andra cellen, känd som sönderdelningscellen, används en grafitkatod medan natriumamalgam fungerar som anoden. Vatten reagerar med natriummetallen i amalgam i sönderdelaren:
Na-Hg + H2O Cl Na+ + OH– + Cl 2 + Hg
i kloralkalimembranceller används ett membran för att separera klor som frigörs vid anoden från natriumhydroxiden och väte som genereras vid katoden. Utan membran kommer den bildade natriumhydroxiden att kombineras med klor för att bilda natriumhypoklorit och klorat. I många celler används asbestmembran för sådan separation. Många typer av membranceller finns tillgängliga.
natriumhydroxid framställs antingen som ett vattenfritt fast ämne eller som en 50% vattenlösning.
Definition
den viktigaste kommersiellakustik.
produktionsmetoder
natriumhydroxid tillverkas genom elektrolys av saltlösning medinertelektroder. Klor utvecklas som en gas vid anoden ochväte utvecklas som en gas vid katoden. Avlägsnandet av kloridoch vätejoner lämnar natrium-och hydroxidjoner i lösning.Lösningen torkas för att producera den fasta natriumhydroxiden.
en andra metod använder Kellner-Solvay-cellen. Mättad natriumkloridlösning elektrolyseras mellan en kolanod och flytande kvicksilverkatod. I detta fall produceras natrium vidkatod snarare än väte på grund av beredskapen avnatrium att lösa upp i kvicksilver. Natrium-kvicksilveramalgam exponeras sedan för vatten och en natriumhydroxidlösning produceras.
reaktioner
natriumhydroxid är starkt alkaliskt och kan reagera med syror för att bilda salter och vatten.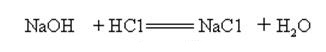
natriumhydroxid reagerar med sura oxider för att bilda salt och vatten, så natriumhydroxid kan användas för att absorbera sura gaser i laboratoriet eller industriellt.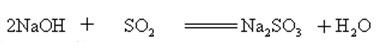
natriumhydroxid kan reagera med vattenlösningar av många metallsalter för att bilda natriumsalter och metallhydroxider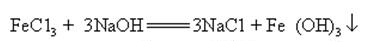
när natriumhydroxid och ammoniaksalt upphettas tillsammans kan det frigöra ammoniak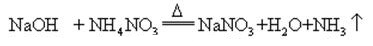
natriumhydroxid är mycket frätande, så att natriumhydroxid och ammoniaksalt värms upp tillsammans, kan det frigöra ammoniak
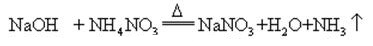
natriumhydroxid är mycket frätande, så att natriumhydroxid och ammoniaksalt värms upp tillsammans glasflaskorna som lagrar natriumhydroxidlösningar måste vara gummiproppar och glasproppar ska inte användas för att förhindra att en kemisk reaktion öppnas. Natriumhydroxid är ett viktigt industriellt råmaterial och kan framställas genom elektrolys av saltlösning industriellt 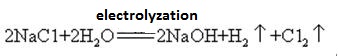
allmän beskrivning
en vit fast substans. Frätande mot metaller och vävnad. Används i kemisk tillverkning, petroleumraffinering, rengöringsföreningar, avloppsrenare.
luft & Vattenreaktioner
lösliga i vatten. Upplösning kan frigöra tillräckligt med värme för att orsaka ångning och stänk och antända intilliggande brännbart material .
Reaktivitetsprofil
kaustisk SODA (natriumhydroxid) är en stark bas. Reagerar snabbt och exotermiskt med syror, både organiska och oorganiska. Absorberar lätt fukt från luften för att ge kaustiska halvfasta ämnen som attackerar aluminium och zink med utvecklingen av brandfarlig vätgas. Katalyserar polymerisationen av acetaldehyd och andra polymeriserbara föreningar; dessa reaktioner kan uppstå våldsamt, till exempel polymeriserar akrolein med extremt våld när de sätts i kontakt med alkaliska material såsom natriumhydroxid . Reagerar med stort våld med fosforpentaoxid när den initieras av lokal uppvärmning . Kontakt (som torkmedel) med tetrahydrofuran, som ofta innehåller peroxider, kan vara farligt—explosioner har inträffat vid en sådan användning av kemiskt liknande kaliumhydroxid . Blandning med något av följande ämnen i en sluten behållare fick temperaturen och trycket att öka: isättika, ättiksyraanhydrid, akrolein, klorohydrin, klorsulfonsyra, etencyanohydrin, glyoxal, saltsyra (36%), fluorvätesyra (48,7%), salpetersyra (70%), oleum, propiolakton, svavelsyra (96%) . Oavsiktlig kontakt mellan en kaustisk rengöringslösning (troligen innehållande natriumhydroxid) och Pentol orsakade en våldsam explosion. . Uppvärmning med en blandning av metylalkohol och triklorbensen under ett försök till syntes ledde till en plötslig ökning av trycket och en explosion . Varm och / eller koncentrerad NaOH kan orsaka att hydrokinon sönderdelas exotermiskt vid förhöjd temperatur. (NFPA Pub. 491M, 1975, 385)
fara
frätande för vävnad i närvaro av fukt, starkt irriterande för vävnad (ögon, hud, mukousmembran och övre luftvägarna), gift genomingestion.
hälsorisk
stark frätande verkan på kontaktade vävnader. Inandning: damm kan orsaka skador på övre luftvägarna och själva lungan, vilket ger mild näsirritation till pneumonit. Förtäring: allvarlig skada på slemhinnor; allvarlig ärrbildning eller perforering kan uppstå. Ögonkontakt: orsakar allvarliga skador.
hälsorisk
natriumhydroxid är ett mycket frätande ämnesom orsakar skador på mänskliga vävnader.Dess verkan på huden är något annorlundafrån sura brännskador. Det finns ingen omedelbar smärta, men det tränger in i huden. Det koagulerar inteprotein för att förhindra dess ytterligare penetration, och därmed kan den kaustiska bränningen bli svåroch långsam läkning. Spillning av dess koncentreradelösningar i ögonen kan leda till svårirritation eller permanent skada.
det är giftigt vid intag såväl som inhalationav dess damm. Även om den orala toxiciteten Hosen 5-10% lösning av kaustisk soda hittadesatt vara låg hos testdjur, höga doser vidstörre koncentrationer kan orsaka kräkningar,utmattning och kollaps. De orala dödliga doseinkaninerna är 500 mg / kg (NIOSH 1986).
Natriumhydroxiddamm eller aerosoler ärirriterar till ögon, näsa och hals. Förlängdexponering för höga koncentrationer i luftkan ge sår i näspassagen.
brandrisk
icke brännbart, ämnet i sig brinner inte men kan sönderdelas vid uppvärmning för att producera frätande och/eller giftiga ångor. Vissa är oxidationsmedel och kan antända brännbara ämnen (trä, papper, olja, kläder etc.). Kontakt med metaller kan utveckla brandfarlig vätgas. Behållare kan explodera vid uppvärmning.
brandfarlighet och Explosibilitet
natriumhydroxid och kaliumhydroxid är inte brandfarliga som fasta ämnen eller vattenhaltiga lösningar.
farmaceutiska applikationer
natriumhydroxid används ofta i farmaceutiska formuleringar för attjustera lösningens pH. Det kan också användas för att reagera med svagasyra för att bilda salter.
industriell användning
kaustisk soda (NaOH) betraktas som den starkaste alkaliska pH-regulatorn. Kaustisk sodaär en mycket aktiv substans och är mycket frätande. Huvuddelen av kaustisk soda tillverkasgenom elektrolys av mättade saltlösningar (NaCl). Kaustik soda har en mycket stark ph-regleringkapacitet (dvs. från pH 7 till pH 14) vid en relativt låg dos jämfört medAndra alkaliska ämnen. Kommersiellt är kaustisk soda tillgänglig i vattenfri form, men i de flesta gruvtillämpningar levereras kaustisk soda som en 50% lösning.
i mineralbearbetningsindustrin används natriumhydroxid mestadels för alkalitetskontrollunder bearbetning av icke-metalliska mineraler. Vid basmetallflotation, användningen avnatriumhydroxid är sällsynt.
säkerhetsprofil
Gift genom intraperitoneal väg. Måttligt giftigt vid intag. Mutationsdata rapporterade. En Frätande irriterande för hud, ögon och slemhinnor. Vid upphettning till sönderdelning avger den giftiga rök av NanO.
säkerhet
natriumhydroxid används i stor utsträckning inom läkemedels-och livsmedelsindustrin och betraktas allmänt som ett icke-toxiskt material vid låga koncentrationer. Vid höga koncentrationer är det Frätande irriterande förhud, ögon och slemhinnor.
LD50 (mus, IP): 0,04 g / kg
LD50 (kanin, oral): 0,5 g / kg
potentiell exponering
NaOH används för att neutralisera syror och göra natriumsalter i petroleumraffinering, viskos rayon; cellofan, plastproduktion; och vid återvinning av lösningar av deras salter. Det används vid tillverkning av merceriserad bomull, papper, sprängämnen och färgämnen vid metallrengöring; elektrolytisk extraktion av zink; tennplätering; oxidbeläggning; tvättning, blekning, diskning; och det används i kemisk industri.
förvaring
splashgoggles och ogenomträngliga handskar ska alltid bäras vid hantering av dessa ämnen för att förhindra ögon-och hudkontakt. Operationer med metallhydroxidlösningar som har potential att skapa aerosoler bör utföras i rök för att förhindra exponering vid inandning. NaOH och KOH genererar betydande värmenär upplöst i vatten; när du blandar med vatten, tillsätt alltid kaustik långsamt tillvatten och rör om kontinuerligt. Tillsätt aldrig vatten i begränsade mängder till fast ämnehydroxider. Behållare med hydroxider ska förvaras på en sval, torr plats, separerad från syror och inkompatibla ämnen.
förvaring
natriumhydroxid ska förvaras i en lufttät icke-metallisk behållare på en sval, torr plats. Vid exponering för luft absorberar natriumhydroxid snabbt fukt och flytande, men blir därefter fast igen på grund av absorption av koldioxid ochbildning av natriumkarbonat.
Frakt
UN1823 NaOH, fast, Faroklass: 8; etiketter: 8-frätande material. UN1824 NaOH, lösning, Faroklass: 8; etiketter: 8-frätande material
reningsmetoder
vanliga föroreningar är vatten och natriumkarbonat. Natriumhydroxid kan renas genom upplösning av 100 g i 1L ren EtOH, filtrering av lösningen under vakuum genom en fin sintrad Glasskiva för att avlägsna olösliga karbonater och halogenider. (Denna och efterföljande operationer bör utföras i en torr, CO2 – fri låda.) Lösningen koncentreras under vakuum, med mild uppvärmning, för att ge en tjock uppslamning av monoalkoholatet som överförs till en grov sintrad Glasskiva och evakueras fri från moderlut. Efter tvättning av kristallerna flera gånger med renad alkohol för att avlägsna spår av vatten torkas de i vakuum, med mild uppvärmning, i ca 30timmar för att sönderdela alkoholatet och lämna ett fint vitt kristallint pulver . Kaustisk. Natriumhydroxidlösningar( kaustiska), 14.77. Karbonatjon kan avlägsnas genom passage genom en anjonbyteskolonn (såsom Amberlite IRA-400; OH–form). Kolonnen bör nyberedas från kloridformen genom långsam tidigare passage av natriumhydroxidlösning tills utflödet inte ger något test för kloridjoner. Efter användning kan kolonnen regenereras genom tvättning med utspädd HCl, sedan vatten. På liknande sätt avlägsnas andra metalljoner när en 1m (eller mer utspädd) NaOH-lösning passeras genom en kolonn av Dowex-jonbyte a-1-harts i sin Na+ – form. Alternativt kan karbonatförorening reduceras genom att skölja pinnar av NaOH (analytisk reagenskvalitet) snabbt med H2O, sedan lösas upp i destillerad H2O eller genom att bereda en koncentrerad vattenlösning av NaOH och dra av den klara supernatantvätskan. (Olöslig Na2CO3 är kvar.) Karbonatförorening kan minskas genom att tillsätta ett litet överskott av koncentrerad BaCl2 eller BA(OH)2 till en NaOH-lösning, skaka väl och låta BaCO3-fällningen lösa sig. Om närvaron av Ba i lösningen är oacceptabel kan en elektrolytisk rening användas. Till exempel framställs natriumamalgam genom elektrolys av 3L av 30% NaOH med 500 ml rent kvicksilver för katod och en platinanod, som passerar 15 Faradays vid 4Amps, i en tjockväggig polyetenflaska. Flaskan är sedan försedd med inlopps-och utloppsrör, varvid den förbrukade lösningen spolas ut med CO2-fri N2. Amalgamet tvättas sedan noggrant med en stor volym avjoniserat vatten (med elektrolysströmmen påslagen för att minimera förlust av Na). Slutligen placeras en ren stålstång i kontakt i lösningen med amalgam (för att underlätta väteutvecklingen), reaktionen får fortsätta tills en lämplig koncentration uppnås innan den överförs till ett lagringskärl och späds ut efter behov .
inkompatibiliteter
en stark bas och en stark oxidator. Våldsam reaktion med syra. Oförenligt med vatten; brandfarliga vätskor; organiska halogener, nitrometan och nitroföreningar, brännbara ämnen. Absorberar snabbt koldioxid och vatten från luften. Kontakt med fukt eller vatten kan generera värme. Frätande mot metaller. Kontakt med zink, aluminium, tenn och bly i närvaro av fukt, som bildar explosiv vätgas. Angriper vissa former av plast, gummi eller beläggningar.
inkompatibiliteter
natriumhydroxid är en stark bas och är oförenlig med någonförening som lätt genomgår hydrolys eller oxidation. Det kommerreagera med syror, estrar och etrar, särskilt i vattenlösning.
avfallshantering
utsläpp i tank som innehåller vatten, neutralisera och spola sedan till avlopp med vatten.
regulatorisk Status
Gras listad. Godkänd för användning som livsmedelstillsats i Europa.Ingår i FDA Inaktiva Ingredienser databas (dentalpreparations; injektioner; inhalationer; nasal, oftalmisk, oral, otic,rektal, topisk och vaginal preparat). Ingår i icke-parenterala och parenterala läkemedel licensierade i Storbritannien. Ingår ikanadisk lista över acceptabla icke-medicinska ingredienser.
Leave a Reply