kovalenta föreningar
Du har nu en kort uppfattning om varför olika element beter sig annorlunda. Men vet du en stor del av det är på grund av ”naturen” av bindningarna i föreningarna. Precis som du och dina bästa vänner har ett antal skillnader på grund av de ”inre” egenskaperna, så är fallet med joniska och kovalenta föreningar. I det här kapitlet kommer vi att lära oss mer om begreppet kovalenta föreningar, titta på deras egenskaper och mer.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Detta beror på att atomerna i de kovalenta molekylerna hålls mycket tätt ihop. Varje molekyl är verkligen ganska separat och attraktionskraften mellan de enskilda molekylerna i en kovalent förening tenderar att vara svag.
vi behöver mycket lite energi för att separera molekylerna. Detta beror på de attraktiva krafterna mellan molekylerna med frånvaro av total elektrisk laddning. Kovalenta föreningar är vanligtvis gasformiga molekyler vid rumstemperatur och tryck. De kan också vara vätskor med låga relativt låga kokpunkter.
dessa egenskaper kan tillskrivas deras svaga intermolekylära krafter som håller dessa atomer tillsammans. Men vi har också många fasta kovalenta föreningar. De har låga smältpunkter. Det är dock intressant att notera att ett litet antal av dessa har en helt annan struktur. De bildar enorma strukturer där ett stort antal atomer hålls ihop. Detta är möjligt på grund av närvaron av delade elektroner.
dessa jätte molekylära strukturer är i grunden gitter som består av molekyler som hålls samman av kovalenta bindningsstrukturer. Dessa kovalenta bindningar är mycket starka. De tenderar också att vara mycket hårda med höga smältpunkter som skiljer sig från de flesta av de kovalenta föreningarna. Exemplet med denna typ av kovalenta föreningar innefattar diamant och grafit av kolatomnät. De inkluderar också kiseldioxid av kisel och syreatomer nätverk.
ladda ner Cheat Sheet Chemical Bonding PDF genom att klicka på nedladdningsknappen nedan


bläddra bland fler ämnen under Chemical Bonding And Molecular Structure
- bindningsparametrar
- grunderna för kemisk bindning
- hybridisering
- vätebindning
- joniska eller elektrovalenta föreningar
- molekylär orbitalteori
- polaritet av bindningar
- resonansstrukturer
- valensbindning Teori
- VSEPR teori
Allmänna egenskaper hos kovalenta föreningar
- kovalenta föreningar har vanligtvis låga smältpunkter. Ett undantag från detta inkluderar molekyler av kiseldioxid och diamanter som har en hög smältpunkt.
- dessa föreningar har låga kokpunkter. Detta kan hänföras till deras svaga attraktionskraft mellan de olika bundna atomerna. Van Der Waals krafter binder dessa atomer.
- dessa föreningar är vanligtvis gaser och vätskor med låga koknings-och smältpunkter.
- de fasta kovalenta föreningarna har mjuka strukturer som grafit. Detta beror på närvaron av ett moln av elektroner mellan varje lager av kolatomer.
- dessa föreningar är icke-ledare av elektrisk laddning. Frånvaron av laddade joner är den främsta orsaken bakom detta. Ett undantag från detta är grafit, där vi ser ett moln av elektroner. Dessa gör grafit till en bra ledare.
- de är dåliga ledare av värme också. Deras molekyler saknar fria elektroner och det hindrar flödet av värmeenergi.
- kovalenta föreningar har inte polära egenskaper som en allmän egenskap. Därför är dessa föreningar olösliga i vatten. Vattenmolekyler är inte helt neutrala och har en liten negativ laddning på syreatomen och små positiva laddningar på väteatomerna och eftersom kovalenta föreningar består av neutrala molekyler eller molekyler med små laddningar och därför inte lockas till vattenmolekyler starkt.
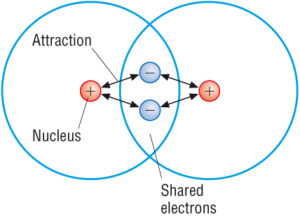
(källa: Google)
fysikaliska och kemiska egenskaper
- de flytande kovalenta föreningarna avdunstar. Detta innebär att molekylerna av vätskor och fasta ämnen förlorar från ytan till luften.
- dessa föreningar har mycket mindre affinitet mellan sina molekyler.
- olika kovalenta föreningar har sina egna karaktäristiskt formade molekyler. Deras obligationer riktas mot förinställda vinklar.
- vissa föreningar, särskilt läkemedel, är lösliga i vatten. Resten är lösliga i olja.
- de flesta av de kovalenta föreningarna är icke-polära eller har mycket liten tendens att delas helt för att bilda joner och leder därför aldrig elektricitet.
- vid normal temperatur och tryck hittar vi dessa föreningar som antingen vätskor eller gaser. Men det finns också fasta ämnen och de har högre molekylvikter.
- de kovalenta föreningskristallerna är av två typer: en som har svag van der Waal-kraft som håller dessa tillsammans som i jod. Dessa är lätt smältbara och flyktiga, den andra har ett stort nätverk av atomer som sätter upp makromolekylerna.
- dessa föreningar är lösliga i organiska lösningsmedel som eter och bensen.
- kovalenta bindningar är riktade i naturen. Därför uppvisar de fenomenet isomerism.
- kovalenta föreningar har huvudsakligen en mycket långsam reaktionshastighet, till skillnad från de olika Joniska föreningarna.
lösta exempel för dig
fråga: Varför är kovalenta föreningar inte lösliga i vatten?
svar: vattenmolekyler är inte helt neutrala. Dessa molekyler har en liten negativ laddning på syreatomen och små positiva laddningar på väteatomerna. Å andra sidan vet vi att de kovalenta föreningarna består av neutrala molekyler eller molekyler med små laddningar. Det är av denna anledning att dessa föreningar inte lockas starkt till vattenmolekyler.
Leave a Reply