Kemisk bindning
kemiska bindningar är attraktionerna mellan atomer som håller dem ihop för att bilda föreningar. Det finns tre huvudtyper av bindning: kovalenta bindningar som binder samman molekylära föreningar, Joniska bindningar som binder salter och joniska kristaller och metallbindningar som binder metallernas atomer.
molekyler och kovalenta bindningar
de flesta bränslen, plast och naturprodukter är molekylära föreningar, gjorda av atomer bundna ihop till molekyler. Den typ av bindning som förenar atomerna i en molekyl är kovalent bindning, vilket uppstår när de yttre elektronerna i två atomer delas mellan dem, vilket skapar en attraktion mellan de två atomerna.
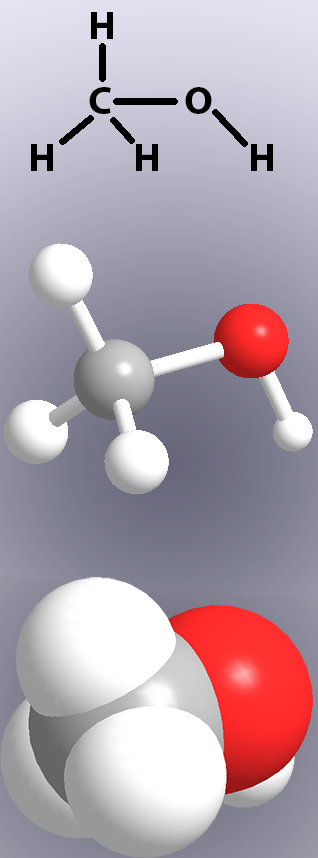
kovalenta bindningar visas i kemiska strukturer med linjer (Figur 1, topp) och i modeller genom att antingen visa ’pinnar’ eller överlappningen av atomerna (Figur 1, mitten och botten).
elektronerna i en kovalent bindning delas inte alltid lika mellan de två atomerna. När delningen är ojämn kommer en atom att ha en mycket liten positiv laddning, och den andra atomen kommer att vara något negativ. Denna lådor en liten elektrisk dipol-molekyler som innehåller en dipol är polära föreningar. Huruvida en molekyl är polär eller icke-polär påverkar dess egenskaper, såsom smält-och kokpunkter och vätebindning.
Läs mer om kovalent bindning på Kemilibretexten.
jonisk och metallisk bindning
medan kovalent bindning innebär att dela elektroner mellan två atomer, innebär jonisk bindning fullständig överföring av elektroner från en atom till en annan, vilket skapar positiva och negativa joner. Dessa joner hålls sedan samman av attraktionen mellan deras motsatta laddningar. Joniska föreningar bildar kristaller baserat på dessa attraktioner.
metallisk bindning innebär fullständig delning av valenselektronerna hos metallatomer, vilket skapar ett ”elektronhav” där elektroner är fria att röra sig. Detta är en del av orsaken till metallernas höga ledningsförmåga. Läs mer om metallisk bindning vid Kemi LibreText
energi och kemiska bindningar
generellt kommer energi att frigöras när en bindning bildas mellan två atomer, oavsett vilken typ av bindning. På samma sätt, om en bindning redan finns mellan två atomer, kommer energi att krävas för att bryta den. Mängden energi som krävs för att bryta en bindning är densamma som mängden energi som frigörs när den bildas.
de flesta kemiska reaktioner involverar både brytning och tillverkning av kemiska bindningar. Om den energi som frigörs genom att bilda nya bindningar är större än den energi som behövs för att bryta de ”gamla” bindningarna, kommer energi att släppas totalt sett av reaktionen. Denna energi kan gå förlorad som värme eller kan användas för kraft.
till exempel följer förbränningen av metan (CH4) denna kemiska reaktion:
denna reaktion innefattar brytning av de fyra kol-vätebindningarna i metan och syre-syrebindningen i O2. Nya bindningar bildas är de två kol-syrebindningarna (i CO2) och väte-syrebindningar (i H2O). Dessa nya obligationer har mindre energi totalt sett än de ursprungliga bindningarna, så energi kommer att släppas av denna reaktion. Att släppa energi är ett kännetecken för förbränningsreaktioner – du kanske har märkt detta när du känner en het flamma. Animationen nedan illustrerar kolväteförbränningen av metan.
eftersom en stor mängd energi frigörs vid bildning av CO2 och H2O vid förbränning av kolväten som metan, är dessa en bra primär energikälla. Det betyder också att en stor mängd energi skulle behövas för att bryta bindningarna i CO2 och bilda andra molekyler. Detta är en anledning till att fotosyntes kräver så mycket energi (från solljus) för att omvandla CO2 till kolhydrater.
för vidare läsning
- kemisk energi
- förbränning
- primärenergi
- energiomvandlingsteknik
- eller utforska en slumpmässig sida
Leave a Reply