Kemi: Vad är syror och baser?
Vad är syror och baser?
även om jag har sagt att syror och baser inte är svåra att förstå, har jag dåliga nyheter: det finns inte en utan tre vanliga definitioner som används för att beskriva syror och baser: Arrhenius syror och baser, Brnsted-Lowry syror och baser, och Lewis syror och baser. Även om detta gör att det låter som om du måste lära dig om syror och baser tre gånger, är den goda nyheten att för många praktiska ändamål är dessa tre definitioner ungefär likvärdiga.
Arrhenius syror och baser
långt tillbaka i slutet av 1800-talet kom vår gamla vän Svante Arrhenius med definitioner av syror och baser medan han arbetade med kinetikproblem.
enligt Arrhenius är syror föreningar som bryts upp i vatten för att avge hydronium (H+) joner. Ett vanligt exempel på en Arrhenius syra är saltsyra (HCl):
- HCl ? H + + Cl-
formlerna för syror börjar vanligtvis med väte, även om organiska syror är ett anmärkningsvärt undantag. Namnen och formlerna för vissa vanliga syror anges i tabellen nedan:
| Syranamn | formel | saltsyra | HCl |
|---|---|
| salpetersyra | HNO3 |
| fosforsyra | H3PO4 |
| svavelsyra | H2SO4 |
| ättiksyra | c2h4o2 |
Arrhenius baser definieras som föreningar som orsakar bildandet av hydroxidjonen när de placeras i vatten. Ett exempel på en Arrhenius-bas är natriumhydroxid (NaOH):
- NaOH ? Na + + OH-
baser har vanligtvis ”OH” i sina formler, även om det finns undantag. Ammoniak (NH3) innehåller till exempel inte hydroxidjoner men bildar dem när det reagerar med vatten:
- NH3 + H2O ? NH4 + + OH-
namnen och formlerna för några vanliga baser finns i följande tabell:
| basnamn | formel |
|---|---|
| ammoniak | NH3 |
| kaliumhydroxid | KOH |
| natriumbikarbonat | NaHCO3 |
| natriumkarbonat | Na2CO3 |
| natriumhydroxid | NaOH |
vissa oxider bildar syror eller baser när vatten tillsätts. Eftersom dessa föreningar inte innehåller några H + eller OH – joner om de inte reagerar med vatten kallas de ”anhydrider.”Vanligtvis är oxider av icke-metaller syraanhydrider (de bildar syra när de placeras i vatten) och oxider av metaller är basanhydrider (bildar en bas när de placeras i vatten).
Brnsted-Lowry syror och baser
i början av 1900-talet föreslogs en alternativ definition för syror och baser av Johannes Brnsted och Thomas Lowry för att redogöra för det faktum att ammoniak kan neutralisera surheten hos HCl även om vatten inte är närvarande. Detta fenomen visade dem att ammoniak är en bas, även om det inte finns vatten runt för att bilda hydroxidjoner.
det finns många olika namn och formler som används för att beskriva hydroniumjonen. Även om formeln tidigare visades som” H+”, skrivs den ibland som” H3O ” eftersom detta är jonen som bildas när H+ kombineras med vatten. Ett annat vanligt sätt att hänvisa till hydroniumjoner är bara att kalla dem ”protoner.”Detta namn kommer från det faktum att H+ representerar en väteatom (en proton och en elektron) som har förlorat sin elektron och lämnar bara den nakna protonen bakom sig.
en Brnsted-Lowry-syra definieras som en förening som ger hydroniumjoner till en annan förening?till exempel ger saltsyra H+ joner till föreningar som den reagerar med. Brnsted-Lowry baser är föreningar som kan acceptera hydroniumjoner?när ammoniak får en hydroniumjon från HCl bildar den ammoniumjonen.
följande ekvation representerar reaktionen av en Brnsted-Lowry-syra med en Brnsted-Lowry-bas:
- HNO3 + NH3 ? NO3- + NH4+
i denna reaktion uppträder salpetersyra som en syra eftersom den ger en proton till ammoniak. Ammoniak beter sig som en bas eftersom den accepterar protonen från salpetersyra.
men om du tittar på den andra sidan av ekvationen hittar vi nitrat-och ammoniumjonerna. Eftersom nitratjonen kan acceptera protoner från ammoniumjonen (för att bilda HNO3) är nitratjonen en mycket svag Brnsted-Lowry-bas. Eftersom ammoniumjonen har en extra proton att donera (i detta fall till nitratjonen) är det en Brnsted-Lowry-syra.
nitratjonen är baserad på salpetersyramolekylen, så vi säger att det är konjugatbasen av salpetersyra. På samma sätt är ammoniumjonen konjugatsyran av ammoniak. Tillsammans kallas en syra med sin konjugatbas (såsom HNO3 och NO3-) eller en bas med sin konjugatsyra (såsom NH3 och NH4+) som ett konjugat syrabaspar.
Lewis syror och baser
i Brnsted-Lowry definition av syror och baser definieras en bas som en förening som kan acceptera en proton. Men hur accepterar den protonen?
en funktion som Brnsted-Lowry-baser har gemensamt med varandra är att de har ett odelat par elektroner. När en hydroniumjon vandrar genom molekylen, ibland kommer de ensamma paren att nå ut och ta tag i den. Ett exempel på detta är när ammoniak accepterar en proton i en sur lösning:
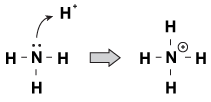
figur 23.1 ammoniak kan ta en proton från salpetersyra med sitt ensamma par elektroner.
ett sätt att se på denna process är att ammoniakatomen donerar sitt ensamma par till protonen. Eftersom de ensamma paren driver denna kemiska reaktion har vi en ny definition av surhet och basicitet, kallad ”Lewis surhetsgrad/basicitet.”En Lewis-bas är en förening som donerar ett elektronpar till en annan förening (ammoniaken i vårt exempel). En Lewis-syra är en förening som accepterar ett elektronpar (h+ – Jonen i vårt exempel).
Lewis baser är kemikalier som kan donera elektronpar. Lewis syror är kemikalier som kan acceptera dem.
även om vi hade ammoniak som donerade ett ensamt par till en proton i vårt exempel, kan det ensamma paret i ammoniak också reagera med många andra föreningar. Ammoniak kan till exempel donera sitt ensamma elektronpar till BH3 genom följande process:

figur 23.2 det ensamma paret på ammoniak som fäster sig vid BH3.
i denna process är ammoniak Lewis-basen och BH3 är Lewis-syran.
generellt sett är Lewis-definitionen av syror och baser den mest användbara eftersom den är den mest inkluderande av de tre definitionerna. Till exempel innehåller brnsted-Lowry-definitionen av en syra HF men inte BH3, som inte förlorar en proton när den fästs av de ensamma paren på en Lewis-bas.
utdrag ur den kompletta idiotens Guide till kemi 2003 av Ian Guch. Alla rättigheter förbehållna inklusive rätten till reproduktion helt eller delvis i någon form. Används enligt överenskommelse med Alpha Books, en medlem av Penguin Group (USA) Inc.
för att beställa denna bok direkt från förlaget, besök Penguin USA webbplats eller ring 1-800-253-6476. Du kan också köpa den här boken på Amazon.com och Barnes & Noble.
Leave a Reply