Första linjens behandling för metastatisk Kastratresistent prostatacancer
i 2019 står prostatacancer (PCa) för nästan 1 av 5 nya diagnoser av cancer hos män i USA.1 under de senaste åren minskade den totala förekomsten av prostatacancer (PCa) med cirka 7% per år.1 Den kraftiga minskningen av incidensen har vanligen tillskrivits minskad prostataspecifik antigen (PSA) testning från 2008 till 2013. Den minskade användningen av PSA-screening orsakades av USA: s (USA) förebyggande Tjänstegrupps rekommendationer mot rutinmässig PSA-screening. Detta var en klass D-rekommendation specifikt hos män i åldern 75 år och äldre, som förklarades 2008 och senare utvidgades till alla män 2011 på grund av ökande oro för överdiagnos och överbehandling.2 även om förekomsten av PSA-testning slutade minska och stabiliserades från 2013 till 2015,3 är effekten av screeningreduktion på förekomsten av avancerad sjukdom fortfarande oklart. En analys av ett stort cancerregister som täcker 89% av den amerikanska befolkningen rapporterade att den totala nedgången i PCA-incidensen faktiskt maskerar en ökning av diagnoser i avlägset Stadium från 2010 över ålder och ras.4
oavsett vilken behandling som ges, utvecklas cirka 20% -30% av patienterna med lokaliserad PCa till metastatisk sjukdom, som vanligtvis behandlas med hormonbehandling.5 Detta kan ges genom kirurgisk kastrering (bilateral orchiektomi) eller genom medicinsk kastrering med androgen deprivationsterapi (ADT). Båda metoderna uppnår en kastratnivå av serumtestosteron som betraktas som standard för vård för behandling av metastatisk hormonkänslig PCa (mHSPC). Mhspc är dock avsett att utvecklas till metastatisk kastratresistent prostatacancer (mCRPC).6 Det kastratresistenta prostatacancertillståndet (CRPC) definieras som sjukdomsprogression trots att man når testosteronnivåer i kastrat (serumtestosteron < 50 ng/dL eller 1.7 nmol / L), och kan presentera som antingen en kontinuerlig ökning av PSA-nivåer i serum, progression av befintlig sjukdom och/eller uppkomsten av nya metastaser.7 CRPC har en medianöverlevnad på cirka tre år8 och är förknippad med en signifikant försämring av livskvaliteten.9 den exakta övergångsmekanismen från mHSPC till mCRPC är fortfarande oklart. Det är emellertid känt att androgenreceptorn (AR) trots kastratnivåer av androgener förblir aktiv och fortsätter att driva PCA-progression i CRPC.10 Detta har lett till utvecklingen av nya medel som syftar till att ytterligare minska androgenproduktionen eller blockera AR-funktionen. Det finns dock andra biologiska vägar som fungerar oberoende av androgen signalering och även resultera i CRPC.
flera signifikanta förändringar har inträffat i behandlingsalternativen för mhspc-utrymmet vilket resulterar i betydande överlevnadsfördelar (se länken ”den snabbt utvecklande förvaltningsstrategin för metastatisk hormonkänslig prostatacancer”), inklusive införandet av kemoterapi i CHAARTED study11 och STAMPEDE-studien,12 tillsatsen av abirateronacetat och prednison i LATITUDE study13 och STAMPEDE-studien,14 tillsatsen av enzalutamid i ARCHES trial15 och ENZAMET-studien,16 och slutligen tillsatsen av apalutamid, en oral icke-steroidal anti-androgen, som gillar enzalutamid binder direkt till ligandbindningsdomänen i AR och förhindrar AR-translokation, DNA-bindning och AR-medierad transkription.17 TITAN-studien visade total överlevnad (OS) nytta hos apalutamidbehandlade mhspc-patienter.18 Apalutamid har också visat fördel jämfört med placebo i den icke-metastatiska CRPC (nmCRP)-inställningen i den spartanska fas 3 placebokontrollerade studien,19 liknande den fördel som visas av enzalutamidbehandlade icke-metastatiska kastratresistenta prostatacancerpatienter (nmCRPC), i PROSPER trial20 (se ”de nya behandlingarna för den icke-metastatiska kastratresistenta prostatacancerlänken”). Dessa behandlingsframsteg i mhspc och nmCRPC-inställningen har tagit upp frågan om vilka behandlingsalternativ som ska erbjudas patienter i mCRPC-inställningen.21
behandlingen av män med CRPC har dramatiskt förändrats under de senaste 15 åren. Före 2004, när patienter misslyckades primär ADT, administrerades behandlingar enbart för palliation. Landmärkeförsöken av Tannock et al.22 och Petrylak et al.23 år 2004 var de första som introducerade docetaxel kemoterapi hos mCRPC-patienter som visade sig förbättra deras överlevnad. Sedan docetaxel godkändes av FDA har fem ytterligare fördelaktiga medel som visar en överlevnadsfördel godkänts av FDA baserat på randomiserade kliniska prövningar (Tabell 1). Dessa inkluderar enzalutamid och abirateron, som specifikt påverkar androgenaxeln, sipuleucel-T, som stimulerar immunsystemet;24 cabazitaxel, vilket är ett annat kemoterapeutiskt medel;25 och radium-223, en radionuklidterapi.26 andra behandlingar för mCRPC har visat sig förbättra resultaten men har ännu godkänts av FDA och kommer att diskuteras i en annan översyn. På grund av den betydande ökningen av flera FDA-godkända terapeutiska medel hos patienter med CRPC utmanas kliniker med en mängd behandlingsalternativ och många potentiella sekvenser av dessa medel, vilket gör kliniskt beslutsfattande i mCRPC betydligt mer komplext.
Tabell 1. Agenter som har godkänts för behandling av metastatisk kastratresistent prostatacancer i USA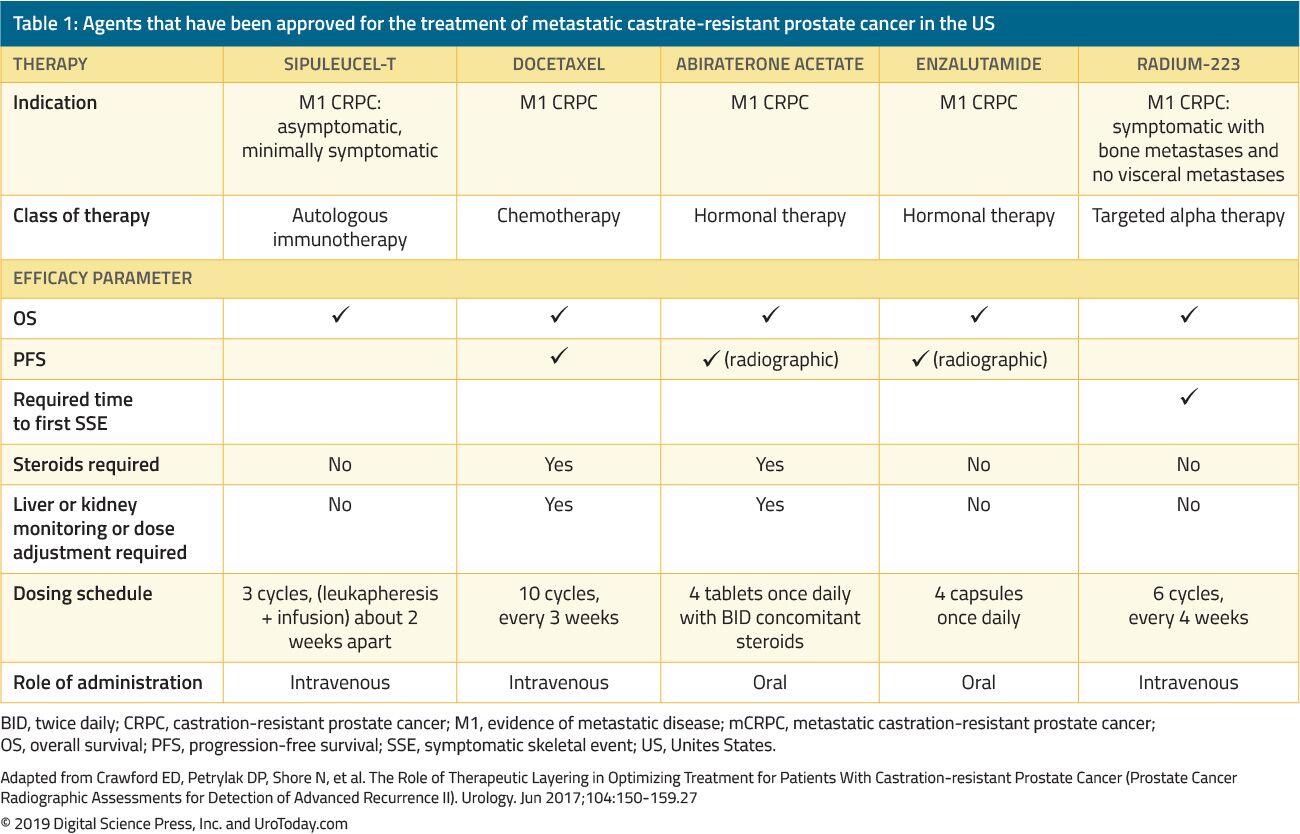
mCRPC är vanligtvis en försvagande sjukdom, och patienter kommer sannolikt att dra nytta av en förvaltningsstrategi formaliserad av ett tvärvetenskapligt team bestående av urologer, medicinska onkologer, strålningsonkologer, sjuksköterskor, psykologer och socialarbetare.28 Det är absolut nödvändigt att diskutera behandlingsalternativ för palliering när man överväger ytterligare systemisk behandling, inklusive hantering av smärta, förstoppning, anorexi, illamående, depression och trötthet.
En annan viktig punkt att tänka på när man fastställer lämplig behandlingssekvens i detta sjukdomsutrymme är den tillhörande kostnaden. Med hjälp av modeller som inkluderade ytterligare behandlingslinjer före eller efter docetaxel var den genomsnittliga kostnaden för mCRPC-behandling under en genomsnittlig period på 28,1 månader ungefär $48,000 per patient.29 denna kostnad är ganska hög på grund av att patienter kan få flera behandlingslinjer och drabbas av pågående medicinska tjänster under sjukdomsförloppet.30
endast två studier har visat en marginell överlevnadsfördel för patienter som återstår på LHRH – analoger istället för att lägga till andra och tredje linjens terapier.31, 32 studier har visat att CRPC inte är resistent mot ADT, utan snarare överkänslig mot den.10 Behandlingsmedierat urvalstryck under ADT får AR att förstärka, och se till att situationen inte eskalerar, ADT fortsätter att administreras i mCRPC-inställningen. Behandlingsmedierat urvalstryck fortsätter också under hela tumörens livslängd, vilket intensifierar behovet av att korrekt sekvensera terapier. Men eftersom potentiella data saknas, överväger den minsta potentiella fördelen med fortsatt kastrering fortfarande den minimala risken för denna behandling. Dessutom har alla senare godkända behandlingar studerats hos män med pågående ADT, vilket ger en annan anledning till varför det bör fortsätta.
innan du går in i de faktiska tillgängliga behandlingsalternativen är det viktigt att inse att det fortfarande är oklart när man ska börja behandlingen hos mCRPC-patienter som är helt asymptomatiska. Det är fortfarande okänt om tidigare behandling är överlägsen, eller om vi ska vänta tills patienten blir symptomatisk och utvecklar smärta. Innan behandlingen påbörjas bör vi överväga patientens befintliga comorbiditeter och förväntade biverkningar av att starta behandlingen. Patienter med tidigt stadium mCRPC i Cou-AA-302-studien som fick abirateron överlevde vanligtvis nästan ett år längre än de som fick placebo (median OS, 53, 6 månader respektive 41, 8 månader, HR, 0, 61; 95% CI, 0, 43 till 0, 87; P = .006).33 således gynnades mCRPC-patienter i tidigt stadium av tidigare start av abirateron. I samma studie ledde patienter med asymptomatisk eller mild symtomatisk mCRPC, med baslinje PSA < 15, 6 ng/mL abirateron också till en snabbare takt och en högre grad av PSA-nedgång än placebo.34 även om de tillgängliga uppgifterna för närvarande är begränsade, tyder det troligen på att det är mer fördelaktigt att starta behandlingen tidigare snarare än senare.33,34
godkända första linjens behandlingsalternativ för metastatisk kastratresistent prostatacancer
abirateron
abirateron är ett antiandrogen som är en hämmare av enzymet 17, 20-lyas (CYP17). COU-AA – 302 fas III-studien utvärderade abirateron hos 1 088 chemo-na-aug, asymptomatiska eller milt symptomatiska mCRPC-patienter utan viscerala metastaser. I denna studie randomiserades patienterna till abirateronacetat eller placebo, båda kombinerade med prednisone35 (Figur 1). Patienterna stratifierades antingen av Eastern Cooperative Oncology Group (ECOG) prestationsstatus 0 eller 1 och av asymptomatisk eller mild symtomatisk sjukdom.35 OS och radiografisk progressionsfri överlevnad (rpfs) var de primära slutpunkterna. Studien visade att efter en medianuppföljning på 22,2 månader var det en signifikant förbättring av rpfs i abirateronarmen (median 16,5 mot 8,2 månader, HR 0,52, p < 0,001). Vid den slutliga analysen efter en medianuppföljning på 49,2 månader var OS-slutpunkten signifikant positiv (34,7 mot 30,3 månader, HR: 0,81, 95% CI: 0,70-0,93, p = 0,0033).36 Det är viktigt att komma ihåg att mCRPC sträcker sig över ett brett prognostiskt spektrum även när det är kemoterapi-na ubicve.37 i en analys av abirateronarmen i Cou-AA-302-studien hade patienter som inte hade någon smärta vid baslinjen, normala alkaliska fosfatas-och LDH-nivåer och mindre än 10 benmetastaser ett median OS på 42, 6 månader.37 patienter med fler riskfaktorer för progression hade dock signifikant kortare median OS.37 vid bedömningen av toxicitetsprofilen för abirateron verkade det ge fler biverkningar relaterade till mineralokortikoidöverskott och leverfunktionsavvikelser, men dessa klassificerades mestadels 1-2 biverkningar. Slutligen visade sig abirateron också vara lika effektivt hos den äldre befolkningen (> 75 år).38
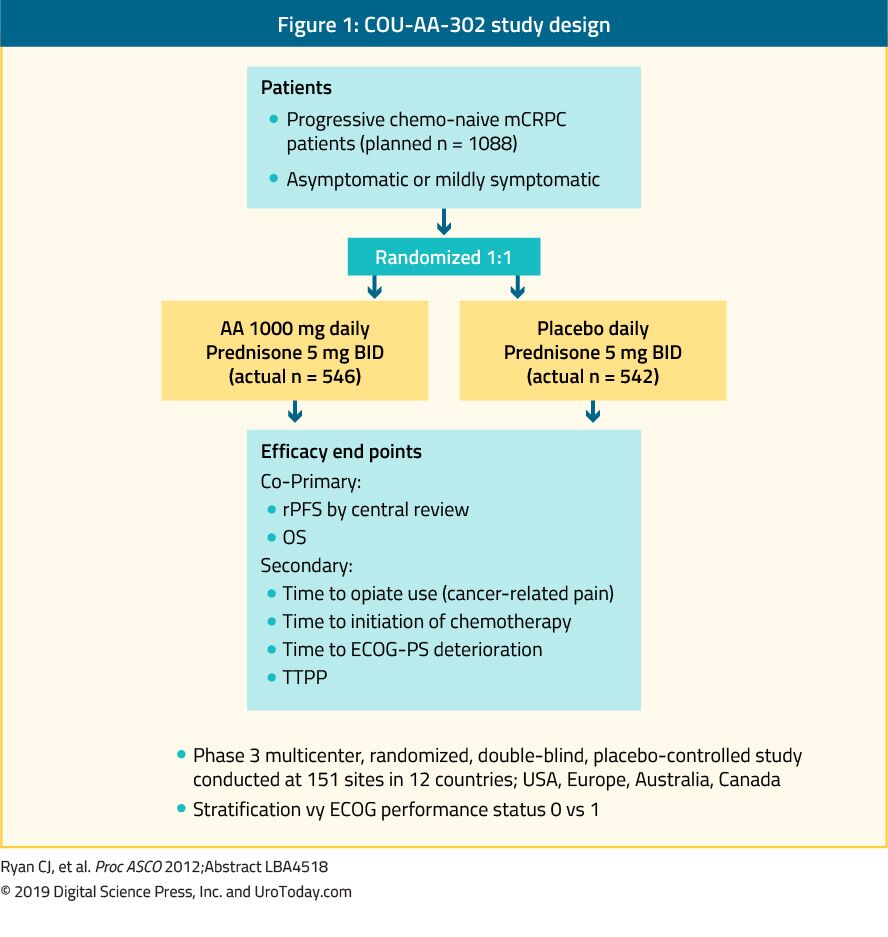
Figur 1. COU-AA – 302 studiedesign
Enzalutamid
Enzalutamid är ett icke-steroidalt antiandrogen. PREVAIL-studien, som är en randomiserad fas III-studie, inkluderade 1,717 chemo-na-jacobve mCRPC-patienter och patienter med viscerala metastaser var också berättigade.39 i denna studie jämfördes enzalutamid med placebo (Figur 2). PREVAIL-studien visade en signifikant förbättring hos enzalutamidbehandlade patienter i båda co-primära endpoints, som inkluderade rPFS (HR: 0,186; CI: 0,15-0,23, p < 0,0001) och OS (HR: 0,706; CI: 0,6-0,84, p < 0.001). Utökad uppföljning och slutlig analys bekräftade en fördel i OS och rPFS för enzalutamid.40 av 78% av patienterna som behandlades med enzalutamid rapporterades en PSA-minskning med mer än 50%. De vanligaste kliniskt relevanta biverkningarna var trötthet och högt blodtryck. Enzalutamid var också lika effektivt och tolererat väl hos äldre män (> 75 år)41 och hos dem med eller utan viscerala metastaser.42 men för män med levermetastaser verkade det inte finnas någon märkbar fördel.43 TERRÄNGSTUDIEN jämförde enzalutamid med bikalutamid, ett äldre antiandrogen, i en randomiserad dubbelblind fas II-studie som visade en signifikant förbättring av PFS (15.7 months vs. 5.8 months, HR: 0.44, p < 0.0001) in favor of enzalutamide.44
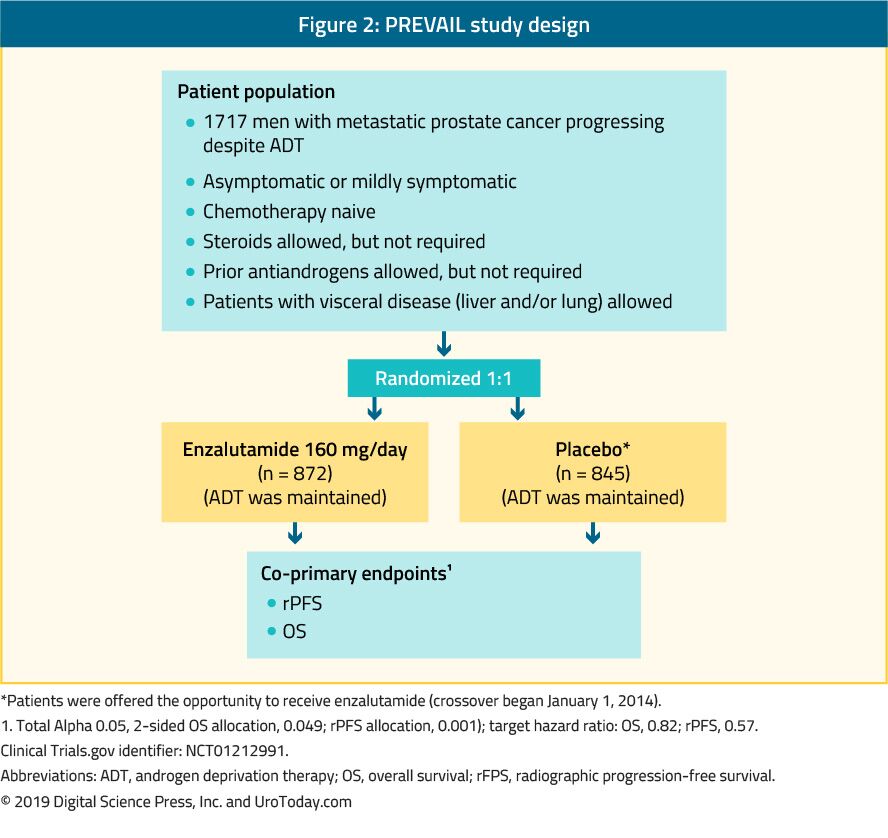
Figure 2. PREVAIL study design
Docetaxel
The landmark trial TAX 327 showed a significant improvement in median OS of 2-2.9 months in mCRPC patients treated with docetaxel-based chemotherapy when compared to patients who were treated with mitoxantrone plus prednisone therapy.22 The SWOG 9916 trial compared mitoxantrone to docetaxel and showed similar results23 (Figure 3). Standard första linjens kemoterapi är docetaxel 75 mg / m2 i tre veckors doser kombinerat med prednison 5 mg två gånger dagligen, upp till tio cykler. Det finns flera viktiga prognostiska faktorer att tänka på vid administrering av docetaxel: viscerala metastaser, smärta, anemi (Hb < 13 g/dL), benskanningsprogression och tidigare estramustinbehandling. Dessa prognostiska faktorer kan bidra till att stratifiera svaret på docetaxel. Med hjälp av dessa prognostiska faktorer kan sjukdomen kategoriseras i låg, mellanliggande och hög risk, med signifikant olika motsvarande median OS-uppskattningar av 25.7, 18,7 respektive 12,8 månader.45 även om ålder i sig inte är en kontraindikation för docetaxel-behandling, måste patienterna vara tillräckligt lämpliga för att uthärda denna typ av behandling och komorbiditeter bör bedömas före behandlingsstart. Hos män som tros vara oförmögna att tolerera standarddos och schema för docetaxel, kan detta minskas från 75 till 50 mg/m2 varannan vecka, visar mindre grad 3-4 biverkningar och en längre tid till behandlingssvikt.46
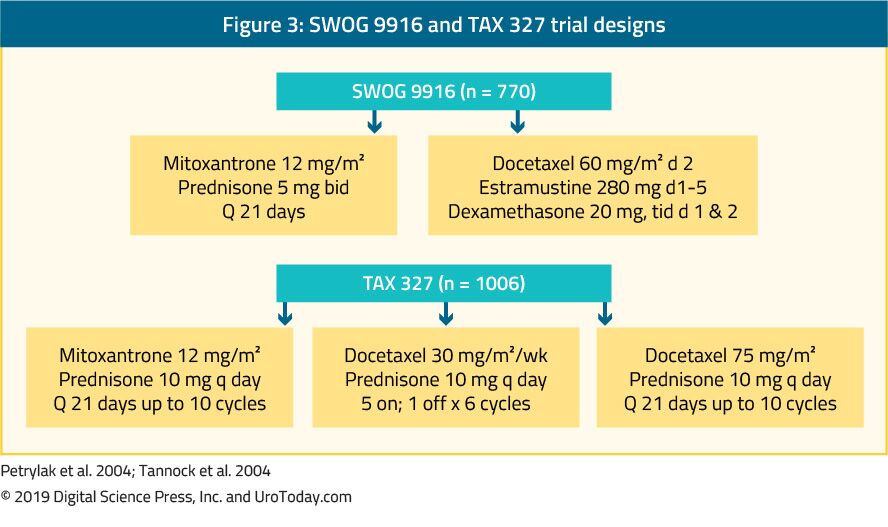
Figur 3. SWOG 9916 och TAX 327 försöksdesign
Sipuleucel-T
Sipuleucel-T, en autolog aktiv cellulär immunterapi, visades i en fas III-studie (IMPACT trial) för att ge en överlevnadsfördel hos 512 asymptomatiska eller minimalt symptomatiska mCRPC-patienter jämfört med placebo24 (Figur 4). Efter en medianuppföljning på 34 månader var medianöverlevnaden signifikant högre i sipuleucel-T-gruppen (25,8 mot 21,7 månader, med en HR på 0,78,p = 0,03).24 Det är viktigt att ingen PSA-nedgång observerades under eller efter behandlingen och PFS var liknande i båda armarna. Den totala toleransen mot sipuleucel-T var mycket god, med mestadels biverkningar av grad 1-2. För närvarande är denna behandling endast tillgänglig i USA och är inte längre tillgänglig i Europa.
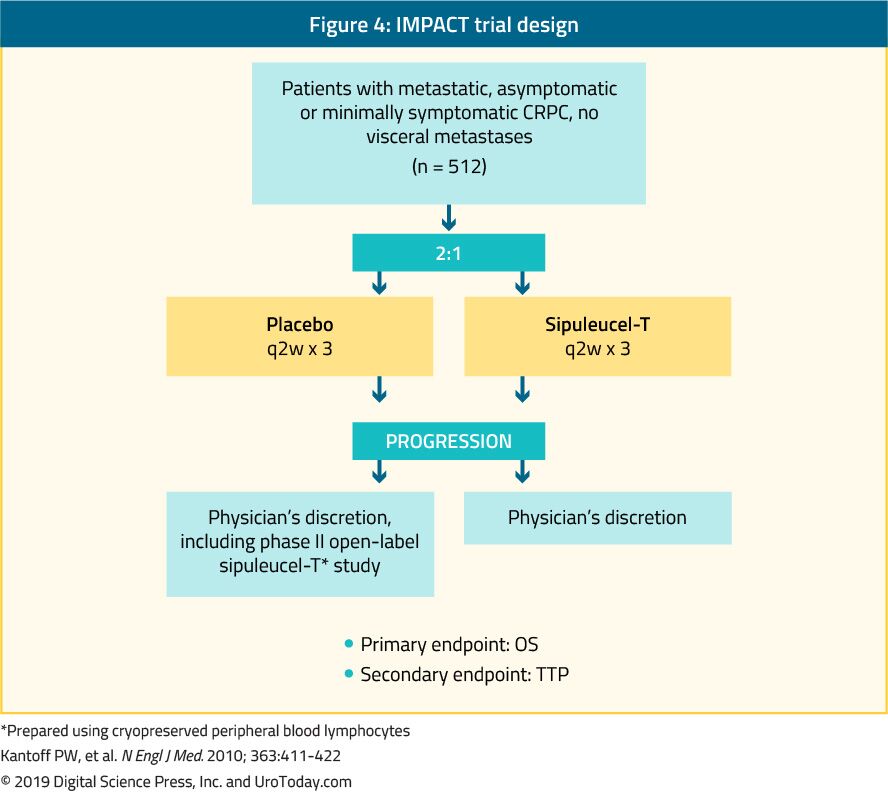
Figur 4. IMPACT trial design
slutsatser
under de senaste 15 åren har det skett betydande vetenskapliga framsteg och investeringar i läkemedelsutveckling för patienter med mCRPC. Detta har resulterat i FDA-godkännande av flera rader av systemiska terapier på grund av smärtlindring, minimering av sjukdomsbiverkningar och OS-förlängning. Hittills är den rapporterade effekten på OS hos mCRPC-patienter från var och en av dessa enskilda medel fortfarande blygsam, vilket resulterar i ett tillägg på bara några månader. Det är nödvändigt att förbättra vår förståelse av mCRPC: s sjukdomsbiologi, integrera en omfattande molekylär förståelse för kastrationsresistens och analysera mekanismer för resistens mot nuvarande terapier för att förbättra framtida behandlingsutveckling. Det är också viktigt att investera och utveckla prediktiva biomarkörer för att hjälpa till med personalisering av terapi. Slutligen, på en mer praktisk anteckning, behövs mer data om lämpliga andra och tredje linjens terapier, och sekvensering och kombination av tillgängliga mediciner, diskuteras mer detaljerat i nästa översynsartikel (”bortom första linjens behandling av metastatisk kastratresistent prostatacancer”).
publicerat datum: November 19th, 2019
Leave a Reply