Biologi för Majors i
lärandemål
- identifiera komponenterna i enkla kemiska reaktioner
alla element är mest stabila när deras yttersta skal fylls med elektroner enligt oktettregeln. Detta beror på att det är energiskt gynnsamt för atomer att vara i den konfigurationen och det gör dem stabila. Eftersom inte alla element har tillräckligt med elektroner för att fylla sina yttersta skal, bildar atomer kemiska bindningar med andra atomer och därigenom erhåller de elektroner de behöver för att uppnå en stabil elektronkonfiguration. När två eller flera atomer kemiskt binder med varandra är den resulterande kemiska strukturen en molekyl. Den välbekanta vattenmolekylen, H2O, består av två väteatomer och en syreatom; dessa binds samman för att bilda vatten, som illustreras i Figur 1. Atomer kan bilda molekyler genom att donera, acceptera eller dela elektroner för att fylla sina yttre skal.
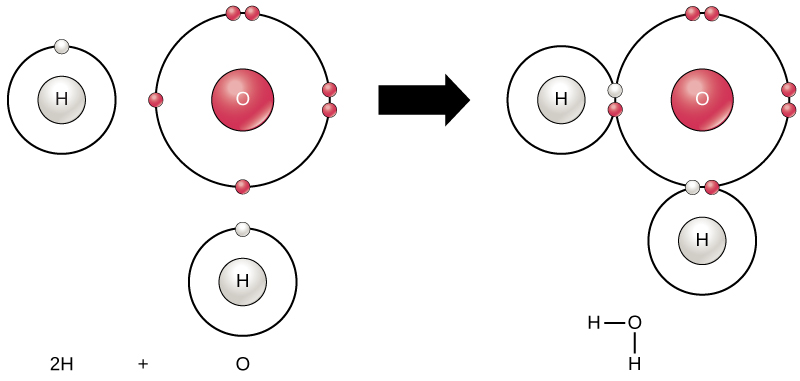
Figur 1. Två eller flera atomer kan binda med varandra för att bilda en molekyl. När två väten och ett syre delar elektroner via kovalenta bindningar bildas en vattenmolekyl.
kemiska reaktioner uppstår när två eller flera atomer binds samman för att bilda molekyler eller när bundna atomer bryts isär. De ämnen som används i början av en kemisk reaktion kallas reaktanterna (vanligtvis finns på vänster sida av en kemisk ekvation), och de ämnen som finns i slutet av reaktionen är kända som produkterna (vanligtvis finns på höger sida av en kemisk ekvation). En pil dras vanligtvis mellan reaktanterna och produkterna för att indikera riktningen för den kemiska reaktionen; denna riktning är inte alltid en ”enkelriktad gata.”För skapandet av vattenmolekylen som visas ovan skulle den kemiska ekvationen vara:
2H + O C2O
ett exempel på en enkel kemisk reaktion är nedbrytningen av väteperoxidmolekyler, som var och en består av två väteatomer bundna till två syreatomer (H2O2). Den reaktanta väteperoxiden bryts ner i vatten, innehållande en syreatom bunden till två väteatomer (H2O) och syre, som består av två bundna syreatomer (O2). I ekvationen nedan innefattar reaktionen två väteperoxidmolekyler och två vattenmolekyler. Detta är ett exempel på en balanserad kemisk ekvation, varvid antalet atomer av varje element är densamma på varje sida av ekvationen. Enligt lagen om bevarande av materia bör antalet atomer före och efter en kemisk reaktion vara lika, så att inga atomer under normala omständigheter skapas eller förstörs.
2H2O2 (väteperoxid) 2H2O(vatten) + O2 (syre)
Även om alla reaktanter och produkter av denna reaktion är molekyler (varje atom förblir bunden till minst en annan atom), är endast väteperoxid och vatten i denna reaktion representativa för en underklass av molekyler som kallas föreningar: de innehåller atomer av mer än en typ av element. Molekylärt syre, å andra sidan, som visas i Figur 2, består av två dubbelt bundna syreatomer och klassificeras inte som en förening utan som ett element.
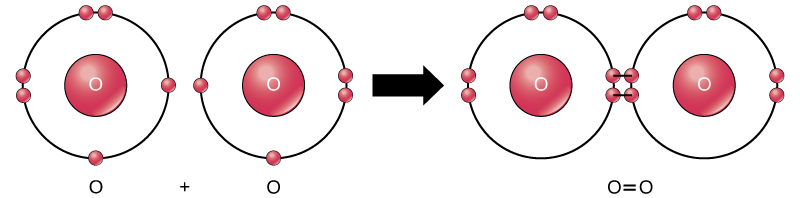
Figur 2. Syreatomerna i en O2-molekyl förenas med en dubbelbindning.
vissa kemiska reaktioner, såsom den som visas ovan, kan fortsätta i en riktning tills reaktanterna är alla förbrukade. Ekvationerna som beskriver dessa reaktioner innehåller en enkelriktad pil och är irreversibla. Reversibla reaktioner är de som kan gå i båda riktningarna. Vid reversibla reaktioner omvandlas reaktanter till produkter, men när koncentrationen av produkten går utöver en viss tröskel (karakteristisk för den specifika reaktionen) kommer vissa av dessa produkter att omvandlas tillbaka till reaktanter; vid denna tidpunkt vänds beteckningarna för produkter och reaktanter. Detta fram och tillbaka fortsätter tills en viss relativ balans mellan reaktanter och produkter uppstår—ett tillstånd som kallas jämvikt. Dessa situationer med reversibla reaktioner betecknas ofta med en kemisk ekvation med en dubbelhårig pil som pekar mot både reaktanterna och produkterna.
till exempel i humant blod binder överskott av vätejoner (H+) till bikarbonatjoner (HCO3–) som bildar ett jämviktstillstånd med kolsyra (H2CO3). Om kolsyra tillsattes till detta system skulle en del av det omvandlas till bikarbonat och vätejoner.
HCO3– + h+ C2CO3
i biologiska reaktioner erhålls emellertid jämvikt sällan eftersom koncentrationerna av reaktanterna eller produkterna eller båda ständigt förändras, ofta med en produkt av en reaktion som en reaktant för en annan. För att återgå till exemplet med överskott av vätejoner i blodet kommer bildandet av kolsyra att vara huvudriktningen för reaktionen. Kolsyran kan emellertid också lämna kroppen som koldioxidgas (via utandning) istället för att omvandlas tillbaka till bikarbonatjon, vilket driver reaktionen till höger genom kemisk lag som kallas lag om massåtgärd. Dessa reaktioner är viktiga för att upprätthålla homeostasen i vårt blod.
HCO3 – + h + cu 2CO3 cu 2 + H2O
i sammanfattning: Kemiska reaktioner och molekyler
det yttre elektronskalet dikterar hur lätt och vilken typ av kemiska bindningar en viss atom kommer att bildas. Bildandet av föreningar beskrivs ofta visuellt i kemiska ekvationer som visar de reaktanter som deltar i kemiska reaktioner för att bilda produkter.
prova det
bidra!
förbättra denna sidalär dig mer
Leave a Reply