1.14: att skilja mellan pH och pKa
relativ surhet och pKa-värden
en tillämpning av Henderson-Hasselbach ekvationen är förmågan att bestämma den relativa surheten hos föreningar genom att jämföra deras pKa-värden. Ju starkare en syra, desto större jonisering, desto lägre pKa, och ju lägre pH föreningen kommer att producera i lösning. Vissa utvalda PKA-värden för föreningar i studien av organisk kemi visas nedan. Eftersom organiska reaktioner kan utföras i icke-vattenhaltiga miljöer kan pH överstiga 14 och organiska föreningar kan ha pKa-värden över 16. Det är en variation på den linjen från Trollkarlen från Oz, ” Vi lever inte längre i vatten.”





det är mycket bra att engagera sig i minnet de ungefärliga pKa-områdena för föreningarna ovan. Ett ord av försiktighet: när du använder PKA-tabellen, var helt säker på att du överväger rätt konjugatsyra/baspar. Om du blir ombedd att säga något om ammoniakens basicitet (NH3) jämfört med etoxidjon (CH3CH2O-), till exempel, är de relevanta pKa-värdena att överväga 9, 2 (PKA för ammoniumjon) och 16 (PKA för etanol). Från dessa siffror vet du att etoxid är den starkare basen. Gör inte misstaget att använda pKa-värdet på 38: Detta är PKA av ammoniak som fungerar som en syra och berättar hur grundläggande NH2 – jonen är (väldigt grundläggande!)
* en anteckning på PKA av vatten: PKa av vatten är 14. Biokemi och organisk kemi texter listar ofta värdet som 15.7. Dessa texter har felaktigt beaktat det molära värdet för koncentrationen av vatten i jämviktskonstanten. Den korrekta härledningen av jämviktskonstanten involverar aktiviteten av vatten, som har ett värde av 1.
exempel
medan denna kurs börjar med enstaka funktionella grupper, kommer vi så småningom att arbeta med intressanta föreningar som innehåller flera funktionella grupper. Att erkänna vilka väten som kan joniseras som sura protoner och vilka väten inte kan, är en användbar färdighet. Lägg märke till i detta exempel att vi måste utvärdera den potentiella surheten på fyra olika platser på molekylen.
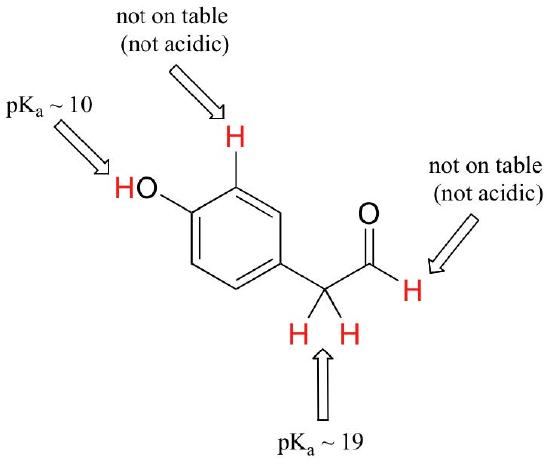
aldehyd och aromatiska protoner är inte alls sura (pKavalues är över 40 – inte på vårt bord). De två protonerna på kolet bredvid karbonylen är något sura, med pKa-värden runt 19-20 enligt tabellen. Den suraste protonen är på fenolgruppen, så om föreningen skulle utsättas för en enda molär ekvivalent med stark bas, är detta protonen som skulle doneras.
sur& grundläggande miljöer – allt är relativt i reaktivitet
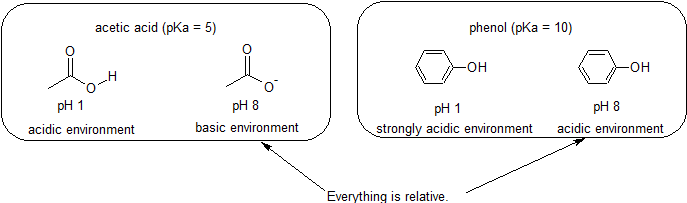
eftersom vårt mål är att förstå dynamisk kemisk reaktivitet behöver vi inte veta den specifika mängden protonerade och oskyddade former av en förening. Vi behöver helt enkelt veta vilken form som dominerar. När miljöens pH är mindre än föreningens PKA anses miljön vara sur och föreningen kommer att existera övervägande i sin protonerade form. När miljöens pH är större än föreningens PKA anses miljön vara basisk och föreningen kommer att existera övervägande i sin deprotonerade form.
till exempel är PKA av ättiksyra ca 5. Vid ett pH av 1 anses miljön vara sur och ättiksyra existerar övervägande i sin protonerade form. Vid pH 8 anses miljön vara basisk och ättiksyra avprotoneras för att bilda acetat (CH3CO2-). Omvänt är PKA av fenol 10. Vid pH 8 anses miljön vara sur för fenol och den förblir främst protonerad.
det är också viktigt att komma ihåg att organisk kemi inte behöver förekomma i vatten så pKa-värden kan vara så höga som 50.
övning
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
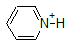 |
 |
 |
 |
 |
 |
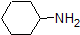 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply