NOAA Global Monitoring Laboratory – Halocarbons and other Atmospheric Trace Species
Chlorofluorocarbons (CFCs)
(published in The Chapman & Hall Encyclopedia of Environmental Science, edited by David E. Alexander and Rhodes W. Fairbridge, pp pp.78-80, Kluwer Academic, Boston, MA, 1999.)
Chlorofluorocarbons (CFCs) are nontoxic, nonflammable chemicals containing atoms of carbon, chlorine, and fluorine. Acestea sunt utilizate la fabricarea spray-urilor cu aerosoli, agenți de suflare pentru Spume și materiale de ambalare, ca solvenți și ca agenți frigorifici. CFC-urile sunt clasificate ca halocarburi, o clasă de compuși care conțin atomi de atomi de carbon și halogen. Moleculele CFC individuale sunt etichetate cu un sistem unic de numerotare. De exemplu, numărul CFC de 11 indică numărul de atomi de carbon, hidrogen, fluor și clor (de exemplu, CCl3F ca CFC-11). Cel mai bun mod de a vă aminti sistemul este „regula lui 90” sau adăugați 90 la numărul CFC unde prima cifră este numărul de atomi de carbon (C), A doua cifră este numărul de atomi de hidrogen (H), iar a treia cifră este numărul atomilor de fluor (F). Numărul total de atomi de clor(Cl) se calculează prin expresia: Cl = 2 (C+1) – H – F. În exemplul CFC-11 are un carbon, fără hidrogen, un fluor și, prin urmare, 3 atomi de clor.
frigiderele de la sfârșitul anilor 1800 și începutul anilor 1900 foloseau gazele toxice, amoniacul (NH3), clorura de metil (CH3Cl) și dioxidul de sulf (SO2), ca agenți frigorifici. După o serie de accidente fatale în anii 1920, când clorura de metil s – a scurs din frigidere, A început căutarea unui înlocuitor mai puțin toxic ca un efort de colaborare al trei corporații americane-Frigidaire, General Motors, și Du Pont. CFC-urile au fost sintetizate pentru prima dată în 1928 de Thomas Midgley, Jr.de la General Motors, ca substanțe chimice mai sigure pentru frigiderele utilizate în aplicații comerciale mari1. Frigidaire a primit primul brevet, numărul 1.886.339, pentru formula CFC la 31 decembrie 1928. În 1930, General Motors și Du Pont au format Kinetic Chemical Company pentru a produce Freon (un nume comercial Du Pont pentru CFC) în cantități mari. Până în 1935 Frigidaire și concurenții săi vânduseră 8 milioane de frigidere noi în Statele Unite folosind Freon-12 (CFC-12) fabricat de Kinetic Chemical Company și acele companii care au fost autorizate să fabrice acest compus. În 1932, Carrier Engineering Corporation a folosit Freon-11 (CFC-11) în prima unitate de aer condiționat auto-conținută din lume, numită „Cabinetul atmosferic”.; Din cauza recordului de siguranță CFC pentru netoxicitate, freonul a devenit lichidul de răcire preferat în sistemele mari de aer condiționat. Codurile de Sănătate Publică din multe orașe americane au fost revizuite pentru a desemna freonul ca singurul lichid de răcire care ar putea fi utilizat în clădirile publice. După Al Doilea Război Mondial, CFC-urile au fost folosite ca propulsori pentru spray-uri de insecte, vopsele, balsamuri de păr și alte produse de îngrijire a sănătății. La sfârșitul anilor 1950 și începutul anilor 1960, CFC-urile au făcut posibilă o soluție ieftină pentru dorința de aer condiționat în multe automobile, case și clădiri de birouri. Mai târziu, creșterea utilizării CFC a decolat la nivel mondial cu vârf, vânzări anuale de aproximativ un miliard de dolari (SUA) și mai mult de un milion de tone metrice de CFC produse. în timp ce CFC-urile sunt sigure de utilizat în majoritatea aplicațiilor și sunt inerte în atmosfera inferioară, ele suferă reacții semnificative în atmosfera superioară sau stratosferă. În 1974, doi chimiști de la Universitatea din California, profesorul F. Sherwood Rowland și Dr. Mario Molina, a arătat că CFC-urile ar putea fi o sursă majoră de clor anorganic în stratosferă în urma descompunerii lor fotolitice prin radiații UV. În plus, o parte din clorul eliberat ar deveni activ în distrugerea ozonului din stratosferă2. Ozonul este un gaz de urmă situat în principal în stratosferă (vezi ozon). Ozonul absoarbe radiațiile ultraviolete dăunătoare în lungimile de undă cuprinse între 280 și 320 nm ale benzii UV-B, care pot provoca daune biologice la plante și animale. O pierdere de ozon stratosferic are ca rezultat radiații UV-B mai dăunătoare care ajung la suprafața Pământului. Clorul eliberat din CFC distruge ozonul în reacții catalitice în care 100.000 de molecule de ozon pot fi distruse pe atom de clor.
o epuizare mare de primăvară a ozonului stratosferic se agrava în fiecare an următor. Această pierdere de ozon a fost descrisă în 1985 de cercetătorul britanic Joe Farman și colegii săi3. A fost numit de către alții Hole de ozon din Antarctica de către alții. Gaura de ozon a fost diferită de pierderea de ozon în medii. Pierderea a fost mai mare asupra Antarcticii decât a latitudinilor medii din cauza multor factori: temperaturile neobișnuit de reci ale regiunii, izolarea dinamică a acestui Centauri, precum și reacțiile sinergice ale clorului și bromului4. Pierderea de ozon este, de asemenea, îmbunătățită în regiunile polare ca urmare a reacțiilor care implică nori stratosferici polari (PSCs)5 și în medii în urma erupțiilor vulcanice. Nevoia de control al CFC-urilor a devenit urgentă.
în 1987, 27 de națiuni au semnat un tratat global de mediu, Protocolul de la Montreal pentru a Reduce substanțele care epuizează stratul de Ozon6, care avea o prevedere pentru a reduce nivelurile de producție din 1986 ale acestor compuși cu 50% înainte de anul 2000. Acest Acord internațional a inclus restricții privind producția de CFC-11, -12, -113, -114, -115, și Halonii(substanțe chimice utilizate ca agenți de stingere a incendiilor). Un amendament aprobat la Londra în 1990 a fost mai puternic și a cerut eliminarea producției până în anul 2000. Solvenții clorurați, cloroformul de metil (CH3CCl3) și tetraclorura de carbon (CCl4) au fost adăugați la amendamentul de la Londra. cantități mari de clor stratosferic reactiv sub formă de monoxid de clor (ClO) care ar putea rezulta doar din distrugerea ozonului de către CFC-uri în stratosferă au fost observate de instrumentele de la bordul aeronavei NASA ER-2 și UARS (Upper Atmospheric Research Satellite) în unele regiuni din America de Nord în timpul iernii 19927,8. Preocuparea de mediu pentru CFC-uri rezultă din durata lor lungă de viață atmosferică (55 de ani pentru CFC-11 și 140 de ani pentru CFC-12, CCl2F2)9, care limitează capacitatea noastră de a reduce abundența lor în atmosferă și pierderile viitoare de ozon asociate. Acest lucru a dus la amendamentul de la Copenhaga care a limitat și mai mult producția și a fost aprobat mai târziu în 1992. Fabricarea acestor substanțe chimice sa încheiat în cea mai mare parte la 1 ianuarie 1996. Singurele excepții aprobate au fost pentru producția în țările în curs de dezvoltare și pentru unele aplicații exceptate în medicină (de exemplu, inhalatoare de astm) și cercetare. Protocolul de la Montreal a inclus dispoziții de aplicare prin aplicarea de sancțiuni economice și comerciale în cazul în care o țară semnatară comercializează sau produce aceste substanțe chimice interzise. Un total de 148 de țări semnatare au semnat acum protocolul de la Montreal. Măsurătorile atmosferice CFC-11 și CFC-12 raportate în 1993 au arătat că ratele lor de creștere au scăzut atât ca urmare a reducerilor voluntare, cât și a celor obligatorii ale emisiei9. Mulți CFC și solvenți clorurați Selectați s-au nivelat (Figura 1) sau au scăzut în concentrație cu 19949,10.
cererea de CFC a fost acomodată prin reciclarea și reutilizarea stocurilor existente de CFC și prin utilizarea de înlocuitori. Unele aplicații, de exemplu degresarea metalelor și solvenții de curățare pentru plăcile de circuite, care odată utilizate CFC folosesc acum fluide fără halocarbon, apă (uneori sub formă de abur) și acizi citrici diluați. Industria a dezvoltat două clase de înlocuitori de halocarbon – hidroclorofluorocarburi (HCFC) și hidrofluorocarburi (hfc). HCFC-urile includ atomi de hidrogen pe lângă clor, fluor și atomi de carbon. Avantajul utilizării HCFC este că hidrogenul reacționează cu hidroxilul troposferic (OH), rezultând o durată de viață atmosferică mai scurtă. HCFC-22 (CHClF2) are o durată de viață atmosferică de aproximativ 13 ani11 și a fost utilizat în aer condiționat la domiciliu cu cerere redusă și în unele aplicații de refrigerare din 1975. Cu toate acestea, HCFC-urile conțin încă clor, ceea ce face posibilă distrugerea ozonului. Amendamentul de la Copenhaga solicită eliminarea producției lor până în anul 2030. Hfc-urile sunt considerate unul dintre cei mai buni înlocuitori pentru reducerea pierderilor de ozon stratosferic din cauza duratei lor scurte de viață și a lipsei de clor. În Statele Unite, HFC-134a este utilizat în toate noile aparate de aer condiționat auto. De exemplu, HFC-134a crește rapid în 1995, cu o rată de creștere de aproximativ 100% pe an, cu o durată de viață atmosferică de aproximativ 12 ani12. („Regula 90” se aplică și pentru formula chimică a HCFC și HFC.)
utilizarea CFC-urilor, a unor solvenți clorurați și a Halonilor ar trebui să devină caducă în următorul deceniu dacă protocolul de la Montreal este respectat de toate părțile și se utilizează înlocuitori. Știința care a devenit baza Protocolului de la Montreal a dus la Premiul Nobel pentru Chimie din 1995. Premiul a fost acordat în comun profesorilor F. S. Rowland la Universitatea din California la Irvine, M. Molina la Massachusetts Institute of Technology, Cambridge, și Paul Crutzen la Max-Planck-Institute for Chemistry din Mainz, Germania, pentru munca lor în chimia atmosferică, în special în ceea ce privește formarea și descompunerea ozonului (în special, de CFC și oxizi de azot).
1Midgley, T. și Henne, A., fluoruri organice ca agenți frigorifici, Chimie Industrială și inginerească, 22, 542-547, 1930.
2Molina, M. J. și F. S. Rowland, chiuvetă stratosferică pentru clorofluorometani: Distrugerea catalizată a atomului de clor a ozonului, natura, 249, 810-814, 1974.
3Farman, J. C., B. G. Gardiner și J. D. Shanklin, pierderile mari de ozon total din Antarctica dezvăluie interacțiunea sezonieră ClOx / NOx, natură, 315.207-210, 1985.
4McElroy, Mb, RJ Salawitch, SC Wofsy și Ja Logan, reduceri ale ozonului Antarctic datorită interacțiunilor sinergice dintre clor și brom, Nature, 321, 759-762, 1986. 5Solomon, S., R. R. Garcia, F. S. Rowland și D. J. Wuebbles, despre epuizarea ozonului Antarctic, Nature, 321, 755-758, 1986.
6protocolul Montreal privind substanțele care epuizează stratul de ozon, 15 pp, Programul Națiunilor Unite pentru mediu( UNEP), New York, 1987.
7Toohey, D. W., L. M. Avallone, L. R. Lait, P. A. Newman, M. R. Schoeberl, D. W. Fahey, E. L. Woodbridge și J. G. Anderson, evoluția sezonieră a clorului reactiv în stratosfera emisferei nordice, știință, 261, 1134-1136, 1993.
8Waters, J., L. Froidevaux, W. Read, G. Manney, L. .Elson, D. Flower, R. Jarnot și R. Harwood, stratosferic CLO andozone de la sunetul cu microunde al membrelor de pe satelitul de cercetare a atmosferei superioare, Nature, 362, 597-602, 1993. 9Elkins, J. W., T. M. Thompson, T. H. Swanson, J. H. Butler, B. D. Hall, S. O. Cummings, D. A. Fisher și A. G. Raffo, scăderea ratelor de creștere a clorofluorocarburilor atmosferice 11 și 12, Nature, 364 , 780-783, 1993.
10Prinn, R. G., R. F. Weiss, B. R. Miller, J. Huang, F. N. Alyea, D. M. Cunnold, P. J. Fraser, D. E. Hartley și P. G. Simmonds, tendințe atmosferice și vieți ale ch3ccl3 și concentrații globale de OH, știință, 269, 187-192, 1995.
11Montzka, S. A., R. C. Myers, J. H. Butler, S. C. Cummings și J. W. Elkins, scala globală de distribuție și calibrare troposferică a HCFC-22, scrisori de cercetare Geofizică, 20 (8), 703-706, 1993. 12Montzka, S. A., R. C. Myers, J. H. Butler, J. W. Elkins, L. T. Lock, A. D. Clarke și A. H. Goldstein, observații ale HFC-134a în troposfera îndepărtată, Geophysical Research Letters, 23, 169-172, 1996.
a sugerat o lectură suplimentară:
Cagin, S. și P. Dray, între Pământ și cer: cum CFC-urile au schimbat lumea noastră și au amenințat stratul de ozon, 512 pp., Pantheon Press, New York, 1993.
evaluarea științifică a epuizării ozonului: 1994, editat de D. L. Albritton, R. T. Watson și R. J. Aucamp, 37, 451 pp., Organizația Meteorologică Mondială (OMM), Geneva, 1995.
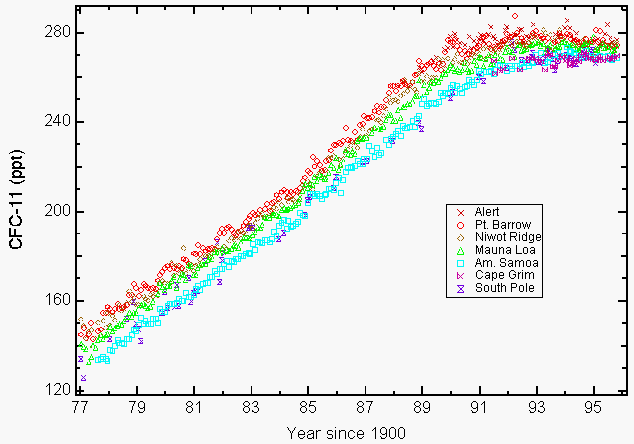
Figura 1: acumularea de clorofluorocarbon-11 (CFC-11) în atmosferă se oprește ca urmare a reducerilor voluntare și obligatorii ale emisiilor. Mijloace lunare raportate ca raporturi de amestecare uscată în părți pe trilion (ppt) pentru CFC-11 la nivelul solului pentru patru stații NOAA/CMDL (pt. Barrow, Alaska; Mauna Loa, Hawaii; Cape Matatula, Samoa Americană; și Polul Sud) și trei stații de cooperare (alertă, Teritoriile de Nord-Vest, Canada (serviciul de mediu atmosferic); Niwot Ridge, Colorado (Universitatea din Colorado); Cape Grim Baseline Air Pollution Station, Tasmania, Australia, (Commonwealth Scientific and Industrial Research Organization) 9. (Prin amabilitatea NOAA/CMDL)
Leave a Reply