Legătură chimică
legăturile chimice sunt atracțiile dintre atomi care îi țin împreună pentru a forma compuși. Există trei tipuri majore de legături: legături covalente care leagă împreună compuși moleculari, legături ionice care leagă sărurile și cristalele ionice și legături metalice care leagă atomii metalelor.
molecule și legături covalente
majoritatea combustibililor, materialelor plastice și produselor naturale sunt compuși moleculari, făcuți din atomi legați împreună în molecule. Tipul de legătură care unește atomii unei molecule este legătura covalentă, care apare atunci când electronii exteriori ai doi atomi sunt împărțiți între ei, creând o atracție între cei doi atomi.
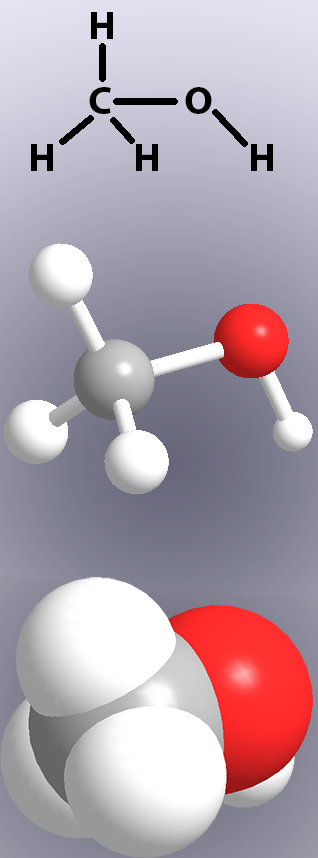
legăturile covalente sunt prezentate în structurile chimice prin linii (Figura 1, sus) și în modele fie prin afișarea ‘bastoanelor’, fie prin suprapunerea atomilor (Figura 1, mijloc și jos). electronii dintr-o legătură covalentă nu sunt întotdeauna împărțiți în mod egal între cei doi atomi. Când împărțirea este inegală, un atom va avea o sarcină pozitivă foarte ușoară, iar celălalt atom va fi ușor negativ. Aceasta lăzi un mic dipol electric – moleculele care conțin un dipol sunt compuși polari. Dacă o moleculă este polară sau nepolară îi va afecta proprietățile, cum ar fi punctele de topire și fierbere și legarea hidrogenului.
citiți mai multe despre legătura covalentă pe Libretextul chimic.
lipirea Ionică și metalică
în timp ce legătura covalentă implică partajarea electronilor între doi atomi, legătura ionică implică transferul complet al electronilor de la un atom la altul, creând ioni pozitivi și negativi. Acești ioni sunt apoi ținuți împreună de atracția dintre sarcinile lor opuse. Compușii ionici formează cristale pe baza acestor atracții.
lipirea metalică implică partajarea completă a electronilor de valență ai atomilor de metal, creând o „mare de electroni” în care electronii sunt liberi să se miște. Aceasta face parte din motivul conductivității ridicate a metalelor. Read more about metallic bonding at the Chemistry LibreText
energie și legături chimice
În general, energia va fi eliberată atunci când se formează o legătură între doi atomi, indiferent de tipul de legătură. În mod similar, dacă există deja o legătură între doi atomi, va fi necesară energie pentru a o rupe. Cantitatea de energie necesară pentru a rupe o legătură este aceeași cu cantitatea de energie eliberată atunci când se formează.
majoritatea reacțiilor chimice implică atât ruperea, cât și realizarea legăturilor chimice. Dacă energia eliberată prin formarea de noi legături este mai mare decât energia necesară pentru a rupe legăturile „vechi”, energia va fi eliberată în general de reacție. Această energie poate fi pierdută sub formă de căldură sau poate fi utilizată pentru energie.
de exemplu, arderea metanului (CH4) urmează această reacție chimică:
această reacție implică ruperea celor patru legături carbon-hidrogen din metan și legătura oxigen-oxigen din O2. Noile legături formate sunt cele două legături carbon-oxigen (în CO2) și legături hidrogen-oxigen (în H2O). Aceste noi legături au mai puțină energie în general decât legăturile originale, astfel încât energia va fi eliberată prin această reacție. Eliberarea energiei este o caracteristică a reacțiilor de combustie-este posibil să fi observat acest lucru atunci când simțiți o flacără fierbinte. Animația de mai jos ilustrează arderea hidrocarburilor de metan.
deoarece o cantitate mare de energie este eliberată la formarea CO2 și H2O în arderea hidrocarburilor precum metanul, acestea sunt o sursă bună de energie primară. De asemenea, înseamnă că ar fi necesară o cantitate mare de energie pentru a rupe legăturile din CO2 și a forma alte molecule. Acesta este unul dintre motivele pentru care fotosinteza necesită atât de multă energie (de la lumina soarelui) pentru a converti CO2 în carbohidrați.
pentru lecturi suplimentare
- energie chimică
- combustie
- energie primară
- tehnologie de conversie a energiei
- sau explorați o Pagină aleatorie
Leave a Reply