hidroxid de sodiu
hidroxid de sodiu proprietăți chimice,utilizări,producție
proprietăți chimice
hidroxidul de sodiu este un material alcalin alb, inodor, nevolatil comercializat sub formă solidă sub formă de pelete, fulgi, aglomerări sau bastoane. Solubilitatea sa în apă este de 111% în greutate și o presiune a vaporilor de 0mmHg (NIOSH, 1994).
poate reacționa cu tricholetilena (TCE) pentru a forma dicloroacetilenă inflamabilă și cu metale pentru a forma hidrogen gazos (oehha, 1993). Reactivitatea sa cu metalele trebuie luată în considerare în ceea ce privește unitățile de stocare și containerele.
hidroxidul de sodiu este disponibil în mod obișnuit ca o soluție apoasă cunoscută sub numele de sodă caustică, leșie de sodă sau simplă ca leșie. Are diverse utilizări, inclusiv neutralizarea acidului; fabricarea hârtiei, textilelor, materialelor plastice, corozivilor, coloranților, vopselei, îndepărtării vopselei și săpunului; rafinarea petrolului; galvanizare; curățarea metalelor; spălare; și spălarea vaselor. O utilizare înfloritoare a fost în fabricarea ilegală de metamfetamină.
utilizări
hidroxidul de sodiu (NaOH) este unul dintre cei mai utili compuși industriali de sodiu. Este, de asemenea, cunoscut sub numele de leșie sau sodă caustică și este una dintre cele mai puternice baze alcaline (valoare ridicată a pH-ului)de pe piața gospodăriei. Este folosit ca un dispozitiv de curățare a scurgerilor și a cuptorului și saponifică grăsimile înfabricarea săpunului. Trebuie utilizat cu grijă, deoarece este, de asemenea, capabil să producă arsuri grave ale pielii.
descriere
hidroxidul de sodiu, cunoscut și sub denumirea de leșie și sodă caustică, este o substanță foarte caustică utilizată în cantități mici în produsele cosmetice pentru a stabili și menține pH-ul unui produs.Hidroxidul de sodiu este un compus extrem de important în viața noastră, deoarece are atât de multe utilizări. Este o bază foarte comună utilizată în industria chimică și este folosită pentru multe lucruri, dintre care multe apar în viața noastră de zi cu zi. Una dintre cele mai cunoscute utilizări ale hidroxidului de sodiu este utilizarea sa în decuplarea scurgerilor. Vine în multe mărci diferite de curățători de scurgere, dar una dintre cele mai frecvente este Drano. De asemenea, vine sub formă de săpun de leșie care poate fi folosit pentru a spăla practic orice, de la vase până la față.
structura hidroxidului de sodiu
La temperatura camerei, hidroxidul de sodiu este un solid alb cristalin inodor care absoarbe umezeala din aer. Este o substanță fabricată. Hidroxidul de sodiu este un compus anorganic utilizat pentru a controla nivelul pH-ului sau pentru a servi ca agent de tamponare în produsele cosmetice și de îngrijire personală. A fost folosit istoric în formularea săpunurilor, dar este văzut în prezent într-o varietate de formule, inclusiv produse pentru baie, produse de curățare, parfumuri, pulberi pentru picioare, vopsele și culori pentru păr, machiaj, produse pentru unghii, produse de curățenie personală, șampoane, produse de bărbierit, depilatoare, produse de îngrijire a pielii și produse pentru bronzare, precum și produse chimice pentru îndreptarea părului și seturi de valuri de păr. Este, de asemenea, un ingredient popular în solvenții industriali ca bază chimică pentru săpunuri, detergenți pentru cuptoare, detergenți și curățători de scurgere datorită capacității sale de a dizolva grăsimi, uleiuri, grăsimi și depozite pe bază de proteine, potrivit Wikipedia. Mai rar, hidroxidul de sodiu este văzut ca ingredient în pastele de dinți.hidroxidul de sodiu este aprobat de FDA și a primit ratingul GRAS (în general recunoscut ca sigur) ca aditiv alimentar direct. Cu toate acestea, este utilizat în principal în spălarea și peelingul chimic al produselor. Este aprobat pentru utilizare în produse cosmetice și produse de îngrijire personală în concentrații diferite: 5% în greutate în solvenți pentru cuticule pentru unghii, 2% în greutate în îndreptarea părului pentru uz general, 4,5% în greutate în îndreptarea părului pentru uz profesional, până la un pH 12,7 în depilatoare și până la pH 11 în alte utilizări ca regulator de pH.
https://pubchem.ncbi.nlm.nih.gov/compound/sodium_hydroxide
http://sodiumhydroxide.weebly.com/uses.html
proprietăți chimice
hidroxidul de sodiu, NaOH,denumit și sodă caustică sau hidrat de sodiu(și cunoscut anterior ca leșie), este un solid cristalin alb,masiv, delicvescent,care este solubil în apă, alcool și glicerol. Se topește la 318 c (606 de) și este cea mai utilizată și disponibilă substanță chimică alcalină. Majoritatea hidroxidului de sodiu este produs ca un coprodus al clorului prin utilizarea celulelor electrolitice;celulele sunt de tip diafragmă, mercur sau membrană. Unele hidroxid de sodiu este marcat ca produs în celule;cele mai multe sunt evaporate și vândute ca soluții 50% și 73% sau ca granule anhidre. Majoritatea utilizărilor finale caustice necesită soluții cu concentrații relativ scăzute. Soda caustică este utilizată ca reactiv analitic și intermediar chimic, în băile de curățare și curățare,în recuperarea cauciucului și rafinarea petrolului, în băile de stingere pentru tratarea termică a oțelului,în uleiurile de tăiere și solubile,în săpunuri și detergenți și într-o mare varietate de alte aplicații.
proprietăți chimice
NaOH este un material alb, inodor, delicvescent vândut sub formă de pelete, fulgi, bulgări sau bastoane. Soluțiile apoase sunt cunoscute sub numele de leșie de sodă
proprietăți chimice
hidroxidul de sodiu apare ca o masă topită albă sau aproape albă. Este disponibil în pelete mici, fulgi, bastoane și alte forme sau forme. Este greu și fragil și prezintă o fractură cristalină. Sodiumhidroxidul este foarte delicvescent și la expunerea la aer rapidabsoarbe dioxidul de carbon și apa.
proprietăți fizice
cristale ortorombice albe, produse sub formă de pelete, bulgări, bețe, mărgele, așchii, fulgi sau soluții; higroscopic; foarte coroziv; absoarbe rapid CO2 și apa din aer; densitate 2,13 g/cm3; se topește la 323 CTC; se vaporizează la 1388 CTC; presiunea vaporilor 1 torr la 739 CTC și 5 torr la 843 CTC; foarte solubil în apă (110 g/100ml la temperatura camerei), generând căldură la dizolvare; soluții apoase foarte alcaline, pH de soluție 0,5% aproximativ 13 și soluție 0,05% aproximativ 12; solubil în metanol, etanol și glicerol (23,8 g/100 ml metanol și 13.9 g/100 mL etanol la temperaturi ambiante.).
utilizări
soda caustică este una dintre cele mai utilizate pe scară largăproduse chimice. Este folosit pentru a neutraliza acizi; tomake săruri de sodiu; pentru a precipita metale cahidroxizi lor; în rafinarea petrolului; în saponificarea Esteri; în tratamentul deceluloză, materiale plastice, și cauciuc; și în numeroase aplicații sintetice și analitice.
utilizări
hidroxidul de sodiu este vândut comercial sub formă de fulgi sau pelete anhidre sau sub formă de soluții apoase 50% sau 73%. Are nenumărate utilizări industriale și este una dintre primele 10 substanțe chimice în ceea ce privește producția și utilizarea la scară globală. Aproximativ 15 milioane de tone de hidroxid de sodiu sunt utilizate anual. Utilizarea sa cea mai mare, consumând aproximativ jumătate din producția sa, este ca bază în producerea altor substanțe chimice. Este utilizat pentru a controla pH-ul și a neutraliza acizii în procesele chimice. Industria hârtiei folosește pe scară largă hidroxidul de sodiu în procesul de pulping. Hidroxidul de sodiu este utilizat pentru separarea fibrelor prin dizolvarea ligninei de legătură. Este utilizat în mod similar în producția de raion din celuloză. Hidroxidul de sodiu este o substanță chimică cheie în săpun industry.In procesul de saponificare, trigliceridele obținute de la animale și plante sunt încălzite în soluție abazică pentru a da glicerol și săpun:
hidroxidul de sodiu este utilizat în industria textilă pentru albirea și tratarea textilelor pentru a le face colorantul mai ușor. Industria petrolieră folosește hidroxid de sodiu în nămolurile de foraj și bactericid asa. Hipocloritul de sodiu (NaOCl) este utilizat pe scară largă pentru curățare și ca dezinfectant.Înălbitorul obișnuit de uz casnic constă din aproximativ 5% soluție de hipoclorit de sodiu. Sodiuhipocloritul se prepară prin reacția clorului cu hidroxidul de sodiu: Cl2(g) + 2NaOH(aq) NaOCl(aq) + NaCl(aq) + H2O(l). Hidroxidul de sodiu este utilizat în industria alimentară pentru curățareși peeling fructe și legume. Hidroxidul de sodiu este un ingredient minor în multe comuneproduse de uz casnic, dar în câteva poate constitui mai mult de jumătate din produs. Dranocristalele conțin între 30% și 60% hidroxid de sodiu, iar unele substanțe de curățare a scurgerilor pot consta în hidroxid de sodiu 100%.
utilizări
hidroxidul de sodiu este un alcalin care este solubil în apă, având o solubilitate de 1 g în 1 ml de apă. este folosit pentru a distruge substanțele chimice amare din măsline care urmează să devină măsline negre. de asemenea, funcționează pentru a neutraliza acizii din diferite produse alimentare.
utilizări
hidroxidul de sodiu este utilizat pentru a ajusta pH-ul unui produs pentru a-l face mai acceptabil pentru piele. Este denumit în mod obișnuit sodă caustică și servește adesea ca reactiv chimic la fabricarea săpunului. Dacă este prea concentrat, poate provoca iritații severe ale pielii.
utilizări
hidroxidul de sodiu este una dintre cele mai importante substanțe chimice industriale. În volum, se află în primele zece substanțe chimice produse în Statele Unite. Este utilizat în fabricarea unui număr mare de compuși, inclusiv mai multe săruri de sodiu, în tratarea celulozei pentru producerea raionului și a celofanului și în fabricarea săpunurilor, detergenților, pulpei și hârtiei. Hidroxidul de sodiu este un agent de neutralizare comun pentru acizii din titrările acido-bazice și rafinarea petrolului. O altă aplicație majoră este extragerea metalelor din minereurile lor, unde fuziunea alcalină, cum ar fi fuziunea cu sodă caustică, este adesea aplicată pentru a deschide minereurile. În plus, hidroxidul de sodiu este utilizat pentru precipitarea metalelor ca hidroxizi. Alte utilizări sunt în recuperarea cauciucului, dizolvarea cazeinei în producția de materiale plastice, rafinarea uleiurilor vegetale, prelucrarea textilelor, ca eluant în cromatografia Ionică, gravare și galvanizare și ca reactiv de laborator. Hidroxidul de sodiu este, de asemenea, utilizat ca bază puternică în multe sinteze organice și reacții catalizate de bază.
utilizări
soluțiile NaOH sunt utilizate pentru a neutraliza acizii și a face săruri de sodiu, de exemplu, în rafinarea petrolului pentru a îndepărta acizii sulfurici și organici; pentru a trata celuloza în fabricarea raionului de viscoză și celofan; în recuperarea cauciucului pentru a dizolva țesătura; în fabricarea materialelor plastice pentru a dizolva cazeina. Soluțiile de NaOH hidrolizează grăsimile și formează săpunuri; precipită alcaloizi (baze) și majoritatea metalelor (ca hidroxizi) din soluțiile de apă ale sărurilor lor. Ajutor farmaceutic (alcalizator).
preparat
hidroxidul de sodiu este fabricat împreună cu clorul prin electroliza soluției de clorură de sodiu. Diferite tipuri de celule electrolitice sunt utilizate comercial. Acestea includ celula de mercur, celula diafragmei și celula membranei.
O soluție saturată de saramură este electrolizată. Gazul de clor este eliberat la anod și ionul de sodiu la catod. Descompunerea apei produce ioni de hidrogen și hidroxid. Ionul hidroxid se combină cu ionul de sodiu formând NaOH. Reacțiile electrolitice globale pot fi reprezentate ca:
2NA + + 2CL – + 2H2O cl2 (g) + h2 (g) + 2NaOH (aq)
celula de mercur se desfășoară în două etape care apar separat în două celule. Primul este cunoscut sub numele de celulă de saramură sau electrolizor primar în care ionul de sodiu se depune pe catodul de mercur formând amalgam, în timp ce gazul de clor este eliberat la anod:
Na+ + Cl– Na-Hg (catod) + noxcl2(g) (anod)
în a doua celulă, cunoscută sub numele de celulă de descompunere, se utilizează un catod de grafit, în timp ce amalgamul de sodiu servește ca anod. Apa reacționează cu metalul de sodiu al amalgamului în decompozator:
Na-Hg + H2O na+ + OH– + XH2 + HG
în celulele cu diafragmă clor-alcalină, o diafragmă este utilizată pentru a separa clorul eliberat la anod de hidroxidul de sodiu și hidrogenul generat la catod. Fără diafragmă, hidroxidul de sodiu format se va combina cu clorul pentru a forma hipoclorit de sodiu și clorat. În multe celule, diafragmele de azbest sunt utilizate pentru o astfel de separare. Sunt disponibile multe tipuri de celule cu diafragmă.hidroxidul de sodiu este produs fie ca solid anhidru, fie ca soluție apoasă 50%.
definiție
cea mai importantă comercialăcaustic.
metode de producție
hidroxidul de sodiu este fabricat prin electroliza saramurii folosind electrozi inert. Clorul este evoluat ca un gaz la anod șihidrogenul este evoluat ca un gaz la catod. Îndepărtarea clorurii și a ionilor de hidrogen lasă ionii de sodiu și hidroxid în soluție.Soluția este uscată pentru a produce hidroxidul de sodiu solid.o a doua metodă folosește celula Kellner–Solvay. Soluția de clorură de sodiu saturată este electrolizată între un anod de carbon și un catod de mercur care curge. În acest caz, sodiul este produs mai degrabă la catod decât la hidrogen din cauza disponibilității sodiului de a se dizolva în Mercur. Amalgamul sodiu-Mercur este apoi expus la apă și se produce o soluție de hidroxid de sodiu.
reacții
hidroxidul de sodiu este puternic alcalin și poate reacționa cu acizii pentru a forma săruri și apă.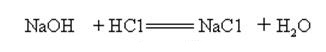
hidroxidul de sodiu reacționează cu oxizii acizi pentru a forma sare și apă, astfel încât hidroxidul de sodiu poate fi utilizat pentru a absorbi gazele acide în laborator sau industrial.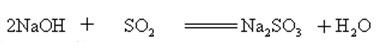
hidroxidul de sodiu poate reacționa cu soluții apoase de multe săruri metalice pentru a forma săruri de sodiu și hidroxizi metalici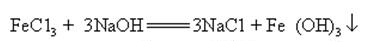
când hidroxidul de sodiu și sarea de amoniac sunt încălzite împreună, acesta poate elibera amoniac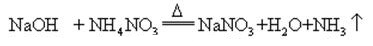
hidroxidul de sodiu este sticlele de sticlă care stochează soluții de hidroxid de sodiu trebuie să fie dopuri de cauciuc, iar dopurile de sticlă nu trebuie utilizate pentru a preveni deschiderea unei reacții chimice. Hidroxidul de sodiu este o materie primă industrială importantă și poate fi produs prin electroliza soluției saline industrial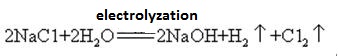
descriere generală
un solid alb. Coroziv pentru metale și țesuturi. Utilizat în fabricarea chimică, rafinarea petrolului, compuși de curățare, curățători de scurgere.
aer& reacții de apă
solubil în apă. Dizolvarea poate elibera suficientă căldură pentru a provoca aburirea și stropirea și pentru a aprinde materialul combustibil adiacent .
profilul de reactivitate
SODA caustică (hidroxid de sodiu) este o bază puternică. Reacționează rapid și exoterm cu acizi, atât organici, cât și anorganici. Absoarbe ușor umezeala din aer pentru a da semi-solide caustice care atacă aluminiul și ZINCUL cu evoluția hidrogenului gazos inflamabil. Catalizează polimerizarea acetaldehidei și a altor compuși polimerizabili; aceste reacții pot apărea violent, de exemplu, acroleina polimerizează cu violență extremă atunci când este pusă în contact cu materiale alcaline, cum ar fi hidroxidul de sodiu . Reacționează cu mare violență cu pentaoxidul de fosfor atunci când este inițiat de încălzirea locală . Contactul (ca agent de uscare) cu Tetrahidrofuranul, care conține adesea peroxizi, poate fi periculos—explozii au avut loc într-o astfel de utilizare a hidroxidului de potasiu similar chimic . Amestecarea cu oricare dintre următoarele substanțe într-un recipient închis a determinat creșterea temperaturii și presiunii: acid acetic glacial, anhidridă acetică, acroleină, clorohidrină, acid clorosulfonic, etilen cianohidrină, glioxal, acid clorhidric (36%), acid fluorhidric (48,7%), acid azotic (70%), oleum, propiolactonă, acid sulfuric (96%) . Contactul Accidental dintre o soluție de curățare caustică (probabil conținând hidroxid de sodiu) și Pentol a provocat o explozie violentă. . Încălzirea cu un amestec de alcool metilic și triclorbenzen în timpul unei încercări de sinteză a dus la o creștere bruscă a presiunii și la o explozie . NaOH fierbinte și / sau concentrat poate determina hidrochinona să se descompună exoterm la temperaturi ridicate. (Pub NFPA. 491m, 1975, 385)
pericol
coroziv pentru țesut în prezența umezelii, puternic iritant pentru țesut (ochi, piele, membrane mucoase și tractul respirator superior), otravă prin ingestie.
pericol pentru sănătate
acțiune corozivă puternică asupra țesuturilor contactate. Inhalare: praful poate provoca leziuni ale tractului respirator superior și ale plămânului în sine, producând de la iritarea ușoară a nasului până la pneumonită. Ingestie: leziuni severe ale membranelor mucoase; poate apărea formarea sau perforarea severă a cicatricilor. Contactul cu ochii: produce daune grave.
pericol pentru sănătate
hidroxidul de sodiu este o substanță foarte corozivăcare cauzează deteriorarea țesuturilor umane.Acțiunea sa asupra pielii este oarecum diferităde la arsuri acide. Nu există durere imediată, dar pătrunde în piele. Nu coaguleazăproteine pentru a preveni penetrarea ulterioară și, prin urmare, arderea caustică poate deveni severăși vindecarea lentă. Vărsarea concentratăsoluții în ochi poate duce la severeiritație sau leziuni permanente.
este toxic atât prin ingestie, cât și prin inhalarea prafului său. Deși s-a constatat că toxicitatea orală a unei soluții de sodă caustică de 5-10% este scăzută la animalele testate, dozele mari la concentrații mai mari pot provoca vărsături,prostrație și colaps. Doza letală orală la iepuri este de 500 mg / kg (NIOSH 1986).praf de hidroxid de sodiu sau aerosoli suntiritante la ochi, nas și gât. Prelungitexpunerea la concentrații mari în aerpoate produce ulcerații ale pasajului nazal.
pericol de incendiu
incombustibil, substanța în sine nu arde, dar se poate descompune la încălzire pentru a produce vapori corozivi și/sau toxici. Unele sunt oxidanți și pot aprinde combustibili (lemn, hârtie, ulei, îmbrăcăminte etc.). Contactul cu metalele poate evolua hidrogen gazos inflamabil. Containerele pot exploda atunci când sunt încălzite.
inflamabilitate și Explozibilitate
hidroxidul de sodiu și hidroxidul de potasiu nu sunt inflamabile ca substanțe solide sau soluții apoase.
aplicații farmaceutice
hidroxidul de sodiu este utilizat pe scară largă în formulările farmaceutice pentru a regla pH-ul soluțiilor. Poate fi folosit și pentru a reacționa cu cei slabiacizi pentru a forma săruri.
utilizări industriale
soda caustică (NaOH) este considerată cel mai puternic regulator al pH-ului alcalin. Soda causticăeste o substanță foarte activă și este foarte corozivă. Cea mai mare parte a sodei caustice este fabricatăprin electroliza saramurilor saturate (NaCl). Soda caustică are o capacitate de reglare foarte puternică (adică de la pH 7 la pH 14) la o doză relativ mică comparativ cualte substanțe alcaline. Din punct de vedere comercial, soda caustică este disponibilă sub formă anhidră,dar în majoritatea aplicațiilor miniere soda caustică este furnizată ca soluție de 50%.
în industria de prelucrare a mineralelor, hidroxidul de sodiu este utilizat în principal pentru controlul alcalinitățiiîn timpul procesării mineralelor nemetalice. În flotația metalelor de bază, utilizareahidroxidul de sodiu este rar.
profil de siguranță
otravă pe cale intraperitoneală. Moderat toxic prin ingestie. Datele de mutație raportate. Un iritant coroziv pentru piele, ochi și mucoase. Când este încălzit până la descompunere, emite vapori toxici de NanO.
siguranță
hidroxidul de sodiu este utilizat pe scară largă în industria farmaceutică și alimentară și este în general considerat un material netoxic la concentrații scăzute. La concentrații mari este un iritant corozivpielea, ochii și membranele mucoase.
LD50( șoarece, IP): 0,04 g/kg
LD50( iepure, oral): 0,5 g/kg
expunerea potențială
NaOH este utilizat pentru a neutraliza acizii și a face săruri de sodiu în rafinarea petrolului, viscoză; celofan, producția de plastic; și în recuperarea soluțiilor de săruri ale acestora. Se utilizează la fabricarea bumbacului mercerizat, a hârtiei, a explozivilor și a coloranților în curățarea metalelor; extracția electrolitică a zincului; placare cu staniu; acoperire cu oxid; spălare, albire, spălare vase; și este utilizat în industria chimică.
depozitare
la manipularea acestor substanțe trebuie purtate în permanență mănuși impermeabile și stropi, pentru a preveni contactul cu ochii și pielea. Operații cu hidroxizi metalicisoluțiile care au potențialul de a crea aerosoli trebuie efectuate într-o fumalitate pentru a preveni expunerea prin inhalare. NaOH și KOH generează căldură considerabilăcând se dizolvă în apă; când se amestecă cu apă, adăugați întotdeauna caustice încet în apă și amestecați continuu. Nu adăugați niciodată apă în cantități limitate la solidhidroxizi. Recipientele de hidroxizi trebuie depozitate într-o locație rece și uscată, separate de acizi și substanțe incompatibile.
depozitare
hidroxidul de sodiu trebuie depozitat într-un recipient nemetalic etanș într-un loc răcoros și uscat. Când este expus la aer, sodiulhidroxidul absoarbe rapid umezeala și lichefiază, dar ulterior devine din nou solid datorită absorbției dioxidului de carbon și a formării carbonatului de sodiu.
transport
Un1823 NaOH, solid, clasa de pericol: 8; etichete: 8-Material coroziv. UN1824 NaOH, soluție, clasa de pericol: 8; etichete: 8-Material coroziv
metode de purificare
impuritățile obișnuite sunt apa și carbonatul de sodiu. Hidroxidul de sodiu poate fi purificat prin dizolvarea a 100g în 1l de EtOH pur, filtrând soluția sub vid printr-un disc de sticlă sinterizată fină pentru a îndepărta carbonații și halogenurile insolubile. (Aceasta și operațiile ulterioare trebuie efectuate într-o cutie uscată, fără CO2.) Soluția este concentrată sub vid, utilizând o încălzire ușoară, pentru a obține o suspensie groasă de mono-alcoolat care este transferată pe un disc de sticlă sinterizată grosieră și evacuată fără lichior mamă. După spălarea cristalelor de mai multe ori cu alcool purificat pentru a îndepărta urmele de apă, acestea sunt uscate în vid, cu încălzire ușoară, timp de aproximativ 30 de ore pentru a descompune alcoolatul, lăsând o pulbere cristalină albă fină . CAUSTIC. Soluții de hidroxid de sodiu( caustice), 14.77. Ionul carbonat poate fi îndepărtat prin trecerea printr-o coloană de schimb de anioni (cum ar fi Amberlite IRA-400; Oh–form). Coloana trebuie preparată proaspăt din forma de clorură prin trecerea lentă prealabilă a soluției de hidroxid de sodiu până când efluentul nu dă nici un test pentru ionii de clorură. După utilizare, coloana poate fi regenerată prin spălare cu HCl diluat, apoi cu apă. În mod similar, alți ioni metalici sunt îndepărtați atunci când o soluție de NaOH de 1m (sau mai diluată) este trecută printr-o coloană de rășină a-1 Cu schimb de ioni Dowex în forma sa Na+ -. Alternativ, contaminarea cu carbonat poate fi redusă prin clătirea rapidă a bețelor de NaOH (calitatea reactivului analitic) cu H2O, apoi dizolvarea în H2O distilat sau prin prepararea unei soluții apoase concentrate de NaOH și extragerea lichidului supernatant limpede. (Na2CO3 insolubil este lăsat în urmă.) Contaminarea cu carbonat poate fi redusă prin adăugarea unui ușor exces de BaCl2 concentrat sau Ba (OH)2 la o soluție de NaOH, agitând bine și permițând sedimentarea precipitatului BaCO3. Dacă prezența Ba în soluție este inacceptabilă, se poate utiliza o purificare electrolitică. De exemplu, amalgamul de sodiu este preparat prin electroliza a 3l de 30% NaOH cu 500 ml de mercur pur pentru catod și un anod de platină, trecând 15 Faradays la 4 amperi, într-o sticlă de polietilenă cu pereți groși. Flaconul este apoi echipat cu tuburi de intrare și ieșire, soluția uzată fiind spălată cu N2 fără CO2. Amalgamul este apoi spălat bine cu un volum mare de apă deionizată (cu curentul de electroliză pornit pentru a minimiza pierderea de Na). În cele din urmă, o tijă de oțel curată este plasată în contact în soluție cu amalgamul (pentru a facilita evoluția hidrogenului), reacția fiind lăsată să se desfășoare până la atingerea unei concentrații adecvate, înainte de a fi transferată într-un vas de stocare și diluată după cum este necesar .
incompatibilități
o bază puternică și un oxidant puternic. Reacție violentă cu acid. Incompatibil cu apa; lichide inflamabile; halogeni organici, nitrometan și nitrocompuși, combustibili. Absoarbe rapid dioxidul de carbon și apa din aer. Contactul cu umezeala sau apa poate genera căldură. Coroziv pentru metale. Contactul cu zinc, aluminiu, staniu și plumb în prezența umidității, formând hidrogen gazos exploziv. Atacă unele forme de materiale plastice, cauciuc sau acoperiri.
incompatibilități
hidroxidul de sodiu este o bază puternică și este incompatibil cu orice compus care suferă cu ușurință hidroliză sau oxidare. Va reacționa cu acizi, esteri și eteri, în special în soluție apoasă.
eliminarea deșeurilor
deversarea în rezervorul care conține apă, neutralizarea, apoi spălarea la canalizare cu apă.
statutul de reglementare
GRAS enumerate. Acceptat pentru utilizare ca aditiv alimentar în Europa.Inclus în baza de date a ingredientelor inactive FDA (preparate dentarepreparate; injecții; inhalări; preparate nazale, oftalmice, orale, otice,rectale, topice și vaginale). Inclus în medicamente non-parenterale și parenterale autorizate în Marea Britanie. Inclus înlista canadiană a ingredientelor Non-medicamentoase acceptabile.
Leave a Reply