compuși covalenți
aveți acum o scurtă idee despre motivul pentru care diferite elemente se comportă diferit. Dar știi o mare parte din ea este din cauza „naturii” a legăturilor în compușii. La fel cum tu și cei mai buni prieteni ai tăi Aveți o serie de diferențe datorită calităților „interioare”, la fel este cazul compușilor ionici și covalenți. În acest capitol, vom afla mai multe despre conceptul de compuși covalenți, vom analiza proprietățile lor și multe altele.
Suggested Videos
What is a Covalent Compound?
Covalent compounds are the ones having strong intra-molecular bonds. Acest lucru se datorează faptului că atomii din moleculele covalente sunt foarte strâns ținuți împreună. Fiecare moleculă este într-adevăr destul de separată și forța de atracție dintre moleculele individuale dintr-un compus covalent tinde să fie slabă.
avem nevoie de foarte puțină energie în separarea moleculelor. Acest lucru se datorează forțelor de atracție dintre molecule cu absența sarcinii electrice globale. Compușii covalenți sunt de obicei molecule gazoase la temperatura și presiunea camerei. Acestea ar putea fi, de asemenea, lichide cu puncte de fierbere relativ scăzute.aceste caracteristici ar putea fi atribuite forțelor lor intermoleculare slabe care țin acești atomi împreună. Cu toate acestea, avem și o mulțime de compuși covalenți solizi. Au puncte de topire scăzute. Cu toate acestea, este interesant de observat că un număr mic dintre acestea au o structură complet diferită. Ele formează structuri uriașe în care un număr imens de atomi sunt ținute împreună. Acest lucru este posibil datorită prezenței electronilor împărțiți.
aceste structuri moleculare gigantice sunt în esență rețele formate din molecule care sunt ținute împreună de structura legăturilor covalente. Aceste legături covalente sunt foarte puternice. De asemenea, ele tind să fie foarte dure, cu puncte de topire ridicate, care sunt diferite de majoritatea compușilor covalenți. Exemplul acestui tip de compuși covalenți include diamant și grafit de rețea atom de carbon. Acestea includ, de asemenea, silice de rețea de atomi de siliciu și oxigen.
Descarca chimice lipirea Cheat Sheet PDF, făcând clic pe butonul de descărcare de mai jos


Răsfoiți mai multe subiecte în legătură chimică și structura moleculară
- parametrii legăturii
- fundamentele legăturii chimice
- hibridizare
- legarea hidrogenului
- compuși ionici sau electrovalenți
- teoria orbitală moleculară
- polaritatea legăturilor
- structuri de rezonanță
- legătură de valență Teoria
- teoria VSEPR
proprietățile generale ale compușilor covalenți
- compușii covalenți au de obicei puncte de topire scăzute. O excepție de la aceasta includ moleculele de silice și diamante care au un punct de topire ridicat.
- acești compuși au puncte de fierbere scăzute. Acest lucru poate fi atribuit forței lor slabe de atracție între diferiții atomi legați. Forțele Van Der Waals leagă acești atomi.
- acești compuși sunt de obicei gaze și lichide cu puncte de fierbere și topire scăzute.compușii covalenți solizi au structuri moi precum grafitul. Acest lucru se datorează prezenței unui nor de electroni între fiecare strat de atomi de carbon.
- acești compuși nu sunt conductori de sarcină electrică. Absența ionilor încărcați este principalul motiv din spatele acestui lucru. O excepție de la aceasta este grafitul, unde vedem un nor de electroni. Acestea fac din grafit un bun conductor.
- sunt și conductori de căldură răi. Moleculele lor nu au electroni liberi și asta împiedică fluxul de energie termică.
- compușii covalenți nu posedă caracteristici polare ca proprietate generală. Prin urmare, acești compuși sunt insolubili în apă. Moleculele de apă nu sunt absolut neutre și au o ușoară sarcină negativă asupra atomului de oxigen și ușoare sarcini pozitive asupra atomilor de hidrogen și deoarece compușii covalenți sunt alcătuiți din molecule neutre sau molecule cu sarcini ușoare și, prin urmare, nu sunt atrași puternic de moleculele de apă.
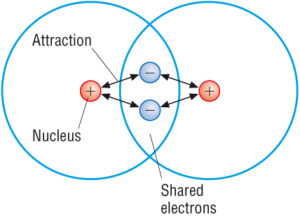
(sursă: Google)
proprietăți fizice și chimice
- compușii covalenți lichizi se evaporă. Aceasta înseamnă că moleculele de lichide și solide pierd de pe suprafața lor în aer.
- acești compuși au o afinitate foarte mică între moleculele lor.
- diferiți compuși covalenți au propriile molecule în formă caracteristică. Legăturile lor sunt îndreptate spre unghiuri prestabilite.
- unii compuși, în special medicamentele, sunt solubili în apă. Restul sunt solubile în ulei.majoritatea compușilor covalenți sunt nepolari sau au o tendință foarte mică de a se diviza complet pentru a forma ioni și, prin urmare, nu conduc niciodată electricitatea.
- la temperatură și presiune normală, vom găsi acești compuși fie ca lichide, fie ca gaze. Dar, există și solide și au greutăți moleculare mai mari.cristalele compușilor covalenți sunt de două tipuri: unul care are o forță van der Waal slabă care le ține împreună ca în iod. Acestea sunt ușor fuzibile și volatile, celălalt având o rețea mare de atomi care instalează macromoleculele.
- acești compuși sunt solubili în solvenți organici, cum ar fi eter și benzen.
- legăturile covalente sunt de natură direcțională. Prin urmare, ele prezintă fenomenul izomerismului.
- compușii covalenți au în mare parte o rată foarte lentă de reacții, spre deosebire de diferiții compuși ionici.
exemple rezolvate pentru dvs.
întrebare: de ce compușii covalenți nu sunt solubili în apă?
răspuns: moleculele de apă nu sunt absolut neutre. Aceste molecule au o ușoară sarcină negativă asupra atomului de oxigen și ușoare sarcini pozitive asupra atomilor de hidrogen. Pe de altă parte, știm că compușii covalenți sunt alcătuiți din molecule neutre sau molecule cu sarcini ușoare. Din acest motiv, acești compuși nu sunt atrași puternic de moleculele de apă.
Leave a Reply