Chimie: ce sunt acizii și bazele?
ce sunt acizii și bazele?
deși v-am spus că acizii și bazele nu sunt greu de înțeles, am vești proaste: nu există una, ci trei definiții comune folosite pentru a descrie acizii și bazele: acizii și bazele Arrhenius, acizii și bazele Brnsted-Lowry și acizii și bazele Lewis. Deși acest lucru face să sune ca și cum va trebui să înveți despre acizi și baze de trei ori, vestea bună este că, în multe scopuri practice, aceste trei definiții sunt aproximativ echivalente.
acizi și baze Arrhenius
înapoi la sfârșitul anilor 1800, vechiul nostru prieten Svante Arrhenius a venit cu definiții ale acizilor și bazelor în timp ce lucra la probleme cinetice.
potrivit lui Arrhenius, acizii sunt compuși care se descompun în apă pentru a emite ioni de hidroniu (H+). Un exemplu comun de acid Arrhenius este acidul clorhidric (HCl):
- HCl ? H + + Cl-
formulele pentru acizi încep de obicei cu hidrogen, deși acizii organici sunt o excepție notabilă. Numele și formulele unor acizi comuni sunt prezentate în tabelul de mai jos:
| nume Acid | Formula |
|---|---|
| acid clorhidric | HCl |
| acid azotic | HNO3 |
| acid fosforic | H3PO4 | acid sulfuric | H2SO4 | acid acetic | c2h4o2 |
bazele Arrhenius sunt definite ca compuși care determină formarea ionului de hidroxid atunci când sunt plasați în apă. Un exemplu de bază Arrhenius este hidroxidul de sodiu (NaOH):
- NaOH ? Na + + OH-
bazele au de obicei „OH” în formulele lor, deși există excepții. De exemplu, amoniacul (NH3) nu conține ioni de hidroxid, ci îi formează atunci când reacționează cu apa:
- NH3 + H2O ? NH4 + + OH –
numele și formulele unor baze comune sunt în tabelul următor:
| denumirea bazei | Formula | amoniac | NH3 | hidroxid de potasiu | KOH |
|---|---|
| bicarbonat de sodiu | NaHCO3 |
| carbonat de sodiu | Na2CO3 | hidroxid de sodiu | NaOH |
unii oxizi formează acizi sau baze atunci când se adaugă apă. Deoarece acești compuși nu conțin ioni H + sau OH – decât dacă reacționează cu apa, se numesc „anhidride”.”De obicei, oxizii nemetalelor sunt anhidride acide (formează acid atunci când sunt plasate în apă), iar oxizii metalelor sunt anhidride de bază (formând o bază atunci când sunt plasate în apă).
Brnsted-Lowry acizi și baze
la începutul anilor 1900, o definiție alternativă pentru acizi și baze a fost propusă de Johannes Brnsted și Thomas Lowry pentru a explica faptul că amoniacul poate neutraliza aciditatea HCl chiar dacă apa nu este prezentă. Acest fenomen le-a arătat că amoniacul este o bază, chiar și atunci când nu există apă în jur pentru a forma ioni de hidroxid.
există multe nume și formule diferite folosite pentru a descrie ionul hidroniu. Deși formula A fost prezentată anterior ca ” H+”, uneori este scrisă ca” H3O”, deoarece acesta este ionul format atunci când H+ se combină cu apa. Un alt mod obișnuit de a se referi la ionii de hidroniu este doar să-i numim „protoni.”Acest nume provine din faptul că H+ reprezintă un atom de hidrogen (un proton și un electron) care și-a pierdut electronul, lăsând în urmă doar protonul gol.
un acid Brnsted-Lowry este definit ca un compus care dă ioni de hidroniu unui alt compus?de exemplu, acidul clorhidric dă ioni H+ compușilor cu care reacționează. Bazele Brnsted-Lowry sunt compuși care pot accepta ioni de hidroniu?când amoniacul primește un ion hidroniu din HCl, acesta formează ionul de amoniu.
următoarea ecuație reprezintă reacția unui acid Brnsted-Lowry cu o bază Brnsted-Lowry:
- HNO3 + NH3 ? NO3 – + NH4 +
în această reacție, acidul azotic se comportă ca un acid deoarece dă un proton amoniacului. Amoniacul se comportă ca bază deoarece acceptă protonul din acidul azotic.
cu toate acestea, dacă aruncați o privire la cealaltă parte a ecuației, găsim ionii de nitrat și amoniu. Deoarece ionul nitrat poate accepta protoni din ionul de amoniu (pentru a forma HNO3), ionul nitrat este o bază Brnsted-Lowry foarte slabă. Deoarece ionul de amoniu are un proton suplimentar de donat (în acest caz ionului nitrat), este un acid Brnsted-Lowry.
ionul nitrat se bazează pe molecula de acid azotic, deci spunem că este baza conjugată a acidului azotic. La fel, ionul de amoniu este acidul conjugat al amoniacului. Împreună, un acid cu baza sa conjugată (cum ar fi HNO3 și NO3-) sau o bază cu acidul său conjugat (cum ar fi NH3 și NH4+) este denumit pereche acid-bază conjugată.
acizi și baze Lewis
în definiția Brnsted-Lowry a acizilor și bazelor, o bază este definită ca un compus care poate accepta un proton. Cu toate acestea, cum acceptă protonul?
o caracteristică pe care bazele Brnsted-Lowry o au în comun între ele este că au o pereche de electroni nepartajați. Când un ion de hidroniu vine rătăcind de moleculă, uneori perechile singure se vor întinde și îl vor apuca. Un exemplu în acest sens este atunci când amoniacul acceptă un proton într-o soluție acidă:
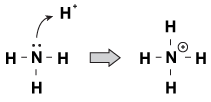
figura 23.1 amoniacul poate prinde un proton din acidul azotic cu perechea sa unică de electroni.
o modalitate de a privi acest proces este că atomul de amoniac își donează perechea singură protonului. Deoarece perechile singure conduc această reacție chimică, avem o nouă definiție a acidității și bazicității, numită „Lewis acidity/basicity.”O bază Lewis este un compus care donează o pereche de electroni unui alt compus (amoniacul din exemplul nostru). Un acid Lewis este un compus care acceptă o pereche de electroni (ionul H+ în exemplul nostru).
bazele Lewis sunt substanțe chimice care pot dona perechi de electroni. Acizii Lewis sunt substanțe chimice care le pot accepta.
deși am avut amoniac donând o pereche singură unui proton în exemplul nostru, perechea singură din amoniac poate reacționa și cu o mulțime de alți compuși. De exemplu, amoniacul își poate dona perechea singură de electroni către BH3 prin următorul proces:

figura 23.2 perechea singură pe amoniac atașându-se de BH3.
în acest proces, amoniacul este baza Lewis și BH3 este acidul Lewis.
în general, definiția Lewis a acizilor și bazelor este cea mai utilă, deoarece este cea mai incluzivă dintre cele trei definiții. De exemplu, definiția Brnsted-Lowry a unui acid include HF, dar nu BH3, care nu pierde un proton atunci când este atașat de perechile singure pe o bază Lewis.
extras din Ghidul Idiotului complet pentru Chimie 2003 de Ian Guch. Toate drepturile rezervate, inclusiv dreptul de reproducere, integral sau parțial, sub orice formă. Folosit de aranjament cu Alpha Books, un membru al Penguin Group (SUA) Inc.
pentru a comanda această carte direct de la editor, vizitați site-ul Penguin USA sau sunați la 1-800-253-6476. De asemenea, puteți achiziționa această carte la Amazon.com și Barnes& nobil.
Leave a Reply