Carbon: elementele esențiale
carbonul este un element din grupa 14 și este distribuit foarte larg în natură. Se găsește din abundență în soare, stele, comete și atmosfere ale majorității planetelor. Carbonul este prezent ca dioxid de carbon în atmosferă și dizolvat în toate apele naturale. Este o componentă a rocilor ca carbonați de calciu (calcar), magneziu și fier. Atmosfera lui Marte este foarte subțire, dar ceea ce există conține aproximativ 95% CO2.
cărbunele, petrolul și gazele naturale sunt în principal hidrocarburi. Carbonul este unic printre elementele din numărul mare de compuși pe care îi poate forma. Chimia organică, un subset 1/112 al chimiei anorganice, este studiul carbonului și al compușilor săi. În timp ce siliciul ar putea lua locul carbonului în formarea unei serii de compuși înrudiți, în prezent nu este posibil să se formeze compuși stabili cu lanțuri foarte lungi de atomi de siliciu.carbonul se găsește liber în natură în trei forme alotrope: amorf, grafit și diamant. Grafitul este unul dintre cele mai moi materiale cunoscute, în timp ce diamantul este unul dintre cele mai grele. Carbonul, ca diamante microscopice, se găsește în unii meteoriți. Diamantele naturale se găsesc în „țevi” vulcanice antice, cum ar fi cele găsite în Africa de Sud. Diamantele sunt, de asemenea, recuperate de pe fundul oceanului de pe Capul Bunei Speranțe.

un inel cu diamant.mai recent ,a fost descoperită o altă formă de carbon, buckminsterfullerene, C60. Această formă de carbon este subiectul unui mare interes în laboratoarele de cercetare de astăzi.
carbonul pur este disponibil în mai multe forme diferite (alotropi). Cea mai comună formă de carbon pur este grafitul-grafit. Aceasta este și forma cea mai stabilă din punct de vedere termodinamic. Diamantul este o a doua formă de carbon, dar este mult mai puțin obișnuit. Alte forme de carbon includ fullerenele. În timp ce diamantul și grafitul sunt laturi infinite, fullerenele precum buckminsterfullerene, C60, este o specie moleculară discretă. Formele amorfe de carbon, cum ar fi funinginea și abajurul, sunt materiale constând din particule foarte mici de grafit.
cea mai mare parte a grafitului este de grafit cu un strat de grafit și are o structură în care fiecare carbon este legat direct de alți trei atomi de carbon la o distanță de 141,5 pm. Delocalizarea în legătură este evidentă, deoarece distanțele C-C sunt egale și mai scurte decât legăturile simple carbon-carbon normale (tip 154 pm). Distanța dintre straturile atomilor de carbon este de 335,4 pm. În majoritatea grafitului (grafit-grafit), straturile de atomi sunt aranjate într-un ABABAB… repetați moda, dar forma de formă (romboedrică) stivuirea este ABCABCABC… deși distanțele carbon-carbon și spațierea între straturi rămân aceleași ca în forma de la XV. Entalpia diferența între α și α-grafit este mai mică decât 1 kJ mol-1 (0.59 ± 0.17 kJ mol-1. Formele elementelor mai grele corespunzătoare grafitului nu sunt cunoscute, iar structurile siliciului, germaniului și staniului gri sunt legate de structura diamantului (de mai jos).

aranjamentele Atomice în cele mai comune alotropi de carbon: grafit-grafit.
deoarece diamantul are o structură puțin mai compactă, densitatea sa este mai mare decât cea a grafitului. Aspectul de diamant este bine cunoscut și este, de asemenea, unul dintre cele mai grele materiale cunoscute. La fel ca grafitul, este relativ nereactiv, dar arde în aer la 600-800 C. Fiecare atom de carbon este legat de patru vecini la o distanță de 154.45 pm într-un mod tetraedric și astfel fiecare cristal de diamant este o singură structură gigantică de zăbrele. În principiu (și în practică!) grafitul poate fi transformat în diamant prin aplicarea căldurii și a presiunii. Celula unitară a diamantului este cubică cu a = 356,68 pm. Aproape toate diamantele posedă această structură, dar un procent foarte mic arată o structură hexagonală legată de wurtzite și acestea se numesc lonsdaleite.

strucutres de cristal de diamant.
recent a fost caracterizat un alt alotrop de carbon. În timp ce diamantul și grafitul sunt laturi infinite, buckminsterfullerene, C60, este o specie moleculară discretă. Molecula buckminsterfullerene este o plasă de 12 pentagoane și 20 hexagoane pliate într-o sferă. Efectul este foarte asemănător cu mozaicul de 12 piese pentagonale și 20 hexagonale de piele care cusute împreună alcătuiesc un fotbal de asociere (minge de fotbal). Numele buckminsterfullerene (sau buckyball a fost inventat din cauza relației dintre structura C60 și R. Buckminsterfuller geodezic dome modele. Buckminsterfullerene este acum disponibil comercial și a fost identificat și în spațiul interstelar și funingine.
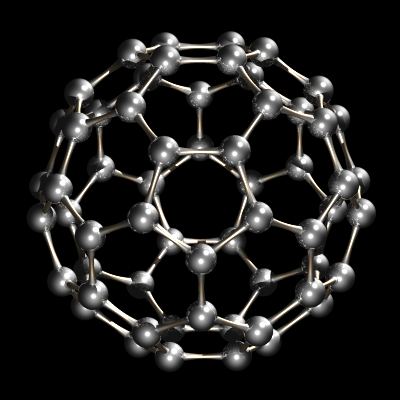
C60, Buckminsterfullerene.
alte fullerene (cuști de carbon închise), cum ar fi C60 și C84 sunt cunoscute, de asemenea, și inded disponibile comercial. Cel mai mic fulleren posibil este dodecaedric C20, format din 12 pentagoane și deloc hexagoane. Nanotuburile sunt legate de fullerene. Sunt tuburi care dau aspectul grafitului laminat, deși sunt fabricate din grafit. Ele sunt deschise, în timp ce fullerenele sunt structuri închise.
o caracteristică interesantă a fullerenelor este capacitatea lor de a închide atomi precum potasiul și alte metale alcaline pentru a face structuri endoedrice denumite K@C60.în 1961, Uniunea Internațională de Chimie Pură și aplicată (IUPAC) a adoptat izotopul 12C ca bază pentru greutățile atomice. Carbon-14, 14C, un izotop cu un timp de înjumătățire de 5730 de ani, este folosit până în prezent materiale precum lemn, specimene arheologice etc. Carbon-13, 13C, este deosebit de util pentru studiile de etichetare izotopică, deoarece nu este radioactiv, ci este un nucleu de spin I = 1/2 și, prin urmare, un nucleu RMN bun.
Leave a Reply