biologie pentru Majors I
rezultatele învățării
- identificați componentele reacțiilor chimice simple
toate elementele sunt cele mai stabile atunci când învelișul lor exterior este umplut cu electroni conform regulii octetului. Acest lucru se datorează faptului că este favorabil din punct de vedere energetic ca atomii să fie în acea configurație și îi face stabili. Cu toate acestea, deoarece nu toate elementele au suficienți electroni pentru a-și umple învelișurile exterioare, atomii formează legături chimice cu alți atomi obținând astfel electronii de care au nevoie pentru a atinge o configurație electronică stabilă. Când doi sau mai mulți atomi se leagă chimic unul cu celălalt, structura chimică rezultată este o moleculă. Molecula de apă familiară, H2O, constă din doi atomi de hidrogen și un atom de oxigen; acestea se leagă împreună pentru a forma apă, așa cum este ilustrat în Figura 1. Atomii pot forma molecule prin donarea, acceptarea sau partajarea electronilor pentru a-și umple învelișurile exterioare.
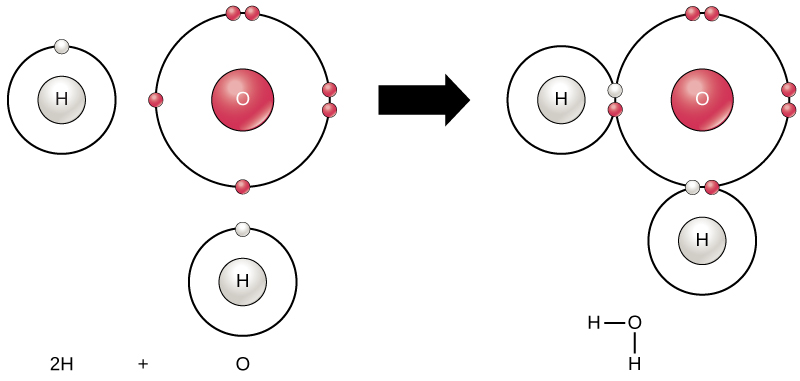
Figura 1. Doi sau mai mulți atomi se pot lega între ei pentru a forma o moleculă. Când doi hidrogeni și un oxigen împart electroni prin legături covalente, se formează o moleculă de apă.
reacțiile chimice apar atunci când doi sau mai mulți atomi se leagă împreună pentru a forma molecule sau când atomii legați sunt despărțiți. Substanțele utilizate la începutul unei reacții chimice se numesc reactanți (de obicei găsiți în partea stângă a unei ecuații chimice), iar substanțele găsite la sfârșitul reacției sunt cunoscute sub numele de produse (de obicei găsite în partea dreaptă a unei ecuații chimice). O săgeată este de obicei trasată între reactanți și produse pentru a indica direcția reacției chimice; această direcție nu este întotdeauna o „stradă cu sens unic.”Pentru crearea moleculei de apă prezentată mai sus, ecuația chimică ar fi:
2h + o H2O
un exemplu de reacție chimică simplă este descompunerea moleculelor de peroxid de hidrogen, fiecare dintre acestea constând din doi atomi de hidrogen legați de doi atomi de oxigen (H2O2). Peroxidul de hidrogen reactant este descompus în apă, conținând un atom de oxigen legat de doi atomi de hidrogen (H2O) și oxigen, care constă din doi atomi de oxigen legați (O2). În ecuația de mai jos, reacția include două molecule de peroxid de hidrogen și două molecule de apă. Acesta este un exemplu de ecuație chimică echilibrată, în care numărul de atomi ai fiecărui element este același pe fiecare parte a ecuației. Conform legii conservării materiei, numărul de atomi înainte și după o reacție chimică ar trebui să fie egal, astfel încât niciun atom să nu fie, în condiții normale, creat sau distrus.
2H2O2 (peroxid de hidrogen) 2H2O(apă) + O2 (oxigen)
chiar dacă toți reactanții și produsele acestei reacții sunt molecule (fiecare atom rămâne legat de cel puțin un alt atom), în această reacție numai peroxidul de hidrogen și apa sunt reprezentative pentru o subclasă de molecule cunoscute sub numele de compuși: conțin atomi de mai mult de un tip de element. Oxigenul Molecular, pe de altă parte, așa cum se arată în Figura 2, constă din doi atomi de oxigen legați dublu și nu este clasificat ca compus, ci ca element.
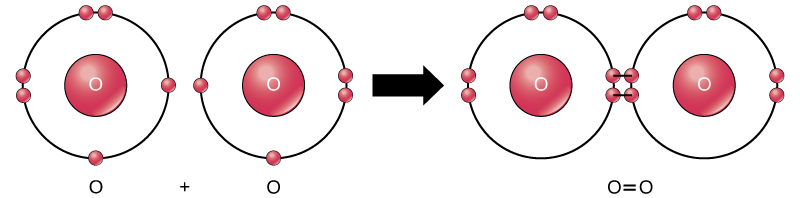
Figura 2. Atomii de oxigen dintr-o moleculă de O2 sunt uniți printr-o dublă legătură.
unele reacții chimice, cum ar fi cea prezentată mai sus, pot continua într-o direcție până când reactanții sunt epuizați. Ecuațiile care descriu aceste reacții conțin o săgeată unidirecțională și sunt ireversibile. Reacțiile reversibile sunt cele care pot merge în ambele direcții. În reacțiile reversibile, reactanții sunt transformați în produse, dar atunci când concentrația produsului depășește un anumit prag (caracteristic reacției particulare), unele dintre aceste produse vor fi transformate înapoi în reactanți; în acest moment, denumirile produselor și reactanților sunt inversate. Acest lucru înainte și înapoi continuă până când apare un anumit echilibru relativ între reactanți și produse—o stare numită echilibru. Aceste situații de reacții reversibile sunt adesea notate printr-o ecuație chimică cu o săgeată cu două capete îndreptată atât către reactanți, cât și către produse.
de exemplu, în sângele uman, excesul de ioni de hidrogen (H+) se leagă de ionii de bicarbonat (HCO3–) formând o stare de echilibru cu acidul carbonic (H2CO3). Dacă s-ar adăuga acid carbonic la acest sistem, o parte din acesta ar fi transformată în ioni de bicarbonat și hidrogen.
HCO3– + H+ H2CO3
în reacțiile biologice, cu toate acestea, echilibrul este rar obținut deoarece concentrațiile reactanților sau produselor sau ambelor sunt în continuă schimbare, adesea cu un produs al unei reacții fiind un reactant pentru altul. Pentru a reveni la exemplul excesului de ioni de hidrogen din sânge, formarea acidului carbonic va fi direcția majoră a reacției. Cu toate acestea, acidul carbonic poate părăsi corpul ca gaz de dioxid de carbon (prin expirație) în loc să fie transformat înapoi în Ion bicarbonat, conducând astfel reacția la dreapta prin Legea chimică cunoscută sub numele de legea acțiunii în masă. Aceste reacții sunt importante pentru menținerea homeostaziei sângelui nostru.
HCO3 – + h + H2CO3 CO2 + H2O
în rezumat: Reacții chimice și molecule
învelișul exterior de electroni dictează cât de ușor și ce tip de legături chimice se va forma un anumit atom. Formarea compușilor este adesea conturată vizual în ecuații chimice care arată reactanții care participă la reacții chimice pentru a forma produse.
încercați să-l
contribuie!
îmbunătățiți această paginăaflați mai multe
Leave a Reply