1.14: distincția între pH și pKa
aciditate relativă și valorile pKa
o aplicație a ecuației Henderson-Hasselbach este capacitatea de a determina aciditatea relativă a compușilor prin compararea valorilor lor pKa. Cu cât un acid este mai puternic, cu atât este mai mare ionizarea, cu atât este mai mic pKa și cu atât este mai mic pH-ul pe care compusul îl va produce în soluție. Unele valori PKA selectate pentru compușii din studiul chimiei organice sunt prezentate mai jos. Deoarece reacțiile organice pot fi efectuate în medii neapoase, pH-ul poate depăși 14, iar compușii organici pot avea valori pKa peste 16. Este o variantă pe această linie din Vrăjitorul din Oz, ” nu mai trăim în apă.”





este o idee foarte bună să se angajeze în memorie intervalele PKA aproximative ale compușilor de mai sus. Un cuvânt de precauție: când utilizați tabelul pKa, asigurați-vă absolut că aveți în vedere perechea corectă de acid conjugat/bază. Dacă vi se cere să spuneți ceva despre bazicitatea amoniacului (NH3) în comparație cu cea a ionului etoxid (CH3CH2O-), de exemplu, valorile PKA relevante de luat în considerare sunt 9,2 (PKA al ionului de amoniu) și 16 (PKA al etanolului). Din aceste numere, știți că etoxidul este baza mai puternică. Nu faceți greșeala de a utiliza valoarea pKa de 38: Acesta este PKA de amoniac care acționează ca un acid și vă spune cât de bazic este ionul NH2 (foarte bazic!)
* o notă privind pKa de apă: PKa de apă este 14. Textele de biochimie și chimie organică enumeră adesea valoarea ca 15.7. Aceste texte au luat în calcul incorect valoarea molară pentru concentrația apei în constanta de echilibru. Derivarea corectă a constantei de echilibru implică activitatea apei, care are o valoare de 1.
exemplu
în timp ce acest curs începe cu grupuri funcționale unice, vom lucra în cele din urmă cu compuși interesanți care conțin mai multe grupuri funcționale. Recunoașterea hidrogenilor care pot fi ionizați ca protoni acizi și care hidrogeni nu pot, este o abilitate utilă. Observați în acest exemplu că trebuie să evaluăm aciditatea potențială în patru locații diferite ale moleculei.
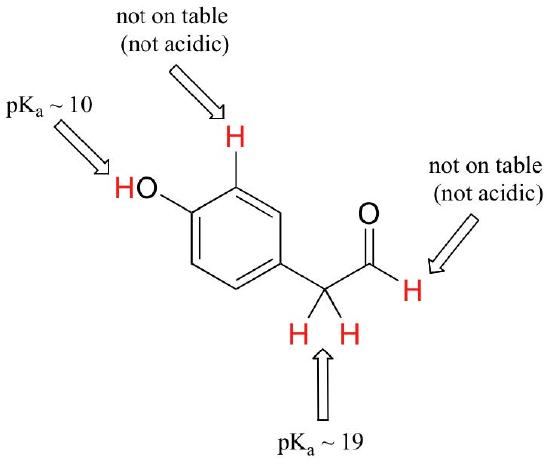
aldehida și protonii aromatici nu sunt deloc acizi (pkavalorile sunt peste 40 – nu pe masa noastră). Cei doi protoni de pe carbonul de lângă carbonil sunt ușor acizi, cu valori pKa în jur de 19-20 conform tabelului. Cel mai acid proton se află pe grupul fenol, deci dacă compusul ar fi supus unui singur echivalent molar de bază puternică, acesta este protonul care ar fi donat.
acid& medii de bază – totul este relativ în reactivitate
deoarece scopul nostru este înțelegerea reactivității chimice dinamice, nu trebuie să cunoaștem cantitatea specifică a formelor protonate și neprotonate ale unui compus. Pur și simplu trebuie să știm ce formă predomină. Când pH-ul mediului este mai mic decât pKa al compusului, mediul este considerat acid și compusul va exista predominant în forma sa protonată. Când pH-ul mediului este mai mare decât pKa al compusului, mediul este considerat bazic și compusul va exista predominant în forma sa deprotonată.
de exemplu, pKa de acid acetic este de aproximativ 5. La un pH de 1, mediul este considerat acid și acidul acetic există predominant în forma sa protonată. La pH 8, mediul este considerat bazic, iar acidul acetic devine deprotonat pentru a forma acetat (CH3CO2-). În schimb, PKA de fenol este 10. La pH 8, mediul este considerat acid pentru fenol și rămâne în primul rând protonat.
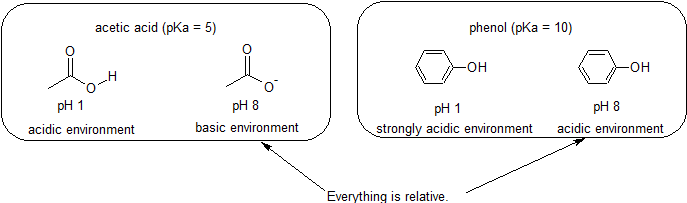
de asemenea, este important să ne amintim că chimia organică nu trebuie să apară în apă, astfel încât valorile pKa pot fi la fel de mari ca 50.
exercițiu
1. Complete the table below to indicate whether each compound exists predominantly in its protonated (acidic environment) or deprotonated (basic environment) form.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
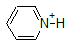 |
 |
 |
 |
 |
 |
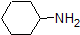 |
 |
 |
 |
 |
 |
 |
 |
 |
Leave a Reply