NOAA Global Monitoring Laboratory – Halocarbons and other Atmospheric Trace Species
Chlorofluorocarbons (CFCs)
(published in The Chapman & Hall Encyclopedia of Environmental Science, edited by David E. Alexander and Rhodes W. Fairbridge, pp pp.78-80, Kluwer Academic, Boston, MA, 1999.)
Chlorofluorocarbons (CFCs) are nontoxic, nonflammable chemicals containing atoms of carbon, chlorine, and fluorine. São utilizados no fabrico de aerossóis, sopradores para Espumas e materiais de embalagem, como solventes e como refrigerantes. Os CFC são classificados como halocarbonetos, uma classe de compostos que contêm átomos de carbono e de halogéneos. Moléculas CFC individuais são rotuladas com um sistema de numeração único. Por exemplo, o número CFC de 11 indica o número de átomos de carbono, hidrogénio, flúor e cloro (por exemplo, CCl3F como CFC-11). A melhor maneira de lembrar o sistema é a “regra dos 90” ou adicionar 90 para o CFC número onde o primeiro dígito é o número de átomos de carbono (C), o segundo dígito é o número de átomos de hidrogênio (H), e o terceiro dígito é o número de átomos de flúor (F). O número total de átomos de cloro (Cl) é calculado pela expressão: Cl = 2(C+1) – H – F. No exemplo CFC-11 tem um carbono, sem hidrogênio, um flúor e, portanto, 3 átomos de cloro.
refrigeradores no final de 1800 e início de 1900 usaram os gases tóxicos, amônia (NH3), cloreto de metilo (CH3Cl), e dióxido de enxofre (SO2), como refrigerantes. Depois de uma série de acidentes fatais na década de 1920, quando cloreto de metila vazou de refrigeradores, uma busca por uma substituição menos tóxica começou como um esforço colaborativo de três corporações americanas – Frigidaire, General Motors, e Du Pont. CFC foram sintetizados pela primeira vez em 1928 por Thomas Midgley, Jr.da General Motors, como produtos químicos mais seguros para frigoríficos usados em grandes aplicações comerciais. Frigidaire foi emitida a primeira patente, número 1.886.339, para a fórmula Para CFC em 31 de dezembro de 1928. Em 1930, a General Motors e a Du Pont formaram A Kinetic Chemical Company para produzir Freon (um nome Du Pont Para CFC) em grandes quantidades. Em 1935, a Frigidaire e os seus concorrentes tinham vendido 8 milhões de novos frigoríficos nos Estados Unidos utilizando Freon-12 (CFC-12) fabricados pela Kinetic Chemical Company e pelas empresas licenciadas para fabricar este composto. Em 1932, a Carrier Engineering Corporation usou o Freon-11 (CFC-11) na primeira unidade de ar condicionado independente do mundo, chamada de “Gabinete atmosférico”.; Por causa do registro de segurança CFC para a não-toxicidade, Freon tornou-se o refrigerante preferido em grandes sistemas de ar condicionado. Códigos de saúde pública em muitas cidades americanas foram revistos para designar Freon como o único refrigerante que poderia ser usado em edifícios públicos. Após a Segunda Guerra Mundial, CFC foram usados como propulsores para sprays de insetos, tintas, condicionadores de cabelo e outros produtos de saúde. Durante o final da década de 1950 e início da década de 1960, o CFC tornou possível uma solução barata para o desejo de ar condicionado em muitos automóveis, casas e edifícios de escritórios. Mais tarde, o crescimento do uso de CFC decolou em todo o mundo com pico, vendas anuais de cerca de um bilhão de dólares (EUA) e mais de um milhão de toneladas métricas de CFC produzidos. enquanto os CFC são seguros de usar na maioria das aplicações e são inertes na atmosfera inferior, eles sofrem uma reação significativa na atmosfera superior ou estratosfera. In 1974, two University of California chemists, Professor F. Sherwood Rowland and Dr. Mario Molina, mostrou que os CFC podem ser uma grande fonte de cloro inorgânico na estratosfera após a sua decomposição fotolítica por radiação UV. Além disso, parte do cloro libertado se tornaria ativo na destruição do ozônio na estratosfera 2. O ozônio é um gás residual localizado principalmente na estratosfera (ver ozônio). O ozono absorve radiação ultravioleta nociva nos comprimentos de onda compreendidos entre 280 E 320 nm da banda UV-B, que pode causar danos biológicos em plantas e animais. A perda de ozono estratosférico resulta numa radiação UV-B mais nociva que atinge a superfície da Terra. O cloro libertado dos CFC destrói o ozono em reacções catalíticas, onde 100 000 moléculas de ozono podem ser destruídas por átomo de cloro.
uma grande depleção da camada de ozônio estratosférico estava piorando a cada ano seguinte. Esta perda de ozono foi descrita em 1985 pelo investigador britânico Joe Farman e pelos seus colegas (3). Foi chamado de ìthe Ozônio Antártico holeî por outros. O buraco de ozônio era diferente da perda de ozônio nas latitudes médias. A perda foi maior sobre a Antártida do que as latitudes médias por causa de muitos fatores: as temperaturas invulgarmente Frias da região, o isolamento dinâmico desta ìholeî, e as reacções sinérgicas do cloro e bromine4. A perda de ozônio também é aumentada em regiões polares como resultado de reações envolvendo nuvens estratosféricas polares (PSCs)5 e em latitudes médias após erupções vulcânicas. A necessidade de controlar os CFC tornou-se urgente. em 1987, 27 nações assinaram um tratado ambiental global, O Protocolo de Montreal para reduzir as substâncias que empobrecem a camada de ozônio 6, que tinha uma disposição para reduzir os níveis de produção destes compostos em 1986 em 50% antes do ano 2000. Este Acordo Internacional incluía restrições à produção de CFC-11, -12, -113, -114, -115, e os Halons (produtos químicos utilizados como agentes extintores de incêndio). Uma alteração aprovada em Londres em 1990 foi mais enérgica e apelou à eliminação da produção até ao ano 2000. Os solventes clorados, o metilclorofórmio (CH3CCl3) e o tetracloreto de carbono (CCl4) foram acrescentados à alteração de Londres.
Grandes quantidades de reativos estratosférico de cloro na forma de monóxido de cloro (ClO), que só poderia resultar da destruição do ozônio pelo Cfc na estratosfera, foram observados por instrumentos a bordo da NASA ER-2 aeronaves e UARS (Upper Atmospheric Research Satellite) sobre algumas regiões da América do Norte durante o inverno de 19927,8. A preocupação ambiental para os CFC decorre da sua longa vida útil na atmosfera (55 anos para os CFC-11 e 140 anos para os CFC-12, CCl2F2)9, o que limita a nossa capacidade de reduzir a sua abundância na atmosfera e a consequente perda futura de ozono. Isso resultou na alteração de Copenhague que ainda mais limitada produção e foi aprovado mais tarde em 1992. A fabricação destes produtos químicos terminou na maior parte em 1 de janeiro de 1996. As únicas exceções aprovadas foram para a produção nos países em desenvolvimento e para algumas aplicações isentas em medicina (ou seja, inaladores para asma) e pesquisa. O protocolo de Montreal incluía disposições de aplicação através da aplicação de sanções económicas e comerciais no caso de um país signatário comercializar ou produzir esses produtos químicos proibidos. Um total de 148 países signatários assinaram agora o protocolo de Montreal. Medições atmosféricas CFC-11 e CFC-12 relatadas em 1993 mostraram que as suas taxas de crescimento estavam a diminuir em resultado de reduções voluntárias e obrigatórias das emissões9. Muitos CFC e solventes clorados seleccionados estabilizaram (Figura 1) ou diminuíram em concentração até 19949,10.
A Procura de CFC foi acomodada pela reciclagem e reutilização das existências existentes de CFC e pela utilização de substitutos. Algumas aplicações, por exemplo, desengorduramento de metais e solventes de limpeza para placas de circuitos, que uma vez usado CFC agora usam fluidos sem halocarbono, água (às vezes como vapor), e ácidos cítricos diluídos. A indústria desenvolveu duas classes de substitutos de halocarbono – os hidroclorofluorocarbonetos (HCFC) e os hidrofluorocarbonetos (HFC). Os HCFC incluem átomos de hidrogênio, além de cloro, flúor e átomos de carbono. A vantagem do uso de HCFC é que o hidrogênio reage com hidroxila troposférica (OH), resultando em uma vida atmosférica mais Curta. O HCFC-22 (CHClF2) tem uma vida útil atmosférica de cerca de 13 anos e tem sido usado em ar condicionado doméstico de baixa demanda e algumas aplicações de refrigeração desde 1975. No entanto, os HCFC ainda contêm cloro, o que lhes permite destruir o ozono. A alteração de Copenhaga exige que a sua produção seja eliminada até ao ano 2030. Os HFC são considerados um dos melhores substitutos para a redução da perda de ozono estratosférico devido ao seu curto tempo de vida e à falta de cloro. Nos Estados Unidos, o HFC-134a é usado em todos os novos aparelhos domésticos de ar condicionado. Por exemplo, o HFC-134a está a crescer rapidamente em 1995 a uma taxa de crescimento de cerca de 100% por ano, com uma vida útil atmosférica de cerca de 12 anos 12. (A “regra de 90” também se aplica à fórmula química dos HCFC e HFC. o uso de CFC, alguns solventes clorados e Halons deve tornar-se obsoleto na próxima década se o protocolo de Montreal for observado por todas as partes e seus substitutos forem usados. A ciência que se tornou a base do Protocolo de Montreal resultou no Prêmio Nobel de Química de 1995. O prêmio foi concedido em conjunto aos professores F. S. Rowland at University of California at Irvine, M. Molina at the Massachusetts Institute of Technology, Cambridge, and Paul Crutzen at the Max-Planck-Institute for Chemistry in Mainz, Germany, for their work in atmospheric chemistry, particularly concerning the formation and decomposition of ozone (in particular, by the CFC and oxides of nitrogen).
1Midgley, T., and Henne, A., Organic fluorides as refrigerants, Industrial and Engineering Chemistry, 22, 542-547, 1930.
2Molina, M. J., E F. S. Rowland, lavatório estratosférico para clorofluorometanos: Átomo de cloro catalisou a destruição do ozono, Nature, 249, 810-814, 1974.
3Farman, J. C., B. G. Gardiner, and J. D. Shanklin, Large losses of total ozone in Antarctica reveal seasonal ClOx / NOx interaction, Nature, 315,207-210, 1985.
4McElroy, M. B., R. J. Salawitch, S. C. Wofsy, e J. A. Logan, Reduções de ozônio Antártico, devido a interações sinérgicas de cloro e bromo, Natureza, 321, 759-762, 1986.
5Solomon, S., R. R. Garcia, F. S. Rowland, and D. J. Wuebbles, On the depletion of Antarctic ozone, Nature, 321, 755-758, 1986. 6montreal Protocol on Substances that Deplet the Ozone Layer, 15 pp, United Nations Environmental Programme (UNEP), New York, 1987.
7Toohey, D. W., L. M. Avallone, L. R. Lait, P. A. Newman, M. R. Schoeberl, D. W. Fahey, E. L. Woodbridge, e J. G. Anderson, A evolução sazonal do reativo de cloro no hemisfério norte estratosfera, a Ciência, 261, 1134-1136, 1993.
8Waters, J., L. Froidevaux, W. Read, G. Manney, L. .Elson, D. Flower, R. Jarnot, and R. Harwood, Stratospheric ClO andozone from the Microwave Limb Sounder on the Upper Atmosphere Research Satellite, Nature, 362, 597-602, 1993.
9Elkins, J. W., T. M. Thompson, T. H. Swanson, J. H. Butler, B. D. Hall, S. O. Cummings, D. A. Fisher, e A. G. Raffo, Diminuição nas taxas de crescimento das atmosférica clorofluorocarbonos 11 e 12, a Natureza, 364 , 780-783, 1993.
10Prinn, R. G., R. F. Weiss, B. R. Miller, J. Marques, F. N. Alyea, D. M. Cunnold, P. J. Fraser, D. E. Hartley, e P. G. Simmonds, Atmosférica tendências e vidas de CH3CCl3 e global OH concentrações, Ciência, 269, 187-192, 1995.
11Montzka, S. A., R.C. Myers, J. H. Butler, S. C. Cummings, e J. W. Elkins, Global troposférico, de distribuição e de calibração de escala de HCFC-22, Geophysical Research Letters, 20 (8), 703-706, 1993.
12Montzka, S. A., R.C. Myers, J. H. Butler, J. W. Elkins, L. T. de Bloqueio, A. D. Clarke, e A. H. Goldstein, de Observações de HFC-134a em remoto troposfera, Geophysical Research Letters, 23, 169-172, 1996.
Suggested Additional Reading:
Cagin, S., and P. Dray, Between Earth and Sky: How CFC changed our world and threatened the ozone layer, 512 pp., Pantheon Press, New York, 1993.
Scientific Assessment of Ozone Depletion: 1994, edited by D. L. Albritton, R. T. Watson, and R. J. Aucamp, 37, 451 pp., Organização Meteorológica Mundial( OMM), Genebra, 1995.
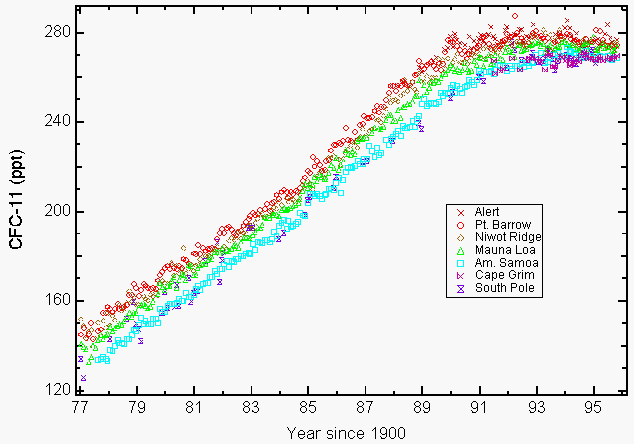
Figura 1: O acúmulo de clorofluorcarbono-11 (CFC-11) na atmosfera níveis de fora, como resultado de voluntários e compulsórios de reduções de emissões. Média mensal reportada como rácios de mistura seca em partes por trilião (ppt) para CFC-11 ao nível do solo para quatro estações NOAA/CMDL (Pt. Barrow, Alasca; Mauna Loa, Havai; Cape Matatula, Samoa Americana e Pólo Sul) e três estações cooperativas (Alert, Northwest Territories, Canada( Atmospheric Environment Service); Niwot Ridge, Colorado (University of Colorado); Cape Grim Baseline Air Pollution Station, Tasmania, Austrália, (Commonwealth Scientific and Industrial Research Organization) 9. (Cortesia de NOAA / CMDL)
Leave a Reply